
干扰素(interferon,IFN)具有广谱抗病原微生物与抗增殖的生物学效应。干扰素通路的激活可以引发上百个干扰素诱导基因的表达,进而引发细胞一系列的生物学效应。鸟苷酸三磷酸酶蛋白家族为干扰素诱导的一类蛋白,包括4个亚蛋白家族:MX蛋白亚家族 (Myxovirus-resistant proteins)、VLIG蛋白亚家族(Very large inducible GTPase)、IRG蛋白亚家族(p47immunity-related GTPases)及GBP蛋白家族 (p65 guanylate-binding pro-teins)。干扰素诱导及病原微生物感染都可以诱导这四类蛋白大量表达。研究表明,MXs蛋白可以抑制多种病毒复制,IRGs和VLIGs具有抑制多种病原微生物的功能。GBPs也被发现广泛地参与着抗病原微生物和抗肿瘤等多种生物学反应。
GBP家族蛋白是分子量约为65~67kD,蛋白结构由N端球状GTP酶活性区、C端α调节区及连接N端 与C端的连接区组成。GBPs具 有GTP水解酶活性,可以水解GTP为GDP和GMP。现在已经发现的人类GBP蛋白有7种(hGBP1~hGBP7),小鼠GBP蛋白有11种 (mGBP1~mGBP11)。GBP1作 为研究最为透彻的一类GBP,已经被报道在机体的多个生物学效应方面发挥着重要功能。
1、 GBP1的分子结构与生物学活性
鸟苷酸结合蛋白1(Guanylate-binding protein1,GBP1)为一类发动蛋白,但是GBP1与其他发动蛋白相比具有着不同的特点,其为单体蛋白,可以与GTP、GDP和GMP结合,并且与三者的结合能力相同。GBP1可以通过两个连续的过程将GTP分别水解为GDP和GMP。人类GBP1基因位于1号染色体上,ORF全长为1 779bp。GBP1蛋白由593个氨基酸构成,蛋白分子量为67kD;其中1~278位为球状GTP酶活性区,279~312为连接区,313~593位为GTP酶效应区。
hGBP1的181~184氨基酸被鉴定为TLRD序列,参与鸟苷酸结合。由于TLRD序列的存在,hGBP1能够水解GTP形 成GDP和GMP,其中GMP为主要的水解产物。这与GBP家族中的hGBP2不同,hGBP2也可以将GTP水解为GDP和GMP,但是主要水解产物为GDP。而hGBP1蛋白在法尼基化后与脂质物结合后,其水解特性也会发生变化。
hGBP1在特定的条件下被法尼基化后可以与胞内膜相互作用。细胞在利用铝氟化合物处理后,hGBP1在脂修饰后可以与其他干扰素诱导蛋白一同存在于高尔基体区。研究人员对法尼基化hG-BP1的作用及其与脂质体膜对GTP酶功能的影响进行了研究。为了获得法尼基化的hGBP1,法尼酰基转移酶α和β与hGBP1质粒被同时转染到细菌内进行表达。法尼基化的hGBP1与未法尼基化的hGBP1可以被显著的分开,进行特性比较。脂质修饰的hGBP1在GDP*AlFx(模拟转运状态)的存在下可以与脂质体结合,未经脂质修饰的hGBP1即使在具有GDP*AlFx的条件下也不能与脂质体结合。这表明hGBP1与胞膜结合同时需要脂质修饰和转运状态两种条件。经过修饰和未经修饰的hGBP1均具有二聚体化和多聚体化形成的特点和能力。但是在存在有脂质体的环境中,修饰化的hGBP1具有比未修饰的hGBP1两倍高的二聚体形成能力。修饰化的hGBP1与未修饰的hGBP1最高GTP酶活性是相同的。然而在有脂质物存在的情况下,修饰化的hGBP1催化的GMP形成率由85%下降了到30%,这是由于脂质物对hGBP1进行了修饰而改变的。因此脂质修饰或者与脂质膜作用可以改变hGBP1的酶活性,其水解GTP的主要产物将会变为GDP。
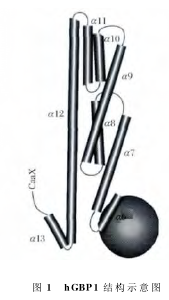
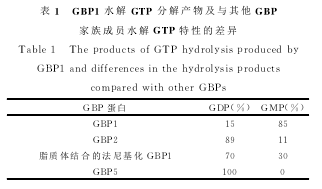
基于认识到GMP与GDP均为hGBP1的水解产物,而且在所有的GBP蛋白中GTP结合区域极为保守,因此推论所有的GBP均可以水解GTP同时形成GMP和GDP。但是后期人们发现hGBP5却只能将GTP水解为GDP而不能形成GMP。不同GBP家族蛋白的水解特性见表1。hGBP1具有迅速解离的特点,和其他GTP水解酶相比,其与GTP的亲和力要显著小于其他GTP水解酶 与GTP的亲和力,例如Ras酶和Ga酶。游离的未结合核苷酸状态下的hGBP1晶体结构已经被解析出来。在hGBP1的N端具有一个致密的球形LG结构域。
LG结构域之后为狭长延伸的α螺旋。
LG结构域与C末端通过一个α螺旋和两个β折叠的短的中间区连接在一起。α螺旋结构域可以被分为两个α螺旋亚结构域。5个α螺旋依次位于LG结构域的远侧。这些α螺旋通过一个转角区使得α12螺旋结构域重复靠近LG区。hGBP1整体结构类似棒状,蛋白长度约为130?。hGBP1结构示意图见图1。
对游离状态下不与GTP结合的hGBP1结构解析完成后,研究人员进一步对与GTP结合状态下的hGBP1结构进行了研究。hGBP1与GTP类似物GppNHp(5'-鸟苷酰亚氨基二磷酸)在共存状态下,hGBP1的结构具有了新的特点,虽然其Mg2+配位方位和P环方位与Ras及异源三聚体G蛋白类似,但是其与鸟苷酸基团的结合的方位和角度则与Ras等蛋白截然不同。其他的GTP酶中的N端鸟苷酸糖苷键均具有一致保守的角度,而hGBP1则与这些GTP酶不同。
2、 hGBP1抗病原微生物的特性
Ⅰ型干扰素在抑制多类病毒的复制过程中发挥着重要功能,Ⅱ型干扰素则在发挥抗胞内菌和寄生虫方面发挥着不可缺少的作用。IFN-α、IFN-β、IFN-γ、IL1α、IL1β、TNF-α和LPS均能够诱导GBP1的表达。而这些细胞因子均在宿主抗病原微生物中发挥着重要作用。因而深入研究GBP1是否参与宿主抵御病原微生物感染由此开展开来。
hGBP1最早被报道具有抑制负链RNA弹状病毒水泡性口炎病毒(VSV)及正链小RNA病毒科的脑心肌炎病毒(EMCV)。而小鼠的GBP1(mGBP1)也被发现具有同样的抗病毒效应。介于hGBP1的具有抗病毒效力,其被认为是一个重要的干扰素诱导蛋白。过表达hGBP1,可以显著抑制丙肝病毒(HCV)复制子的复制,抑制效率可以达到40%。而且HCV复制子在Huh7细胞中复制时可以抑制hGBP1的酶活性。
hGBP1在HEK-293T细胞中可以与HCV NS5B直接结合,HCV NS5B与hGBP1的结合直接抑制了hGBP1的酶活性,这或许是HCV拮抗hGBP1所发挥的抗病毒能力的一种表现,但是hGBP1具体如何发挥抑制HCV的机制仍不是很清楚。GBP1同时被报道具有抑制柯萨奇病毒、流感病毒和登革热病毒复制的能力。我们前期研究发现,流感病毒的感染可以显著引发hG-BP1的表达,hGBP1过表达可以抑制流感病毒的复制,而GBP1的GTPase活性是其发挥抗流感所必需的。流感病毒NS1蛋白可以与hGBP1蛋白相结合,抑制GTPase活性,进而拮抗hGBP1介导的抗病毒能力。登革热病毒感染过程中,GBP1同样大量表达沉默下调表达GBP1后,登革热病毒在细胞内的复制能力显著上升,而且NFκB的活性显著下降,GBP1可能是通过影响NFκB的活性而发挥着重要的抗病毒作用。这些结果表明GBP1可以通过不同方式发挥抗病毒作用,在不同病毒感染过程中机制可能不同,而其GTPase在其发挥抗病毒作用过程中具有重要意义。
hGBP1的抗病毒能力是当前研究的一个热点,其在抗细菌和寄生虫以及衣原体方面的研究也同样取得了很大的发现。hGBP1被报道具有抑制单核细胞增生李氏杆菌复制的能力。单核细胞增生李氏杆菌是一种重要的人畜共患和食源性疾病的病原菌,可引发宿主动物发生脑膜炎、败血症、流产或局部感染等疾病。李氏杆菌主要寄生于宿主细胞为肠内上皮细胞。李氏杆菌在感染过程中首先通过吞噬体进入细胞,为了逃脱溶酶体发挥的杀菌效应,其后续通过特定途径进入细胞质进行复制。而在李氏杆菌复制的过程中,研究同样发现小鼠肝脏和脾脏内的GBP1mRNA的表达显著升高,而对巨噬细胞进行小RNA干扰下调表达GBP1后发现李氏杆菌的复制能力显著上升;同样构建GBP1基因缺失小鼠,感染李氏杆菌后,李氏杆菌在GBP1缺失小鼠体内的感染能力及病变情况显著高于GBP1野生型小鼠。这说明GBP1在参与机体抵御李氏杆菌的过程中发挥着重要的作用。进一步研究发现GBP1发挥抗李氏杆菌的机制是增强氧化杀伤能力及促进运送抗菌肽至自噬体内发挥杀菌效应。而且该机制使得GBP1具有广谱抗胞内菌的能力。
hGBP1同样被发现具有抑制衣原体复制的功能。衣原体是一种在自然界分布广泛的革兰氏阴性专性胞内寄生菌。衣原体中不同的血清型感染宿主时具有不同的特点,有些血清型的衣原体单纯感染眼部组织,有些血清型的衣原体单纯感染生殖系统。衣原体广泛寄生于哺乳动物和鸟类,绝大多数无致病性,仅少数有致病性。致病性衣原体感染可引起沙眼、结膜炎、生殖道系统炎症、不孕不育及肺炎等病症。hGBP1被报道具有抑制衣原体复制的能力,其抑制的机制主要是通过IFN-γ诱导hGBP1而发挥效应的。在HeLa细胞内转染过表达hGBP1后,感染衣原体,结果发现hGBP1分布于衣原体形成的空泡囊膜区域,这种定位并不需要hGBP1的GTP结合区域,而是需要hGBP1的C端α螺旋结构,该结构中包含有与脂质物作用的CaaX位点。
hGBP1和hGBP2均具有抑制衣原体复制的能力,这种抑制能力不需要hGBP1发挥其GTP酶活性。这些发现证明了hGBP1在IFN-γ介导的抗衣原体过程中发挥着重要作用。hGBP1还被发现具有抑制刚地弓形虫在胞内生长的特性。刚地弓形虫是一种胞内寄生原生动物,其可以引起人和动物的弓形虫病,可造成孕妇流产、早产、畸胎或死胎,畸胎发生率明显增高。新生儿出生后形成畸形发育及病死率可达12%。
研究发现弓形虫感染小鼠后,可以显著上调mGBP1的表达。小鼠细胞在感染弓形虫30分钟后,在纳虫空泡附近可以发现大量的GBP1聚集。
ROP16、ROP18和GRA15三种虫体蛋白可以影响mGBP1在纳虫空泡的聚集,GBP1的法尼基化和GTP酶活性在这种聚集过程中并不是必须的,因为GBP1的48位突变和51突变均不影响GBP1的这种定位,而GBP1中仅有15%的GBP1被法尼基化。研究同时发现GBP2和GBP5也可以定位于纳虫空泡附近。GBP1的这种聚集有可能增加了纳虫空泡被细胞吞噬和降解,促进细胞的自身免疫。
3、 GBP1在内皮细胞中发挥的作用
GBP1在内皮细胞中发挥的生物学活性研究引起了很大关注,因为GBP1在内皮细胞的生长分化及细胞迁移等多个生理学过程中发挥着重要功能。
虽然GBP1在内皮细胞中发挥着重要作用,但是通常情况下,正常皮肤的内皮细胞中却检测不到GBP1的表达,只有在皮肤上形成了卡波西氏肉瘤或者皮肤受到炎性疾病等各类应激后,GBP1的表达量才会显著上升,如皮肤受到有害药物刺激或者形成皮肤癣后,皮肤内皮细胞中的GBP1则会大量表达。介于上述研究结果,研究者提出GBP1可以作为一类皮肤炎性疾病的预警指示分子。
IFN-α处理培养的人脐静脉内皮细胞和表皮微血管内皮细胞时也可以诱导大量的GBP1的表达。
IFN-α在人脐静脉内皮细胞中诱导GBP1的能力弱于IFN-γ对GBP1的诱导能力。利用IFN-α处理人脐静脉内皮细胞5h,GBP1mRNA在诱导2h后开始表达,然后在5h内不断持续表达,但是在18h后GBP1的mRNA表达水平降低到未诱导前的水平。而用IFN-γ对人脐静脉内皮细胞处理5h后,GBP1的mRNA持续诱导能力可以持续长达96h。
内源性IFN-α刺激或外源其他刺激可以促进人脐静脉内皮细胞中GBP1的大量表达,GBP1的大量表达可以促进脐静脉内皮细胞对血清和生长因子的获得。但是在含有血清和生长因子进行体外培养的脐静脉内皮细胞培养液中加入IFN-α可以促进细胞的衰老。基于以上的研究结果,研究者认为IFN-α的抗血管形成能力是由IFN-α诱导内皮细胞的衰老而导致的,而并非通过诱导细胞凋而发挥抗血管形成能力。
4、 GBP1抗肿瘤形成的能力
鉴于GBP1具有抑制血管形成的能力,以及抑制生长因子诱导的内皮细胞的增殖,而且有研究发现在结肠直肠癌组织中会有大量的GBP1表达。这暗示了GBP1或许与癌症之间具有一定的联系。而有研究结果证实了这种潜在的联系,证明了GBP1所介导的抗肿瘤形成能力。研究通过对388份结肠直肠癌组织进行了检测,结果发现32%的样品中GBP1都具有大量的表达,GBP1主要表达在基质中,而并非主要表达于癌症细胞中。16.2%GBP1高表达患者生存时间比GBP1低表达患者平均可长达5年之久。这预示了GBP1潜在的抗肿瘤能力,因此GBP1或许可以被用来作为结肠癌发生的一种预警信号。
为了进一步研究GBP1与癌症的关系,Karo-line等人将GBP1构建到一个不依赖于IFN诱导的表达载体中,然后将重组载体转染小鼠乳腺癌细胞(TS/A细胞),通过整合筛选获得了可特异性诱导表达GBP1的TS/A细胞系。将该特异性诱导GBP1的TS/A细胞系移植入同品系Balb/c小鼠。
结果发现,利用特异性刺激(多 西环素)诱导使GBP1大量表达后,受体小鼠体内的肿瘤形成明显被抑制,而不加刺激的则很快形成肿瘤。这充分表明了GBP1具有抑制肿瘤形成的能力。免疫组化分析结果证实了受体小鼠体内GBP1的大量表达。
同时研究发现在GBP1诱导表达的过程中,浸润淋巴B细胞和T细胞的数量并无明显变化,这表明GBP1介导的肿瘤抑制并不是通过特异性T细胞免疫反应或B细胞免疫反应来完成的。而进一步检测发现GBP1大量表达组小鼠肿瘤组织内血管内皮生长因子A(VEGF-A)的表达量显著低于对照组,这表明GBP1或许通过抑制旁分泌的方式抑制肿瘤形成。而因此GBP1也被认定可能是机体先天性抗肿瘤系统中的重要一员。这也说明IFN-γ对肿瘤的抑制有一部分过程可能是通过诱导GBP1表达来发挥的。
5、 GBP1的其他特性
GBP1除了上述抑制多种病原体复制、抑制弓形虫复制、抑制内皮细胞分化和迁移及抑制肿瘤形成的功能外,还具有一些其他的特性。GBP1具有抑制细胞增殖的能力,GBP1通过促进碱性成纤维细胞生长因子和血管内皮生长因子的结合来发挥抑制内皮细胞增殖的作用。这个抑制过程仅依赖hGBP1的C末端α螺旋,而不需要球状GTP结合功能域。GBP1可以抑制内皮细胞基质金属蛋白酶1的表达。
GBP1或许是IL-1β、TNF-α及IFN-γ发挥抑制细胞基质金属蛋白酶1表达的效应分子。GBP1的GTP酶活性区是其发挥这种抑制能力所必需的。与抑制内皮细胞细胞基质金属蛋白酶1作用相同,在以胶原酶Ⅰ和胶原酶Ⅳ为底物的条件下,表达GBP1可以显著抑制内皮细胞的迁移。这表明GBP1可以抑制这些细胞的迁移。在高浓度的胶原酶Ⅰ作用下,GBP1高表达的内皮细胞其向四周的侵袭能力明显下降。
GBP1(D184N)突变体丧失了GTP酶活性,研究发现该突变体的高表达并不能抑制脐静脉内皮细胞中基质金属蛋白酶1的表达,而且该位点突变后,GBP1也丧失了抑制血管形成的能力。GBP1还可以抑制脐静脉内皮细胞通过纤连蛋白移动,调节肠上皮细胞屏障功能,保护细胞不发生凋亡的作用。
6 、结语与展望
GBP1作为一类重要的干扰素诱导蛋白,在宿主细胞内发挥着重要的生物学功能。通过对其抗病毒、抗细菌、抗寄生虫等方面的研究证实其具有广泛抑制外来病原微生物复制的能力。在不同病原微生物的感染过程中,其发挥抗感染作用的机制也不近相同,较为复杂。GBP1可以通过促进氧化杀伤能力、或促进抗病毒或抗菌肽类蛋白进入自噬体内,抑制病原微生物的复制。而通过对GBP1在内皮细胞与肠上皮细胞中的研究,以及通过在小鼠内过表达GBP1的实验,研究发现了GBP1的抗肿瘤能力。
尤其是通过对388份结肠直肠癌患者组织的分析,表明其在癌症临床表现上具有着重要的指示作用,或许可以被用作为结肠癌发生的一种预警信号。同时,Matthias Hammon等人研究发现GBP1在炎性疾病中,如风湿性免疫疾病中发挥着重要的作用,可以抑制炎性疾病的加剧。因此GBP1也可以作为炎性疾病的一个潜在分子标记。

GBP1在抵抗微生物感染及抑制肿瘤形成中发挥的重要作用,使得其近年来成为了基础研究领域中的一个热点。而其功能的广泛性也使得现在对GBP1的研究越来越深入。现在已经对GBP1的功能和特性有了很大的认识和进展(表2)。但是至今对于GBP1具体发挥的抗病毒机制及GBP1与内皮细胞分化和迁移的相互关系和详细机制仍不是特别清楚,有待于进一步深入研究。阐明GBP1发挥的这些功能机制,或许能够为宿主抗病毒、抗细菌、抗寄生虫以及抗肿瘤药物的研发提供新的视角和方法。





