
腹泻性贝毒 ( diarrhetic shellfish poisoning, DSP) 毒素是我国近海贝类产品中一类常见的毒素污染物,对我国贝类进出口贸易造成了一定的影响,同时也对水产品消费者的身体健康构成隐患。DSP 毒素主要由鳍藻属( Dinophysis) 和原甲藻属( Prorocentrum) 中的 10 种有毒甲藻产生,分别为鳍藻属中的倒卵形鳍藻( D. fortii) 、渐尖鳍藻( D. acuminata) 、尖锐鳍藻( D. acuta) 、D. norveg-ica、D. mitra、圆形鳍藻( D. rotundata) 、D. triposs和原甲藻属中的利玛原甲藻( P. lima) ,凹形原甲藻( P. maculosum) 和 P. redfieldi。此外,鳍藻属中的 D. caudata、D. hastata、D. sacculus、D.ovum和微小原甲藻( P. minimum)也有可能产生 DSP 毒素。很多学者认为鳍藻属中的有毒藻种是贝类中 DSP 毒素的主要来源。
海水中的鳍藻细胞密度通常较低,但即便是低至 100/L 的鳍藻细胞密度也会导致贝类染毒; 而且,大部分鳍藻种类的室内培养非常困难,因此,有关鳍藻产毒状况的研究工作一直难以开展。2006 年,韩国学者 Park首次报道了在实验室内成功培养渐尖鳍藻的方法,解决了鳍藻研究的瓶颈问题。在这一工作的基础上,针对多种鳍藻的产毒特征及其影响因素进行了分析。但是,这种培养方法需要构建复杂的食物链,到目前为止我国尚未见有成功培养鳍藻的报道。因此,对我国沿海鳍藻的产毒状况一直缺乏了解。
有学者应用高效液相色谱-质谱联用( highperformance liquid chromatography-mass spectrome-try,LC-MS) 方法,对含有大量鳍藻的网采浮游植物样品进行分析,能够检测到大田软海绵酸( oka-daic acid,OA)、鳍藻毒素( dinophysistoxins,DTXs)和扇贝毒素 ( pectenotoxins,PTXs)等毒素成分。考虑到 LC-MS 方法本身灵敏度高,可以尝试针对手工挑取的鳍藻细胞进行毒素分析,从而了解特定鳍藻的产毒情况。基于此,本文尝试建立了高灵敏度的 LC-MS 分析方法,从青岛近海团岛湾的浮游植物样品中手工挑取了渐尖鳍藻细胞,并应用所建立的方法,对渐尖鳍藻中的毒素成分进行了提取和分析。
1、 材料与方法
1. 1 LC-MS 分析方法的建立
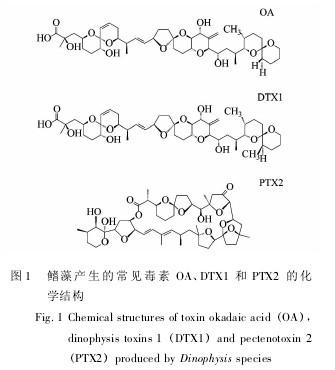
实验所用试剂均为色谱纯试剂,甲醇和乙腈购买自 Merck 公司( 德国) ,甲酸购买自瑞士 Flu-ka 公司,甲酸铵购买自美国 Sigma-Aldrich 公司,分析用水为经 Millipore 纯水系统净化的超纯水。OA 和 PTX2 标准毒素购自加拿大国家研究院海洋生物科学实验室,DTX 1 标准品购自日本 WA-KO 公司,其化学结构如图 1 所示。
实验所用的高效液相色谱系统为美国安捷伦( Agilent,USA) 1200 系列,带有二元梯度泵和自动进样器。质谱系统为美国应用生物公司制造的三重四级杆串联质谱系统( API 4000,Applied Bio-systems,Foster City,CA,USA) ,联接接口为电喷雾电离( electrospray ionization,ESI) 源。采用的色谱柱为 Agilent Eclipse XDB-C18( 5 μm,4. 6 mm× 150 mm) 反相色谱柱,购自美国安捷伦公司。
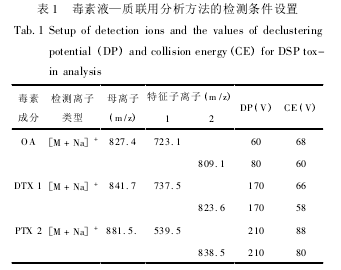
实验所用的流动相设计参照 Hackett 等的方法,该方法对 DSP 毒素有很好的分离效果。流动相 A 为95%乙腈,流动相 B 为100%超纯水,两者都含有 50 mmol/L 甲酸和 2 mmol/L 甲酸铵,等梯度洗脱比例为 A: B =95∶ 5,流速 400 μL/min,进样量 20 μL。分别采用高浓度 OA、DTX1 和PTX2 标准毒素溶液,通过流动注射分析( flowinjection analysis,FIA) 对质谱进行调谐,优化质谱检测器的参数。经流动注射分析发现,3 种标准毒素均以[M + Na]+形式存在的离子丰度最高,因此在定量分析中主要检测 [M + Na]+离子。检测模式采用阳离子模式下的多反应检测方式( multiple reaction monitoring,MRM) ,检测离子及调谐后的相应去簇电压 ( declustering poten-tial,DP) 和碰撞能( collision energy,CE ) 如表 1所示。
使用标准品调谐后的质谱参数为: 电喷雾电压 5 500 V,气帘气压力10 Pa,雾化气压力60 Pa,加热辅气压力 40 Pa,离子源温度 550 ℃,电子倍增管电压 2 200 V,偏转电压-200 V,碰撞气压力 6Pa,入口电压 10 V,出口电压 10 V。
将 DSP 毒素混合标准品用 80% 甲醇水溶液稀释,得到 5 个不同浓度梯度的系列标准,用于绘制方法标准曲线。选择其中两个不同浓度的混合标准品重复进样 3 次,计算其峰面积和峰高的变异系数,查看方法的精密度。根据标准品色谱峰峰高和噪音基线信号,计算信噪比为 3 时的理论检出限。
1. 2 不同毒素提取方法的回收率比较
由于鳍藻样品难以获得,在本部分实验中,采用添加了毒素标准品的其它藻类样品来比较不同方法对毒素的提取效率。藻类样品选用的是不含DSP 毒素的卡盾藻( Chattonella sp. ,分离自烟台四十里湾海域) ,该藻藻细胞比较大,便于进行显微镜下挑取。每个方法设置高、低两个毒素添加水平组,各组设置 3 个重复。低水平毒素添加组添加 OA 总量为110 pg,DTX1 120 pg,高水平毒素添加组添加 OA 总量为 1 100 pg,DTX1 1 200 pg。
1. 2. 1 甲醇直接提取法
在倒置显微镜( 江南 XD-101) 下用玻璃毛细管挑取卡盾藻细胞活体,在干净载玻片上用消毒海水反复冲洗 2 ~3 次,最后挑取到 2 mL 过滤离心管( 带有孔径为 0. 22 μm 的尼龙膜,美国康宁公司) 内管滤膜上,每个离心管中放置 30 个藻细胞,并加入标准毒素,直接加入 60 μL 80%甲醇水溶液进行提取后,放置到冷冻离心机中( Sigma 3-18K,美国) ,于 4 ℃ 12 000 r / min 转速下离心 10min,将过滤离心管下部收集的过滤液转移到 150μL 样品瓶内衬管 ( 美国 Waters 公司) 中,-20 ℃下冷冻保存待分析。
1. 2. 2 氮气吹干浓缩法
如 1. 2. 1 中所述方法,将藻细胞挑取到过滤离心管内管滤膜上,添加入标准毒素,加入 1 mL100% 甲醇进行提取,在冷冻离心机中于 4 ℃12 000 r / min 转速下离心 10 min,将提取液转移到 5 mL 棕色样品瓶中,在氮气吹干仪( DSY-II 型自动快速浓缩仪,北京金科精华苑技术研究所)下吹干,用60 μL 80%甲醇水溶液重新溶解后,转移到 150 μL 样品瓶内衬管中,-20 ℃下冷冻保存待分析。
1. 2. 3 固相萃取( solid-phase extraction,简称SPE) 法
将 30 个卡盾藻细胞挑取到 500 mL 灭菌海水中,添加入毒素标准品。选用 Oasis?HLB 固相萃取小柱( 1 cc,30 mg,Waters 公司,美国) 进行固相萃取,除去盐和杂质。固相萃取小柱事先用 3 mL甲醇和3 mL 超纯水进行活化和平衡,然后加入样品,用 5 mL 超纯水冲洗,最后用 3 mL 100% 甲醇将毒素从萃取小柱上冲洗到5 mL 棕色样品瓶中,在氮气吹干仪下吹干,用 60 μL 80% 甲醇水溶液重新溶解后,转移到 150 μL 样品瓶内衬管中,-20℃ 下冷冻保存待分析。
运用所建立的 LC-MS 方法,对经上述 3 种毒素提取方法获得的提取液进行分析,根据实际检测出的毒素含量和毒素添加含量的比值计算回收率,并进行比较。
1. 3 鳍藻细胞样品的采集和处理
鳍藻样品于 2009 年 4 月 30 日采自青岛团岛湾中苑码头( 36 $2'59″N,120 $17'49″E) 。用 20μm 的浮游植物网从水深 6 m 处垂直拖网多次,获得浮游植物浓缩样品,置于玻璃样品瓶中,快速送回实验室。样品先后经 200 μm 和 80 μm 筛绢过滤,去除浮游动物和其他大型藻类。用 20 μm筛绢浓缩样品,并用灭菌海水反复冲洗,除去悬浮物和泥沙,最后用灭菌海水将样品冲洗到干净玻璃烧杯中备用。
吸取样品 200 μL 置于计数板上,在倒置显微镜下对鳍藻样品进行观察,根据其形态学特征结合分子生物学方法( 未发表) 进行种类鉴定。用毛细玻璃管挑取同种鳍藻细胞,在干净载玻片上用灭菌海水冲洗 2 ~3 次,挑取到过滤离心管( 美国康宁公司,尼龙膜孔径为 0. 22 μm) 内管滤膜上,共放置 30 个细胞,-20 ℃下冷冻保存。
1. 4 鳍藻细胞毒素提取和分析
采用甲醇直接提取法,向盛有鳍藻细胞的离心过滤管内管中加入 60 μL 80% 的甲醇水溶液,静置 2 h ~3 h,离心后滤液直接用于 LC-MS/MS分析,进样量为 40 μL。
2、 结果与讨论
2. 1 DSP 毒素的 LC-MS 分析方法
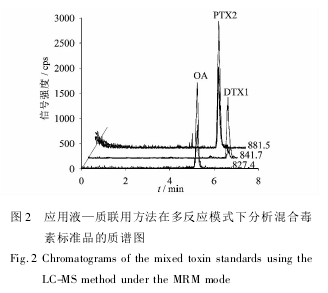
所用的 LC-MS 方法在阳离子模式下分析DSP 混合标准毒素的色谱图如图 2 所示。结果表明,所用的 C18 反相色谱柱对 OA、DTX1 和 PTX2毒素具有良好的保留效果,保留时间分别为 5. 24min,6. 37 min 和 5. 56 min。所建立的 LC-MS 方法检出限低,对 OA、DTX1 和 PTX2 的理论检出限( S/N = 3) 分别为 0. 24 ng/mL、0. 42 ng/mL 和0. 06 ng / mL。如果用该方法分析 30 个鳍藻细胞,则当单细胞毒素含量超过 0. 48 pg/cell( OA) ,0. 84 pg / cell( DTX1) 和 0. 12 pg / cell( PTX2) 时可以被检出。
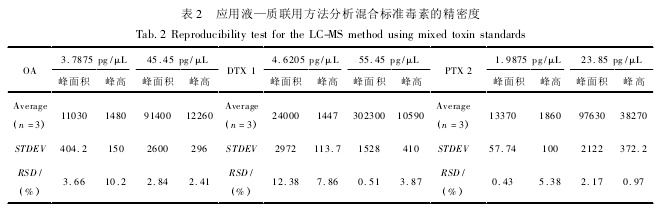
3 种标准毒素的浓度范围分别在( 3 ~ 90 )ng / mL( OA) 、( 4 ~ 110 ) ng / mL ( DTX1 ) 和( 2 ~47) ng / mL( PTX2) 之间时,毒素浓度与检测信号间有良好的线性关系( OA: R2= 0. 998 6; DTX: R2= 0. 995 1; PTX 2: R2= 0. 985 8) ,可以用于定性定量分析。将高、低两个浓度的毒素混合标准溶液在连续进样 3 次后,对峰面积进行比较分析可以看出,除了低浓度标准溶液中 OA 和 DTX1 的的峰面积变异系数大于 10% 以外,其他毒素成分的各浓度梯度色谱峰面积变异系数都小于 8%,表明该方法具有良好的精密度( 如表 2 所示) 。
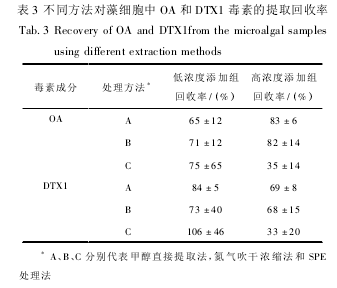
如表 3 所示,在低浓度标准毒素添加组中,甲醇直接提取法对 OA 的回收率略低于氮气吹干浓缩法和 SPE 处理法,但对 DTX1 的回收率比氮气吹干浓缩法高,平均回收率为 83%,而且相对稳定,标准偏差小。氮气吹干浓缩法对 OA 和 DTX1的回收率居中,但重复性差,标准偏差较大。而SPE 处理法的回收效果重复性欠佳。在高浓度标准毒素添加组中,甲醇直接提取法对 OA 和 DTX1的回收率均最高,且重复性好、效果稳定,标准偏差都在 10% 以内。氮气吹干浓缩法对 OA 和DTX1 的回收率居中,仍然存在重复性差、不稳定等现象。而 SPE 处理法的回收率最低,都在 40%以下。综合稳定性、回收率以及操作便捷性 3 个因素,甲醇直接提取法更适合于藻细胞中提取DSP 毒素。
由于鳍藻培养困难,以往对鳍藻产毒状况的研究多是针对网采浮游植物样品进行,通过分析浮游植物样品中的毒素成分和含量,结合样品中的鳍藻种类和细胞密度,对鳍藻产毒状况进行分析。但是,这一过程无法排除其他有毒藻类的干扰,也无法区分不同种类鳍藻的毒素组成和毒性状况。因此,充分利用 LC-MS 方法高灵敏度的优点,手工挑取鳍藻细胞进行毒素组成和含量分析,成为目前研究鳍藻产毒情况的重要手段。
应用这一方法,Fernández 等分析了西班牙加利西亚海域渐尖鳍藻和 D. caudata 中的毒素组成和含量。Suzuki 等对采自日本北海道海域的倒卵形鳍藻、渐尖鳍藻、D. mitra、D. norvegica、D. tri-pos、D. infundibulus 和圆形鳍藻产毒状况进行了研究。Fernández 等所用方法的检出限经换算约为( 1 ~2. 5) pg/cell( PTX2) 、( 2. 4 ~6) pg/cell( OA) 和( 2. 7 ~6. 75) pg/cell; Suzuki 等所建立的 LC-MS 方法对鳍藻细胞毒素的最低检出限( lowest detection levels,LDL; S/N =3) 为 2 pg/cell( DTX1) 和 20 pg/cell ( PTX2); Kamiyama 和Suzuki 在同年发表的另外一项研究中报道其方法检出 限 为 1. 2 pg/cell ( DTX1) 和 3. 2 pg/cell( PTX2)。对比上述研究报道可见,本研究建立的 LC-MS 方法灵敏度较高,可以满足鳍藻低密度情况下对相关毒素组成及含量的分析需求。方法的检出限和灵敏度一般受到仪器设备、色谱柱类型、流动相组成、洗脱条件、被分析物质纯化程度等多种因素的影响,故优化这些因素,例如应用灵敏度更高的飞行时间质谱、优化毒素提取纯化方法等,将进一步改善方法的检出限,从而实现对单个鳍藻细胞毒素组成与含量的分析。
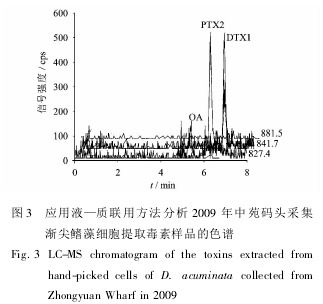
2. 2 渐尖鳍藻细胞的毒素成分与含量分析
经形态学观察,结合单细胞分子生物学方法鉴定,2009 年 4 月 30 日采集自青岛团岛湾中苑码头的鳍藻主要是渐尖鳍藻。从 30 个鳍藻细胞的提取液中检测到 OA,DTX1 和 PTX2 毒素,其保留时间与相应的标准品一致( 图 3) 。计算得到单个渐尖鳍藻细胞毒素含量分别为 2. 54 pg OA,4. 04 pg DTX1 和 1. 73 pg PTX2。其含量在以往国外文献报道的渐尖鳍藻毒素含量范围之内,表明青岛海域的渐尖鳍藻能够产生毒素。这也是目前所知对中国近海鳍藻能够产生腹泻性贝毒毒素的首次报道。
先前研究发现,鳍藻产生的毒素种类很复杂,包括 OA 及其二醇酯化合物,DTXs( 主要是DTX1 和 DTX2,部分鳍藻还能产生 DTX3,DTX4和 DTX5)和 PTXs( 主要是 PTX2,部分鳍藻还能产生 PTX1 及 PTX2 sa 毒素) 等。这些毒素成分中,除了有些能导致呕吐、腹泻效应以外,部分还具有高度肝毒性和细胞毒性,甚至导致癌变。因此,对鳍藻可能产生的所有毒素成分开展全面分析非常重要。但是,由于毒素标准品难以获取,本研究仅针对 OA、DTX1、PTX2 这几种文献报道的鳍藻常见毒素进行了分析。希望在将来的工作中,能够更加全面地分析中国海域鳍藻的产毒情况。
以往研究也表明,不同种类的鳍藻产毒状况具有一定差异,Lee 等应用高效液相色谱-荧光检测方法,对 1 000 个挑取的鳍藻细胞进行毒素分析,发现采自同一海湾( 日本 Mutsu 湾) 的倒卵形鳍藻含有 DTX1 和 PTX2,而 D. mitra 和圆形鳍藻中只含有 DTX1。即使是同一种鳍藻,产毒状况也会因为地理分布、季节不同而不同。在加拿大、法国和日本海域,渐尖鳍藻中检测到的主要毒素成分是 OA,而在西班牙近海,从渐尖鳍藻中检测到的毒素成分主要是 DTX2。Lee在日本海域的圆形鳍藻中检测到了高含量的 DTX1 毒素,而在北美的圆形鳍藻中则没有检测到任何毒素成分。虽然本研究在国内首次报道了中国海域鳍藻的产毒情况,但是,由于鳍藻的产毒特征存在种间、地域和季节差异,因此,对我国沿海不同海域、不同种类鳍藻细胞的毒素组成和含量进行长期跟踪分析,掌握其区域差异和季节变化特征,对于了解鳍藻的产毒规律及其对贝类的潜在影响具有重要意义。目前,相关工作已在进行中。
以往研究发现,青岛近海分布有多种鳍藻,其中,渐尖鳍藻是优势藻种。李萍在胶州湾海域发现了圆形鳍藻。李伟才等在胶州湾红岛附近的冒岛贝类养殖区和青岛四方至沧口一带的海水养殖区水域发现了渐尖鳍藻、倒卵形鳍藻和D. ovum,其中渐尖鳍藻密度最高,可达( 200 ~800) / m3; 在此期间经青岛口岸出口的贝类产品中,也有部分样品检出腹泻性贝毒毒性,检出率为5% ~ 6% 。Zhou 等应用小鼠生物测试法和高效液相色谱法,从青岛近海的菲律宾蛤仔( Venerupisphilippinarum) 中也检测到 DTX1 毒素,含量达54. 29 %g /100g 组织湿重。本研究首次确认了青岛近海分布的渐尖鳍藻能够产生腹泻性贝毒毒素,有可能是本地贝类中 DSP 毒素的重要来源。
因此,应加强对该海域渐尖鳍藻种群动态和毒性状况的监测和研究,防范食用染毒贝类引发的中毒事件。
3、 结 论
本研究针对 OA、DTX1 和 PTX2 等几种鳍藻产生的常见毒素成分,建立了毒素提取方法和高灵敏度的 LC-MS 分析方法,能够对 30 个鳍藻细胞进行毒素组成和含量分析。应用该方法,对于2009 年 4 月采自青岛团岛湾的渐尖鳍藻样品进行了分析,在样品中检测到 OA、DTX1 和 PTX2 三种毒素成分,每一藻细胞内 OA、DTX1 和 PTX2 毒素的平均含量分别为 2. 54 pg/cell,4. 04 pg/cell和 1. 73 pg/cell。这是关于我国沿海鳍藻产毒状况的首次报道。根据本文研究结果,建议相关部门加强对鳍藻种群动态和产毒状况的监测和研究,防范因养殖贝类染毒造成的中毒事件发生。





