
胞自噬(Cell autophagy)是广泛存在于真核细胞中的一种溶酶体(酵母、植物为液泡)依赖性降解途径,用于净化自身多余或受损细胞结构和大分子、促进生物大分子循环利用。细胞自噬过程中,首先是批量细胞质成分或细胞器被双层膜结构包围,形成自噬小体(Autophagosome),随后自噬小体外膜与溶酶体膜融合,将内膜及包围物质(自噬小泡,Autophagic body) 送入溶酶体腔进行消化。
ATG4 和 ATG8 是两个重要自噬相关基因 (Au-tophagy -related gene, ATG)。 ATG8 蛋白前体的 C端经具有半胱氨酸蛋白酶活性的 ATG4 酶切后暴露出保守的甘氨酸残基。此后,ATG8 经一个类泛素结合系统与脂类物质磷脂酰乙醇胺(PE)相连形成 ATG8-PE。ATG8-PE 定位于自噬膜上,对于自噬膜的装配、延伸、合拢及与液泡的融合过程都具有重要意义。ATG4 对 ATG8 的酶切加工是ATG8 进入类泛素连接系统的前提。ATG4 又能从ATG8-PE 和自噬膜上释放 ATG8,ATG8 从自噬膜上的释放是促进自噬小体成熟并成为可融合形式的重要环节。细胞自噬在进化过程中高度保守。植物上,拟南芥基因组分析发现了 36 个 ATG 基因,烟草、水稻、玉米、大豆和小麦等作物上 ATG基因的鉴定和分析也相继被报道。拟南芥上的研究表明,ATG4 和 ATG8 在植物细胞自噬中同样扮演了与酵母类似的重要角色。
细胞自噬与植物生长、发育及响应多种生物、非生物胁迫,包括营养缺乏、氧胁迫、盐胁迫、干旱胁迫和病原侵染等的反应过程密切相关。到目前为止,有关细胞自噬的分子机理和生理功能研究仍然仅限于拟南芥等模式物种上,在重要农作物尤其是小麦上的报道很少。本研究在前期成功克隆多个小麦重要 ATG 基因的基础上,构建了ATG4 和 ATG8 基因的原核表达载体,经大肠杆菌诱导表达和重组蛋白纯化过程获得了小麦ATG4和ATG8 的纯化重组蛋白,可为下一步体外酶活测定、抗体的制备和 Western 杂交等试验奠定基础。

1、 材料和方法
1.1 基因和载体
小麦自噬相关基因 TaATG4a 和 TaATG8h 由本实验室(天津市动植物抗性重点实验室)克隆。两个基因全长 cDNA 分别克隆于 pGEM-Teasy 载体上。原核表达载体 pET30a 由本实验室保存。
1.2 原核表达载体的构建
设计合成两端添加 NotⅠ识别位点的 PCR 引物 对 4aNOTI -F (ATAAGAATGCGGCCGCATGAC-GAGCTTGCCTGAGAG)/4aNOTI-R (ATAAGAATGCGGC CGCTCAGAGAATCTGCCACTCAT) 和 8hNOTI -F(ATAAGAATGCGGCCGCATGAAGTCCTTCAAGAAGGA)/8hNOTI-R(ATAAGAATGCGGCCGCTCACCCAAATGTCTTCTCGC),使用 pfu DNA 聚合酶从 pGEM-Teasy 载体上分别扩增 TaATG4a 和 TaATG8h 基因的全长 ORF。扩增产物 NotⅠ-NotⅠ片段经酶切、连接过程克隆到原核表达载体 pET30a 的 NotⅠ位点处,测序鉴定正确插入方向 (起始密码子ATG 紧邻 T7 启动子) 的重组表达载体 pET -ATG4a 和 pET-ATG8h。采用热激法将表达载体导入到大肠杆菌 BL21(DE3)中。
1.3 原核表达
接种含重组载体质粒的大肠杆菌 BL21(DE3)到 LBK 液体培养基中(含 50 mg·L-1卡那霉素),37 ℃ 振荡培养过夜 。 按 1% 的比例扩大到 5 mLLBK 液体培养基中(卡那霉素 50 mg·L-1),37 ℃振荡培养至 OD600达到 0.6~0.8。加入终浓度为 1mmol·L-1的 IPTG,于 28 ℃条件下震荡培养诱导目标基因的表达。分别于诱导后 0,2,4,6,8 h 取 1mL 菌液用于总蛋白的 SDS-PAGE 电泳分析。
1.4 SDS-PAGE 电泳
将 1 mL 菌液 10 000 r·min-1离心 10 min,弃上清后加入 80 μL 的 ddH2O 重悬沉淀,再加入 20μL 电泳上样缓冲液(5X)并混匀,沸水浴 10 min。12 000 r·min-1离心 5 min,取上清用 SDS-PAGE凝胶电泳(13%分离胶,4%浓缩胶)分离蛋白。电泳后用考马斯亮蓝(R-250)染色液染色 1 h,脱色液脱色至背景无色后观察并拍照。
1.5 重组蛋白的纯化
重组蛋白为 N 端含组氨酸标签 His(6)的 His(6)-TaATG4a 或 His (6)-TaATG8h,因此使用 Ni-Agarose His 标签蛋白纯化试剂盒(康为世纪),在非变性条件下经 Ni 柱亲和层析过程纯化重组蛋白。层析柱的平衡、菌体的超声波破碎和可溶性蛋白的上样及杂蛋白的清洗等过程参照试剂盒手册进行。分别使用 5 mL 含 50,100,200,300 和 500mmol·L-1咪唑的洗脱液分段洗脱目标蛋白。收集各阶段的洗脱液进行 SDS-PAGE (13%分离胶,4%浓缩胶)电泳和考马斯亮蓝(R -250)染色 、脱色分析。纯化的蛋白质溶液(洗脱液)-80 ℃冰箱保存。

2、 结果与分析
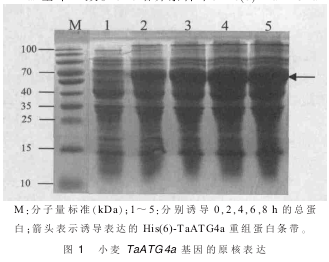
2.1 小麦 TaATG4a 和 TaATG8h 的原核表达。
构建了小麦 TaATG4a 和 TaATG8h 基因的原核表达载体。将表达载体 pET-ATG4a 和 pET-ATG8h 分别转化到大肠杆菌 BL21(DE3)菌株中。
如图 1 和 2 所示,未经 IPTG 诱导的大肠杆菌总蛋白中目标蛋白表达微弱。而经 IPTG 诱导,两个载体均正确表达出了重组蛋白 His (6)-TaATG4a 和His (6) -TaATG8h,实际分子量与理论分子量(His(6) -TaATG4a:59.25 kDa;His (6) -TaATG8h:20.22kDa)基本一致。28 ℃培养条件下,His(6)-TaATG4a的表达量在诱导后 0~8 h 时间段内随诱导时间的延长逐渐增加(图 1),而 His(6)-TaATG8h 在诱导后 2 h 即可实现高效表达(图 2),且其表达量并未随着时间的增加而有明显的变化。电泳上样样品为大肠杆煮沸液的上清部分,表明两个重组蛋白在可溶性部分中的表达量足够高,满足纯化要求,这为后续非变性条件纯化过程的选择提供了依据。
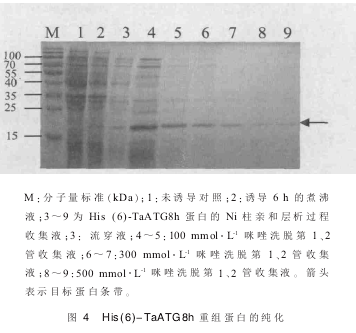
2.2 小麦 TaATG4a 和 TaATG8h 重组蛋白的纯化。
鉴于目标蛋白 N 端融合了 His(6)组氨酸标签,采用 Ni 柱亲和层析方法纯化总可溶性蛋白中的目标蛋白。如图 3 和 4 所示,流穿液中目的蛋白较少。经由不同浓度咪唑洗脱液的洗脱,杂蛋白含量逐渐减少,目标蛋白的相对含量逐渐增加。两个目 标 重 组 蛋 白 His (6) -TaATG4a 和 His (6) -TaATG8h 的 500 mmol·L-1咪唑洗脱液的纯度较高,满足抗体的制备要求。但洗脱液中目标蛋白的含量较低,因此如果后续免疫工作中抗原量不足,可以选择其他杂蛋白含量较低的咪唑浓度洗脱液进行切胶后回收目标条带免疫或碎胶直接免疫的方法。
3、 结 论与讨论。
自噬是一种普遍的蛋白质降解途径,在植物新陈代谢和生长中扮演了重要角色,这些过程包括种子的发育、液泡的增大、饥饿条件下氮的循环、衰老、细胞凋亡和植物在生物、非生物胁迫下的响应,所以从包括 ATG4 和 ATG8 在内的重要ATG 基因入手,对自噬分子机制开展深入研究具有重要的生物学意义。
本研究采用 pET30a 大肠杆菌表达系统进行原核表达,该原核表达系统带有 T7 噬菌体启动子,能够将多聚组氨酸标签融合入目的蛋白,此方法的优点有易于纯化、操作方便和表达量大等。
在 pET30a 表达载体上的 T7 启动子能够与大肠杆菌 BL21(DE3)中噬菌体编码的 T7 RNA 聚合酶特异性的结合,然后启动 T7 启动子下游的目标基因的表达。T7 RNA 聚合酶的活性很高,它的转录合成 RNA 的速度比大肠杆菌 RNA 聚合酶快很多,并且不经常有终止转录的现象发生。本研究中通过原核表达载体构建、IPTG 诱导表达和基于组氨酸标签的 Ni 柱亲和层析过程获得了纯化的TaATG4a 和 TaATG8h 重组蛋白。重组蛋白的获得为今后抗体制备和通过免疫学方法深入研究TaATG4a 和 TaATG8h 基因在小麦自噬过程中的功能奠定了基础。重组蛋白以可溶性形式存在,这使后续的蛋白纯化过程可以在无变性剂的相对温和条件下进行,纯化后的蛋白可以最大限度地保持其空间构象与功能,便于以后的体外酶活分析研究。





