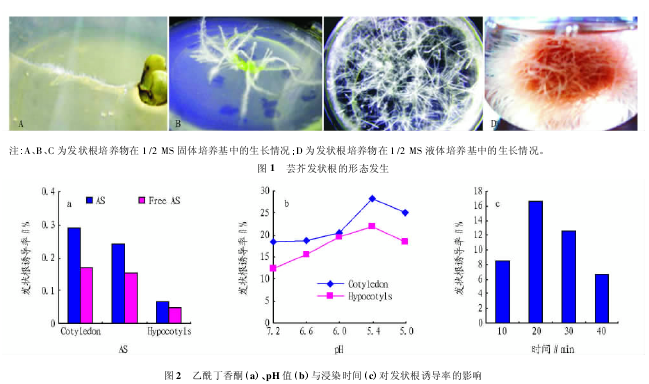
芸芥( Eruca Sativa Mill) 是十字花科( Brassicaceae) 芝麻菜属( Eruca) 作物,与其他十字花科植物一样,含有一种叫硫代葡萄糖苷( 简称硫苷,glucosinolate) 的次生代谢物。该代谢物在芥子酶( myrosinase) 或胃肠道细菌酶的作用下能降解成异硫氰酸盐( isothiocyanates,ITCs),具有抑制癌细胞生长的作用。通过发根农杆菌( Agrobacterium rhizogene) 介导产生的发状根( hairy root) 培养物,因具有生长迅速、遗传稳定、生长周期短、可人为调节以及不受季节与环境影响等优点,因而被公认为是最有希望生产有用植物次生代谢物的有效途径之一,并已经在一些植物中获得了成功。为了探讨采用该发状根系统合成硫苷的可能性,笔者建立芸芥发状根培养体系,并初步分析该发状根中硫苷的含量,以期为芸芥发状根的进一步开发利用奠定基础。
1 材料与方法
1. 1 材料
1. 1. 1 研究对象。青城芸芥,由甘肃省农科院张涛博士惠赠,经鉴定为 Eruca Sativa Mill。
1. 1. 2 主要试剂。所用试剂均为国产分析纯,市售。
1. 2 方法
1. 2. 1 样品的初处理。选取饱满的完好青城芸芥种子,用浓度70%的乙醇消毒 30 s,再用浓度 0. 1% 的 HgC12浸泡 8min,用无菌水冲洗 3 ~ 5 遍,然后用无菌滤纸吸干水分,接种于 MS 无激素固体培养基上,在( 24 ±1) ℃、12 h/d、1 000 lx的光照条件下培养。
1. 2. 2 菌株的培养。发根农杆菌采用 R1000 菌株。低温保存的菌种挑取单菌落接种于含 50 mg/L Kan 的 YEB 液体培养基( pH 7.0) ,恒温振荡培养( 28 ℃、150 r/min) 至 OD600值0. 6 ~ 0. 8。取 100 μl 菌液与 10 ml 新鲜的 YEB 培养液混合,并加入终浓度为 100 mg/L 的乙酰丁香酮( AS),然后在相同条件下培养,OD600值达到 0.2 ~0.5 时进行转化。
1. 2. 3 菌株的转化。取 6 d 苗龄的芸芥无菌苗子叶和下胚轴以及从子叶诱导的胚状体,在 MS 无激素固体培养基上预培养2 d,用活化的 R1000 菌液浸染 20 min,无菌滤纸吸干菌液后,置于 MS 固体培养基上,于25 ℃、黑暗条件下共培养 2d 后转入光照培养( 1 000 lx) ; 继代培养 2 ~ 3 周后,发状根长约1 ~2 cm 时从外植体切下,转移至含头孢噻肟钠( cef) 500mg /L 的 MS 选择培养基,每周转接 1 次,并逐渐降低 cef 浓度,6 ~7 代后转入不含 cef 的无激素 MS 培养基,进行扩增繁殖。
1. 2. 4 分子鉴定。按钟军等改进的 SDS 法,提取芸芥发状根和芸芥无菌苗的基因组 DNA。使用 Zdravkovic korac等依据 Slightom等公布的 rolB 基因序列设计的引物进行PCR 扩增。扩增条件为: 95 ℃ 预变性 5 min,94 ℃ 变性 1min,61 ℃ 退火 1 min,72 ℃ 延伸 1 min,共 36 个循环; 72 ℃ 继续延伸 10 min。扩增产物在 1%的琼脂糖凝胶上分离,紫外检测仪中观察并拍照。其中引物为: 5'-ATG GAT CCC AAATTG CTA TTC CTT CCA CGA-3' ( 上游) ; 5'-TTA GGC TTCTTT CTT CAG GTT TAC TGC AGC-3'( 下游) ,由上海生工公司合成。
1. 2. 5 硫苷含量的氯化钯法测定。取已知硫苷精确含量( 94 μmol/g) 的油菜籽100 mg,用研钵粉碎,沸水浴中干蒸10min,加沸水 8 ~ 10 ml,提取 25 min,冷却后用蒸馏水定容到10 ml,稀释成不同的浓度梯度。取各种稀释液 0. 5 ml + 4. 0ml 显色液( 0. 354% 氯化钯和 0. 150% 羧甲基纤维素钠等体积混合) 混匀,以0.5 ml 蒸馏水 +4.0 ml 显色液为对照,显色20 min 后,在 721 型分光光度计上测 OD 值 ( 波长为 540nm) ,根据吸收值和已知的硫苷含量求出回归方程; 然后把培养的发状根样品烘干,准确称取 100 mg 粉碎,按上述方法提取,定容到10 ml; 直接取0.5 ml 与4 ml 显色液显色20 min后测 OD 值。
1. 2. 6 硫苷含量的高效液相色谱分析。参照 Minchinton 等的方法并稍作修改: 取 10.00 g 芸芥发状根,烘干粉碎,于索氏提取器中加入约50 ml 石油醚脱脂处理6 h,低温干燥成粉沫。取2.00 g 脱脂的发状根干粉,分别沸水浴干蒸 5 min,加入 2 滴巯基乙醇和 25 ml 蒸馏水,浸提 15 min,抽滤,滤液加入 4 ml 浓度 0. 5mol/L 的 Pb( Ac)2-Ba ( Ac)2溶液,于10 000 r /min 离心 10 min,上清液用 DEAE-Sephadex A-25 小柱纯化,双蒸水淋洗,0. 5 mol/L 的硫酸钾溶液洗脱,洗脱液在55 ℃下用旋转蒸发仪浓缩到近干。色谱条件为: 色谱柱为 Reliasil C18柱( 5 μm,250 mm ×4.6 mm ) ; 流动相为无水甲醇∶ 水 =10∶90( V/V) ,含浓度 0. 1% 三乙胺; 醋酸调节 pH 到5. 5; 流动相流速 1 ml /min; 紫外检测波长 230 nm,进样检测分析。
2 结果与分析
2. 1 发状根的形态发生 子叶、下胚轴和胚状体 3 种外植体被发根农杆菌 R1000 感染后,均有发状根长出,这些发状根为单生、双生或丛生,具白色根毛,细而柔软,质脆易断裂,贴壁向上或沿培养基表面生长,无向地性。脱菌后,在无激素的1/2MS 固体和液体培养基上都能迅速生长并产生许多分枝( 图 1) ; 未经转化的外植体虽然也有毛状根长出,但这些根向下长入培养基,在无激素的1/2MS 培养基上逐渐褐化死亡。就转化率而言,子叶的转化率明显高于下胚轴和胚状体( 图2 -a) 。此外还发现,乙酰丁香酮( AS) 、浸染时间和浸染液的 pH 值对转化率也有明显的影响。最佳的 AS 浓度、pH 值和浸染时间分别为 100 mg /L( 图 2 - a) 、pH 5. 4( 图 2 -b) 和 20 min( 图 2 - c) 。
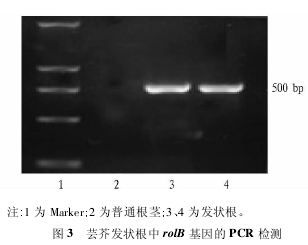
2. 2 发状根培养物中 rolB 基因的鉴定结果 图 3 表明,发状根 DNA 中扩增出了一条特异性条带,而且条带的大小与预期的相同( 500 bp) ,而普通根( 阴性对照) 的 DNA 则无任何条带出现,表明来自发根农杆菌 Ri 质粒上的 rolB 基因已经被转入并整合到芸芥发状根的基因组中。
2. 3 发状根中硫苷含量的测定 计算得硫苷含量的线性回归方程为: Y =0.006 4X +0.024 9,R2= 0. 994 6。其中 X 为光吸收变量,Y 为总硫苷含量( μmol/g) 。所测芸芥普通根和发状根的平均OD 值分别为0.54 和0.35,代入上式得出普通根和发状根硫苷的含量分别为 80. 48 和 50. 80 μmol/g,证明芸芥的发状根也具有合成硫苷的能力。发状根中硫苷的含量约占普通根中含量的 62.5%。
图 4 表明,1( 3. 692) 、2( 6. 483) 号峰分别和袁丽凤等( 2004) 采用完全相同的方法在对油菜籽硫苷成分进行分析时得到的 HLPC 中的 2( 3.61,代表5 -甲硫基戊基硫苷) 和 5号峰( 6.10,代表吲哚3 -甲基硫苷) 大致相同。但由于试验缺少相应对照,所检测到的组分是否真正代表 5 - 甲硫基戊基硫苷和吲哚 3 -甲基硫苷仍有待进一步研究。
3 讨论
Ri 质粒 T - DNA 的 rol 基因与植物激素间的相互作用,能影响植物细胞的分化和植株再生,从而间接影响某些次生代谢产物的合成。研究通过发根农杆菌 R1000 的介导,首次建立了芸芥发状根的诱导和培养体系,并通过 PCR 对所得发状根进行了分子水平的鉴定,表明发根农杆菌 R1000的 rolB 基因已成功地转入并整合到该发根培养物的基因组中。据不完全统计,发状根诱导目前在 26 科 92 种药用植物中已经获得成功。得到的发状根中,大部分能检测到与原植株含量相当的有用次生代谢物,有些甚至大大高于原植株的含量,并且有些已应用于工业化生产。氯化钯分光光度法和高效液相色谱分析结果初步证明了该发状根培养物具有合成硫苷的能力。虽然发根培养物中的硫苷含量约只占普通根的 62%,但由于发状根生长迅速,遗传稳定,生长周期短,可人为调节,同时不受季节与环境的影响,因此经过进一步完善,利用此系统有望获得大量的硫苷,进而通过分解获得大量的异硫氰酸盐。
参考文献
[1]NUGON-BAUDET L,RABOT S,WAL J M,et al.Rctions of the IntestinalMicroflora with Glucosinolates in Rapeseed Meal Txicity: First Evidence ofan Intestinal Lactobacillus Possessing a Myrosinase Like Activity in vivo[J]. J Sci Food Agric,1990,52:547 -559.
[2]ZHANG Y,TALALAU P. Anticarcinogenic Activities of Organic Isothiocya-nates; Chemistry and Mechanisms [J]. Cancer Res,1994,54: 1976 -1981.
[3]HECHT S S. Chemoprevention by Isothiocyanates[J]. J Cell Biochem,1995,22: 195 -209.
[4]HECHT S S. Inhibition of Carcinogenesis by Isothiocyanates [J]. DrugMetal Rev,2000,32: 395 -411.
[5]WALLIG M A,KINGSTON S,STAACK R. Induction of Rat PancreaticGlutathione S - transferase and Quinone Reductase Activities ransferaseand Quinone Reductase Activi5ties by a Mixture of Glucosinolate Break-down Derivatives Found in Brussels[J]. Sprouts Food and Chemical Toxi-cology,1998,36: 365 -373.
[6]TALALAY P,ZHANG Y. Chemoprotection Against Cancer by Isothiocya-nates and Glucosinolate Biochem[J]. Soc Tran,1996,24: 806 -810.
[7]HECHT S. Chemoprevention of Cancer by Isothiocyanates,Modifiers of Car-cinogen Metabolism[J]. J Nutr,1999,129: 768 -774.
[8]WANG Q M,STEFFEN A. Anticancer mechanism and correlation researchof isothiocyanates[J]. Chinese Journal of Cell Biology,2002,24( 3) : 171 -175.
[9]ZHENG Z R,PENG J S,LIU D. The Mass Cultures of the Hairy Roots ofAStragalus membrane-aceus[J]. Plant Physiology Communications,1997,33(2) :133 -134.
[10]LIU J,DING J Y,XU H. Genetic Transformation of Panax gingseng C. A.Meyer Induced by Root Inducing Plasmid( Ri) of Agrobacterium rhizoge[J]. China Journal of Chinese Material Medica,2001,26(2) :95 -99.
[11]XU T F,ZHANG H M,DING R X. Establishm ent of Hairy Root Cultureof Verbascum thapsus and Moll - ugo pentaphylla[J]. Plant PhysiologyCommunications,2000,36( 5) : 423 -425.
[12]CHEN D H,MENG Y L,YE H C. Culture of transgenic Artemisia annuahairy root with cotton cadinene synthase gene[J]. Acta Motanica Sinica,1998,40( 8) : 711 -714.
[13]HU Z,YANG J,ZHENG G C. Establishment of transformed Lycium bar-barum Line mediated with Agrobacterium rhizogenes and factors affectingtransformation [J]. Acta Bot. Boreal - occident Sin,2000,20( 5) : 766 -771.
[14]ZHONG J,LI M X. A method separated the DNA of Eruca Sativa Mill ge-nome[J]. Biotechnology,2002,12( 5) : 18 -19.
[15]ZDRAVKOVIC K,MUHOVSKI Y,DRUART P,et al. Agrobacterium rhi-zogenes mediated DNA transfer to Aesculus hippocastanum L and the re-generation of transformed plants[J]. Plant Cell Rep,2004,22: 698 -704.
[16]SLIGHTOM J L,DURAND TARDIF M,JOUANIN L,et al. Nucleotide se-quence analysis of TL - DNA of Agrobacterium rhizogenes agropine typeplasmid[J]. J Biol Chem,1986,261: 108 -121.
[17]THIES W. Complex -formation between glucosinolates and tetrachloropal-ladate ( II) and its utilization in plant breeding[J]. Fette Seifen An-strichmittel,1982,84: 388 -342.
[18]MINCHINTON I,SANG J,BURKE D,et al. Separation of desulpho-glu-cosinolates by reversed-phase high-performance liquid chromatography[J]. J Chromatogr,1982,247:141 -148.
[19]YUAN L F,GUO W Q,WANG Z G. Determination of glucosinolates byliquid chromatogram - phy mass spectrometry[J]. Journal of Zhejiang U-niversity,2004,31( 2) : 180 -183.
[20]FU C X,JIN Z P,WU F Y. Establishment of Saussurea involucrata HairyRoots Culture and Plantlet Regeneration[J]. Chinese Journal of Biotech-nology,2004,20( 3) : 366 -371.
[21]GUO D A. The effect of biological techniques in modernization of tradi-tional Chinese medicine[J]. Foreign Medicine-in Numbers of BotanicDrugs,1998,13( 6) : 257 -260.