
植物体细胞胚发生是植物细胞“ 全能性” 的体现, 也是植物组织培养中形态建成的重要途径之一。 由于体细胞胚具有单细胞起源、繁殖速度快、繁殖率高、染色体稳定等特点, 成为胚胎发生机制研究的模式系统、植物遗传转化的受体系统和离体繁殖的有效途径。 从Steward首次从悬浮细胞培养的愈伤组织中获得体细胞胚后,植物体细胞胚发生研究就深受关注。 到目前为止,已经成功诱导数百种植物的体细胞胚发生, 在分子水平和体细胞胚发生调控机制方面也开展了研究。 但是体细胞胚诱导发生过程普遍存在效率低和不同步性的问题, 在一定程度上阻碍了体细胞胚发生的生理生化研究和分子生物学研究的进展. 研 究 人 员 也 采 取 了一 系 列 的 物 理 和 化 学 方法来提高体细胞胚的发生效率和体胚发生的同步化控制. 虽 然 取 得 了一 定 效 果, 但 他们 考 虑 的影响因素较少, 没有对其进行系统研究分析。
枸杞(Lycium barbarum L.)是茄科(Solanaceae)枸杞属(Lycium)多分枝灌木植物, 具有补肾生精、养肝、明目安神和延年益寿的药效作用。 主要分布在欧亚大陆和北美洲地区, 在中国主要集中在西北地区--宁夏、甘肃、新疆和青海等地。 对枸杞体细胞胚发生体系建立和机制进行研究, 不仅对枸杞品种改良和快速繁育有重要意义, 而且对其他植物的体胚发生机制研究也有一定的借鉴作用。 杨汉民等以宁夏枸杞叶片为材料开展体细胞胚发生诱导研究, 并观察体细胞胚形态, 发现体细胞胚发生的基本过程与合子胚相似, 但是发生方式和形态特征存在差异。 邢更生等对枸杞胚性细胞分化的超微结构研究指出, 枸杞胚性细胞由愈伤组织表层薄壁细胞分化而来, 胚性细胞的第1 次分裂是均等分裂, 形成二细胞原胚, 继续分裂, 发育形成多细胞原胚。 戴若兰等, 张 玮等对枸杞体细胞胚发生过程中蛋白质和DNA的动态变化展开研究, 结果表明体细胞分化成胚性细胞后, 蛋白质含量显着增加, 到多细胞原胚时期达到峰值。 在体细胞分化成胚性细胞时, DNA的变化不明显, 在梨形胚时期DNA 含量达到峰值, 成熟胚时期又有所下降。 崔凯荣等对枸杞体胚细胞基因表达、抗氧化酶活性以及ABA对枸杞体胚发生的调节作用开展研究, 指出ABA与体细胞胚性能力的启动和表达密切相关, 而过氧化氢对细胞分化及体细胞胚发生有促进作用。Li 等对2, 4-D 诱导枸杞体细胞胚发生过程中Ca2+和ATPase 的时空分布, 以及Ag+对体细胞胚发生的影响进行了研究, 结果表明2, 4-D 是诱导枸杞愈伤组织进入体胚性状态的关键激素,适当质量浓度的Ag+对细胞分化和枸杞体细胞胚发生有促进作用。 在体细胞胚发生及其机制研究方面, 枸杞体细胞胚是研究相对深入、全面的材料之一。 本研究试图在前人研究的基础上, 深入探讨影响枸杞体细胞胚高发生率和同步化的各种条件,完善枸杞体细胞胚发生体系并建立体细胞胚发生模式, 促进体细胞胚的理论和应用研究深入发展。
1 材料与方法
1.1 材料
供 试 材 料 是 从 兰 州 市 种 子 站 购 买 的 宁 夏枸杞(Lycium barbarum L.) 1 号、宁夏枸杞(Lyciumbarbarum L.) 2 号、宁夏枸杞(Lycium barbarum L.)4 号和新疆枸杞(Lycium dasystemum Pojark)种子。
1.2 实验方法
首先利用枸杞的种子培养出无菌苗, 然后利用无菌苗的子叶和下胚轴培养出愈伤组织, 再对愈伤组织进行激素诱导, 使之产生胚性细胞。 通过从不同时期的胚性愈伤组织中剥离不同时期的体细胞胚, 对它们进行形态学观察和发生频率统计。研究不同枸杞品种、2, 4-D 质 量 浓 度、继代培养次数、不同部位和温度对枸杞体细胞胚发生的影响,进而找出最佳的枸杞体细胞胚发生条件。 在本实验中体胚的诱导与培养最为关键, 图1 为体细胞胚发生培养流程图。【图1】

1.2.1 无菌苗获得
将 枸 杞 种 子 用 自 来 水 洗 净, 70% 酒 精 处理30 s, 再用0.1% 的升汞浸泡5 min, 用无菌水冲洗5 次后, 用灭菌的滤纸将种子表面的水吸干, 然后接种于不含激素的MS 培养基上, 光照16h/d,光强2500lx, 温度24C. 约15 天即可长出幼苗, 此幼苗即是枸杞无菌苗。
1.2.2愈伤组织培养
从培养好的无菌苗中分别取其子叶与下胚轴接种到含有2, 4-D 的MS 培养基上进行培养, 约15天后愈伤组织即可出现。 根据生长时间的长短可将愈伤组织分为早期愈伤组织、中期愈伤组织和后期愈伤组织。
1.2.3 体细胞胚诱导
体细胞胚是愈伤组织经诱导进行分化的产物。将枸杞愈伤组织转接到添加不同质量浓度2, 4-D的固体MS 培养基上交替继代培养, 20 天继代1次, 继代时正是中期愈伤组织时期。 获得体胚的方法就是从再分化培养后含有体胚的愈伤组织中剥离出体胚。 根据不同发育阶段形状的差异, 体胚又可分为早期体胚、球形胚、鱼雷胚等。
1.2.4 体细胞胚发育过程中形态观察
从分化不同时期的愈伤组织剥离出不同发育阶段的体细胞胚, 进行观察并拍照。
2 结果与分析
为了探索枸杞体胚高频发生的条件, 对影响体胚发生的枸杞品种、诱导激素质量浓度、外植体、继代次数等多种因素分别进行了实验, 并取得相应的实验数据。 需要说明的是, 实验中的激素为2, 4-D. 使用该激素的原因是我们从早期实验中发现: 在不加2, 4-D 但含有BA 或NAA 的MS 培养基上继代3 次后, 在无激素培养基上分化培养仅可剥离出十几个体细胞胚; 而在只加2, 4-D 的MS 培养基上继代3 次后, 经同样条件的分化培养可剥离出大量的体细胞胚, 见表1. 进一步证明2, 4-D 对启动体细胞胚发生起到了关键作用。【表1】

2.1 不 同枸杞 品种在 不同激 素质量 浓度下对体胚发生率的影响
取不同品种的材料, 分别接种在含有0, 0.1,0.2, 0.3, 0.5, 1.0, 1.5, 2.0 mg/L 2, 4-D 的 MS 培养基上, 继代3 次后, 转入无激素培养基上培养20 天,实验数据如表1 所示。 由表1 中数据不难发现, 不同质量浓度2, 4-D 以及不同的枸杞品种都会对体胚的发生产生影响。
由表1 可知, 不同材料经诱导, 其体胚发生率不同。 在相同质量浓度的2, 4-D 培养基上, 宁夏枸杞4 号材料的体胚发生能力最强。 可见, 不同品种对体胚发生有很大的影响, 其中宁夏枸杞4 号材料的体胚发生率最高。
在无激素的MS 培养基上, 愈伤组织产生的量很少, 体胚发生率也很少, 4 个枸杞品种每克愈伤组织都仅产生十多个体胚; 在含有2, 4-D 的培养基上不但产生大量的愈伤组织, 而且体胚发生率均显着提高。 在2, 4-D 质量浓度低于0.2 mg/L时, 体胚发生率随着质量浓度的增加而增加; 在2,4-D 质 量 浓 度 为 0.2 mg/L 时, 体 胚 发 生 频 率 最 高;在2, 4-D 质量浓度高于0.2 mg/L 时, 体胚发生率随着质量浓度的增加而降低。 这是因为在高质量浓度(0.5-2.0 mg/L)的 激 素 作 用 下, 愈 伤 组织 生 长很快, 但是强烈抑制体胚的发生。 实验结果表明:质量浓度为0.2 mg/L 的2, 4-D 培养基最适合体胚细胞的发生, 在此质量浓度下4 个枸杞品种的体胚发生率都达到峰值。因此, 在后续实验中选用的材料是宁夏枸杞4号, 而使用的2, 4-D 的质量浓度为0.2 mg/L.
2.2 无菌苗外植体对枸杞体胚发生率的影响
为研究同一植株的外植体对枸杞发生率的影响, 分别对无菌幼苗的下胚轴和子叶进行培养。 培养方法是以宁夏枸杞4 号为材料, 分别取无菌幼苗的下胚轴和子叶, 在 2, 4-D 质量浓度为0.2 mg/L的MS 培养基上进行培养, 继代3 次后转入无激素培养基中培养20 天; 取1 g 愈伤组织, 用解剖针和镊子将愈伤组织拨开, 在解剖镜下统计体胚数目,下胚轴和子叶中的体胚数量分别为496, 368 个/g,其中数据是3 次重复的平均值。 由此可知, 不同外植体的体胚发生能力是不同的。 相比之下, 下胚轴产生的愈伤组织生长快, 体胚发生率高。 子叶产生的愈伤组织体胚发生能力也较强, 但是略低于下胚轴部位的。 因此, 同等条件下选用下胚轴作为培养材料可得到更多的体胚。
2.3 枸杞胚性愈伤组织继代培养
考虑到不同继代次数可能会影响体胚发生的能力。 本实验以宁夏枸杞4 号无菌苗的下胚轴为研究材料, 继代培养1-5 次, 然 后 再 转 入 无 激 素的MS 培养基培养20 天观察体胚的发生情况。 实验数据如图2 所示, 结果表明不同继代次数对体胚发生能力的影响也不尽相同。 继代1 次的材料只有少量的体胚, 随着继代次数的增加, 愈伤组织细胞的脱分化能力、体胚发生能力都随之增加。 但是,继代次数超过3 次后, 随着次数的增加, 材料逐步老化, 分化能力降低, 体胚发生频率也随之降低。【图2】

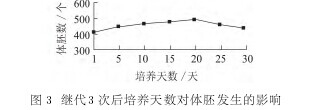
在确定好最佳继代次数后, 接着研究继代3次后培养天数与体胚发生之间的关系。 分别观察第1, 5, 10, 15, 20, 25, 30 天的体胚数, 具体实验数据如图3 所示。 由图3 可以看出, 从第1 天至第30天中体胚数呈现先增大后减小的变化趋势, 第20天时体胚数达到最高。可见, 继代3 次, 再转入无激素MS 培养基培养20 天体胚发生率最高。【图3】
2.4 温度对枸杞体胚发生的影响
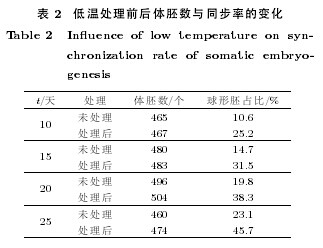
继代3 次后, 在4·C 下低温处理具体实验结果见表2. 由表2 可以看出经低温处理后, 虽然体胚发生率未见太大提高, 但是体胚发生的同步程度得到很大改变。 以球形胚为例, 处理前后球形胚所占比例大幅提高, 这表明体细胞胚的同步发生与温度调控有关。【表2】
2.5 枸杞体胚发育过程的形态变化
消毒的枸杞种子在MS 固体培养基上, 培养15天即可长出无菌苗(图4a)。 图4b 是子叶和下胚轴材料转接到含2, 4-D 的MS 培养基进行诱导。 图4c是早期愈伤组织, 即在2, 4-D 的MS 培养基上继代3 次后, 转到MS 培养基上培养5-7 天 的 愈 伤 组织, 此时期体胚少而小, 不容易剥离。 中期愈伤组织(图4d, 4f)即在分化培养基上生长12-25 天 的 愈伤组织, 此时期体胚较多, 含有大量的球形胚 和 鱼雷胚, 是 剥离体 胚的 最佳 时期。 图4g, 4h, 4i 就是在此阶段剥离的体细胞胚。 到了后期愈伤组织(图4e)阶段, 成熟胚较多, 有的体胚形成幼苗, 是剥离成熟胚(图4j)和早期幼苗(图4k)的最佳时期。

3 讨论
体细胞胚发生效率和体胚发生的同步控制,是体胚发生研究的热点和难点之一, 研究人员利用不同的培养材料探讨高效同步的体胚发生条件. 本 实 验 从不 同 枸杞 品 种、不同质量浓度的2, 4-D 培养基、不同外植体部位、不同继代次数和低温等, 研究不同条件对枸杞体细胞胚同步发生效率的影响, 结果发现2, 4-D 是诱导体细胞胚发生的关键激素。 李杉等在研究Ag+对细胞分化和枸杞体细胞胚发生作用时, 也表达了相同的观点。 方智振等对龙眼体细胞胚同步发生的研究结果还表明, 2, 4-D 质量浓度的微量调节可以提高中期体胚的同步发生。 本实验发现2, 4-D质量浓度为0.2 mg/L 时, 体胚发生效率最高, 而在对百合体细胞胚的发生研究发现, 2, 4-D 质量浓度为4.0 mg/L 时, 百合体细胞胚的发生率最高. 2,4-D 的确是诱导体细胞胚发生的关键激素, 但材料品种不同, 对2, 4-D 质量浓度的要求也不同。
同一个物种不同品种的体胚发生效率也不同。本实验选4 个枸杞品种, 结果宁夏枸杞4 号体胚发生率是最高的, 而宁夏枸杞2 号体胚发生率仅为它的1/3, 产生这种差异的原因有待进一步研究。牛德水等首次以枸杞下胚轴为材料诱导出体细胞胚和再生植株, 杨汉民等成功利用枸杞叶外植体诱导出体细胞胚。 本次研究发现同一材料不同部位对体胚发生率也有一定影响, 宁夏枸杞4号的下胚轴体胚发生率明显高于子叶的, 但起关键因素的还是材料的品种。继代次数也是制约枸杞体胚发生率的重要因素。 以宁夏枸杞4 号为材料, 在2, 4-D 培养基上经不同继代次数培养。 实验结果表明, 继代培养3 次,体胚发生率最高, 这可能是由于继代次数少于3次, 营养和诱导时间不够, 不能产生较多体细胞胚。而继代次数超过3 次, 营养充分但材料老化, 没能在最佳时期完成脱分化, 因此体胚发生率也较低。可见, 在材料的最佳时期完成脱分化也是体细胞胚高效发生的关键因素之一。
4 结论
体细胞胚发生体系构建受到诸多因素影响,但是, 本研究表明植物材料的品种和取材部位是决定体细胞胚发生效率的主要因素, 而外源植物激素可以进一步调节体胚发生效率, 但不同植物材料对激素质量浓度的要求不同。 低温处理可以提高体胚的同步发生效率。 本研究结果以期给体胚研究者一些启示, 在构建高效体胚发生体系时,要对材料品种和取材部位加以选择, 外源激素添加量和低温处理等是提高体胚同步发生效率的有效手段。
参考文献
[1] Cui Kai-rong, Xing Geng-sheng, Qin Lin, et al.The analysis of di·erential gene expression in earlysomatic embryogenesis on Lycium barbarum L.[J].Plant Cell, Tissue and Organ Culture, 1999, 59(3):169-174.
[2] Cui Kai-rong, Xing Geng-sheng, Liu Xin-min,et al. E·ect of hydrogen peroxide on somaticembryogenesis of Lycium barbarum L.[J]. PlantScience, 1999, 146(1): 9-16.
[3] Hu Zhong, Wu Yi-rui, Li Wei, et al. Factorsa·ecting agrobacterium tumefaciens-mediatedgenetic transformation of Lycium barbarum L.[J].In Vitro Cellular & Developmental Biology: Plant,2006, 42(5): 461-466.
[4] Hu Zhong, Hu Yao-ming, Gao Huan-huan, et al.Callus production, somatic embryogenesis and plantregeneration of Lycium barbarum root explants[J].Biologia Plantarum, 2008, 52(1): 93-96.
[5] Steward F C.Growth and organized developmentof culture cells: Ⅲ。 interpretations of the growthfrom free cell to carrot plant[J]. American Journalof Botany, 1958, 45(10): 709-713.
[6] 方 智 振, 赖 钟 雄。 龙 眼 体 胚 发 生 中 期 发 育 同 步 化 的初步调控[J]. 中国农学通报, 2009, 25(1): 152-155.





