
药品是特殊商品,人类的生存离不开药品,药品质量的好坏直接影响人民群众的用药安全[1]。而药品生产企业的质量管理部门负责监控药品的质量,是风险最大的 GMP 管理部门。质量控制 (QC)实验室作为传统质量控制体系的重要组成部分,历来是企业质量管理实施中的重点之一[2]。生产过程中经常需要根据 QC 实验室的测定数据调整生产工艺,并且最终成品必须经 QC 实验室检验合格后才能上市销售[3]。因此,QC 实验室对药品的安全性和有效性有最为直接的影响。为切实加强药品生产企业 QC 实验室的规范化管理,认真贯彻落实《药品生产质量管理规范(2010 年修订)》(以下简称新版 GMP)[4],提升药品生产企业质量管理水平,进一步规范药品生产质量监管体系,本文根据省相关监督检查部门对我省 18 家药品生产企业 QC 实验室的抽查结果进行统计分析,总结目前我省药品生产企业 QC 实验室的不足之处,为其规范化管理提供部分参考。
1 调研方法与调研内容
1.1 调研方法
本次调研采用随机样本法和对比法。以我省辖区内正常生产的 262 家药品生产企业作为整体,根据河南省药品审评认证中心 2013 年进行的认证检查、跟踪检查及专项检查企业名单,从中随机抽取18 家药品生产企业(其中,认证检查企业 3 家,跟踪检查企业 10 家,专项检查企业 5 家),进行QC实验室情况调查。调研样本企业涉及郑州、安阳、济源、焦作、开封,商丘、驻马店、新乡、信阳、南阳等 10 个地市。跟随检查人员现场检查并填写调查表 18 份。将调查结果与新版 GMP 相关规定进行对比分析。
1.2 调研内容
参照新版 GMP 对 QC 实验室规定的重点检查内容设定检查项目。主要从3个方面设计调查问卷:实验室质量管理相关人员情况、实验仪器考核的合格情况、质量管理体系达标情况。
1.2.1 对质量管理人员的调查质量管理人员调查内容见表 1。
1.2.2 对质量控制实验室检验仪器设备的调查。质量控制实验室检验仪器设备调查的内容见表 2。
1.2.3 对质量控制实验室管理体系的调查
对企业质量控制实验室管理体系的调查内容见表 3。


2 结果与讨论
2.1 QC 实验室质量管理及检验人员学历情况QC 实验室质量管理及检验人员的学历普遍较低,具体见表 4。
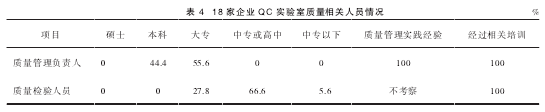
企业中每个员工对质量和质量工作的认识和理解就是质量意识,质量意识对质量行为有着极其重要影响及制约作用[5]。质量管理人员的知识水平、阅历以及检验能力对药品的质量控制是十分重要的。新修订药品 GMP 提高了关键人员的学历、专业职称等要求,其中学历从大学专科提高为大学本科[6]。通过本次调研结果可以看出,我省药品生产企业质量管理人员学历普遍偏低,调查的 18 家生产企业中,无一家质量管理负责人为硕士或以上学历,本科学历仅占 44.4%,55.6% 为大专学历;但在检查中发现,学历偏低的质量管理负责人大多阅历比较丰富,属于经验型的管理者,这一情况还算是差强人意。
质量检验人员学历劣势明显,竟无一人为本科或本科以上学历,大专学历仅占 27.8%,66.6% 为中专或高中学历,甚至有一家企业出现了中专以下学历的检验人员。新版 GMP 第二百一十九条规定:质量控制实验室的检验人员至少应当具有相关专业中专或高中以上学历,并经过与所从事的检验操作相关的实践培训且通过考核[3]。我国目前高等院校培养出来的药学相关专业人员正在逐年增加,但每年走进生产企业从事质量检验的人员却寥寥无几。而药品检验工作由接受过专业知识教育的高素质人才担任方能更好的保证药品质量。随着 GMP 及市场对药品质量要求的提高,生产企业应该更多地引入专业技术人才,为完善质量控制管理体系提供保障。
2.2 QC 实验室的仪器设备考核情况
QC 实验室仪器设备放置不符合标准的企业占有较大的比例,具体情况见表 5。
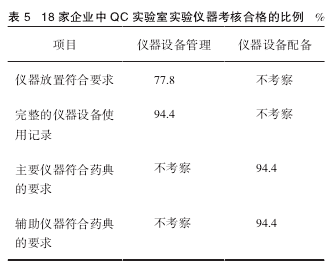
稳定的分析仪器、实验设备成为获得准确可靠实验数据的基础[7]。从检查结果来看,我省药品生产企业主要仪器和辅助仪器配备比较完善,基本符合质量控制要求,能够保证所生产药品的各项检验顺利进行。仪器设备的使用记录也比较完整,能够很好的追溯本企业所生产的药品。但仪器的放置却不尽如人意:现场发现部分企业存在仪器放置不规范的情况,比如对环境有要求的仪器和容易产生震动的仪器放在了同一间实验室内,这可能会影响检验结果的准确度,甚至导致对药品检验结果不准确,造成药品安全方面存在潜在的威胁。
2.3 企业管理体系达标情况
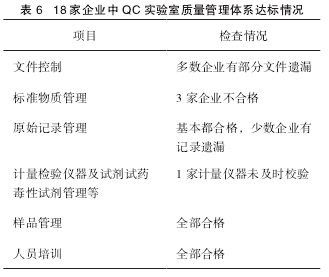
企业 QC 实验室质量管理体系达标情况见表 6。表 6 18 家企业中 QC 实验室质量管理体系达标情况项目 检查情况文件控制 多数企业有部分文件遗漏标准物质管理 3 家企业不合格原始记录管理 基本都合格,少数企业有记录遗漏计量检验仪器及试剂试药毒性试剂管理等1 家计量仪器未及时校验样品管理 全部合格人员培训 全部合格从整个检查结果来看,仅有 3 家企业标准物质管理不合格,1 家企业计量仪器未及时校验。但多数企业在细化的项目检查中仍然存在瑕疵,比如基准试剂、安全检查试剂等未进行质量验收或不能提供质量安全证明,以及多数企业存在缺少部分规程、部分操作记录有遗漏的现象,这些细节都可能成为成品质量安全的隐患。比如基准试剂含量过高或过低,会导致劣药因检查合格而流入市场,优质药品却因检查不合格而被废弃。
3 结论
抽查结果虽然不能完全代表本省药品生产企业质量控制实验室的整体情况,但通过检查可见:自新版 GMP 实施以来,我省药品生产企业均在努力与之靠近,质量控制实验室方面已无明显不足,但细节上仍有不少漏洞,各个方面均存在不完善的地方。这就要求生产企业仍然需要通过不断的自我检查、自我改进,严格按照新版 GMP 的规定,在要求的期限内完善细节,从根本上保证进入市场的药品质量安全、可靠。
4 建议
4.1 招贤纳士 补充力量
建议生产企业与高校实行对接,通过高校为企业培养优秀的检验及管理人才。可以通过提供实习岗位、宣传企业文化、定期招聘等途径引进专业技术人员,保障企业的检验质量。
4.2 高度重视 严格要求
简单的设计错误或者操作疏忽是最容易造成质量缺陷的。建议各企业高度重视对质量检验人员进行仪器设备使用的相关培训,强化细节,使检验人员时刻保持严谨的态度,才能更好的保障产品质量。
4.3 规范操作 完善管理体系
建立适宜的实验室质量管理体系是实验室全面质量管理的前提,严格运行和实施质量管理体系才能提升实验室质量[8]。管理属于对细节及整体的把握,必须建立完善的管理体系,细化规定,保证质量控制各个环节对产品质量检验不产生负面影响。
参考文献:
[1] 黄灿坤 . 药品质量管理与经济效益 [J]. 国际医药卫生导报,2003,Z2:119-120.
[2] 陈巍,白巍 . 试析 GMP 认证对 QC 实验室的要求 [J].中国药业,2003,12(11):28-29.
[3] 杨美成,林梅,王林波,等 . 药品生产企业质量控制实验室检测能力考核及结果评价模式 [J]. 药学服务与研究,2012,12(3):175-179.
[4] 卫生部 . 卫生部令第 79 号 药品生产质量管理规范(2010 年修订)[S]. 2010.





