
细胞因子及其受体广泛表达于免疫细胞和神经系统,最近 研究发现 细 胞 因 子CCL-2、CX3CL-1、CCL-1等细胞因子可以通过激活脊髓小胶质细胞引起痛觉过敏。近年来,疼痛的表观遗传学研究逐步深入。表观遗传学是指在DNA序列没有改变的情况下基因表达发生可遗传的改变,其中组蛋白乙酰化修饰是重要的表观遗传修饰方式。最新研究发现组蛋白3赖氨酸9位(H3histone subunitat lysine residue 9,H3K9)乙 酰 化 与 疼 痛 有 关。
CCR-8[chemokine(C-C motif)receptor 8]作为细胞因子CCL-1的特异性受体,其功能与疼痛调节关系的研究尚未见报道。故本研究拟在小鼠切口痛模型的基础上,观察脊髓CCR-8表观遗传调控及其对痛觉敏化的影响。
材料与方法
试剂和仪器七氟醚(批号:11062431),异羟肟酸(Sigma公司,美国),漆树酸(Sigma公司,美国),抗H3K9(Sigma公司,美国)小鼠一抗、抗CCR-8小鼠一抗(Sigma公司,美国)和碱性磷酸酶标记马抗小鼠二抗(SC-2034,Santa公司,美国),Von Frey纤维丝、Model 400热痛刺激仪(IITC公司,美国)。
实验动物清洁级成年雄性昆明种小鼠64只,体重18~20g,由实验动物中心提供。所有小鼠实验前静养1周,12h/12h昼夜交替,温度(23±1)℃,自由进食饮水。实验动物使用遵守实验动物伦理的相关规定。
实验分组64只小鼠随机均分为:对照组(C组)、切口痛组(INC组)、切口痛+组蛋白去乙酰化酶抑制剂组(INC+SAHA组)和切口痛+组蛋白乙酰转移酶抑制剂组(INC+ACA组),其中每组10只用于疼痛行为学检测,每组另外6只于术后第4天检测脊髓H3K9和CCR-8蛋白表达。
小鼠切口痛模型制备小鼠七氟醚吸入麻醉后,碘伏消毒右后爪跖部,参照文献介绍的方法制备切口痛模型:使用手术刀片从足底近端向足趾方向纵行切开5mm的条形切口,切开足底皮肤后,用眼科镊提起足底肌肉并纵向钝性分离,保持其起止附着点完整。切口处纱布压迫止血,使用6-0尼龙丝线行褥式缝合,手术后肌注3万单位青霉素预防感染。
INC+SAHA组和INC+ACA组小鼠分别于术前1d、术前2h及术后连续1~4d每天上午行为学测试后腹腔分别注射50mg/kg的SAHA和5mg/kg的ACA,所有药物剂量和给药时间参考文献和预实验结果。
小鼠疼痛行为学记录术前1d(T0)、2h(T1)及术后1d(T2)、2d(T3)、3d(T4)、4d(T5)、5d(T6)、6d(T7)、7d(T8)、14d(T9)小鼠机械缩足阈值(mechani-cal withdrawal threshold,MWT)和 热 缩 足 潜 伏 期(paw withdrawal latency,PWL)。MWT检测:将有机玻璃箱置于铁丝网格上,小鼠置于有机玻璃盒预适应30min,以不同力度的Von Frey纤毛刺激大鼠足底,按照升序的序列从0.2g开始,以纤毛稍稍弯曲作为完全受力标准,持续刺激2s,连续5次,每次至少间隔15s。若3次不抬腿,换高一级克数的纤毛;有3次抬腿,则返回低一级克数的纤毛,直到每5次测试中有3次抬腿。能够引起3/5次抬腿的最低VonFrey纤毛的克数计为MWT值。
PWL检测:将有机玻璃箱置于3mm厚的玻璃板上,小鼠置于有机玻璃盒预适应30min,用热辐射刺激仪照射小鼠足底,照射开始至小鼠出现抬腿回避终止,热刺激强度在整个实验过程中维持一致,自动切断时间为25s,连续测定5次,每次间隔5分钟,取后3次平均值计为PWL值。
Western blot检测小鼠脊髓 H3K9和CCR-8蛋白表达戊巴比妥钠(30mg/kg)深麻醉下断头处死小鼠,冰上操作取L4~L6脊髓腰骶膨大段,参考文献 进 行Western blot检 测 各 组 小 鼠 脊 髓H3K9和CCR-8蛋白表达(H3K9和CCR-8一抗浓度为1∶500)。所得条带经Photoshop软件进行灰度分析,目的蛋白条带灰度值与相应β-actin灰度值之比反应目的蛋白表达。
统计分析采用SPSS 16.0统计学软件。计量资料以均数±标准差(珚x±s)表示。疼痛行为学指标采用双因素重复测量方差分析,组间两两比较采用Bonferroni t检验,Western blot数据使用单因素方差分析,组间两两比较采用q检验。
结果
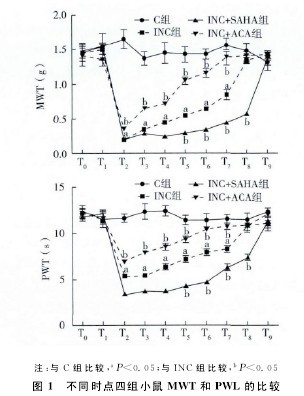
与T0时比较,T1~T9时C组MWT和PWL比较差异无统计学意义。与C组比较,T2~T7时INC组MWT明 显 降 低、PWL明 显 缩 短 (P <0.05)。与ICN组比较,T5~T8时INC+SAHA组MWT明显降低、PWL明显缩短(P<0.05),T2~T7时INC+ACA组MWT明显升高、PWL明显延长(P<0.05)(图1)。【图1】
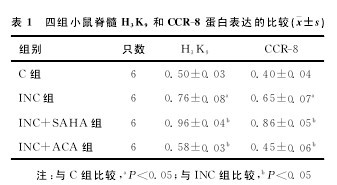
与C组比较,INC组H3K9和CCR-8蛋白表达明显增加(P<0.05)。与ICN组比较,INC+SA-HA组H3K9和CCR-8蛋白表达明显增加 (P<0.05);INC+ACA组H3K9和CCR-8蛋白表达明显减少(P<0.05)(表1)。【表1】
讨论
外周组织损伤或炎症产生对伤害性刺激产生过强的反应导致术后痛觉过敏,严重影响患者的术后恢复,其机制目前仍不十分清楚。研究发现,小胶质细胞在痛觉敏化过程中其重要作用,其通过趋化因子、促炎细胞因子、炎症介质等及其受体与神经元发生作用,参与痛觉敏化过程,其中趋化因子在该过程的作用 正 逐 步 受 到 重 视。
CCR-8作 为 趋 化 因 子CCL-1的特异性受体参与痛觉敏化的发展,其功能调节和痛觉敏化关系的研究尚不清楚。
表观遗传学是指DNA或周围染色质修饰,在不改变DNA序列的情况下影响基因的表达。组蛋白尾端赖氨酸共价修饰和DNA甲基化是已知的两种表观遗传调控形式,这种变化趋势持续存在且与细胞和组织长期适应性改变有关。目前,组蛋白乙酰化是研究最好组蛋白修饰形式,通过组蛋白乙酰转移酶(Histone acetyltransferases,HATs)和组蛋白去乙酰化酶(Histone deacetylases,HDACs)调节活性平衡:组蛋白乙酰化造成染色质松弛,转录活性增强;组蛋白去乙酰化造成DNA卷曲紧密,基因转录沉默。组蛋白乙酰化和去乙酰化被认为在生理和病理条件下其至关重要的作用,其中包括痛觉敏化过程。药理学研究显示,使用HAT或HDAC抑制剂阻断或刺激组蛋白乙酰化可影响多种疼痛模型的疼痛行为。本研究也发现使用HDAC抑制剂SAHA使小鼠切口痛模型术后第4~7天痛觉过敏增强,HAT抑制剂ACA则可缓解小鼠切口痛模型术后第2~6天痛觉过敏。进一步研究发现腹腔连续注射HDAC抑制剂SAHA后脊髓组蛋白H3K9和CCR-8表达明显增多,而HAT抑制剂ACA则明显减少脊髓组蛋白H3K9和CCR-8,这一结果也与疼痛行为学改变一致。
综上所述,脊髓水平趋化因子受体的表观遗传学调控机制在切口痛痛觉敏化过程中发挥重要作用,针对其药物干预将为临床切口痛治疗提供新的思路。





