摘 要: 表观遗传学作为近年来炙手可热的研究方向,主要描述发育过程中基因与环境间的相互作用,其研究已经深入到各个学科领域,在疾病筛查、诊断和治疗等方面获得了显着的突破.其中,DNA甲基化在不涉及基因序列的改变下,通过向特定碱基添加甲基基团从而调控基因的表达,在调节细胞增殖和分化中起着重要的作用,是当前表观遗传学研究的热点领域之一.异常的DNA甲基化与疾病的发生密切相关,广谱性去甲基化药物因具有特异性差等毒副作用,在临床中的使用受到了限制.研发具有靶向作用的DNA甲基化修饰技术将有助于临床上疾病的预防与治疗.
关键词 : 表观遗传学; DNA甲基化;疾病;靶向治疗;
Abstract: Epigenetics, as a hot research direction in recent years, mainly describes the interaction between genes and the environment in the process of growth. Epigenetics has been deeply studied in various disciplines and significant breakthroughs have been made in disease screening, diagnosis and treatment. Among them, DNA methylation plays an important role in the regulation of cell proliferation and differentiation by adding methyl groups to specific bases to regulate gene expression without involving changes in gene sequences, which is one of the hot areas of epigenetic research at present. Abnormal DNA methylation is closely related to the occurrence of diseases, and the use of broad-spectrum demethylated drugs in clinical practice is restricted due to their toxic and side effects such as poor specificity. The development of targeted DNA methylation modification technology will contribute to the prevention and treatment of clinical diseases.
Keyword: epigenetics; DNA methylation; disease; targeted therapy;
上个世纪50年代,英国发育生物学家Conrad Waddington首次提出表观遗传学的概念.表观遗传学主要是指在有丝分裂和减数分裂过程中DNA序列不发生改变,但基因的表达发生可遗传的、稳定的改变[1].表观遗传修饰的失调可能导致细胞在分化终端产生基因表达多样性,使原本正常的细胞出现异常增殖或其他变化,最终导致疾病的发生.表观遗传学现象很多,已知的有:DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA调控等方式[2].其中DNA甲基化通过调控基因的转录和表达,在细胞分化和疾病发生中发挥重要的作用,成为当前表观遗传学的热门研究领域.DNA甲基化是在DNA甲基转移酶(DNMTs)的作用下,以s-腺苷甲硫氨酸(SAM)为甲基供体,将甲基添加到特定碱基的过程.在成年脊椎动物体细胞中,主要发生在胞嘧啶-鸟嘌呤二核苷酸CpG中胞嘧啶第五位碳原子上[3,4,5].机体成熟以后,DNA甲基化保持动态平衡以维持正常的生理功能.如果DNA发生异常的甲基化可能造成多种疾病的发生,比如肿瘤、神经退行性疾病和自身免疫疾病等等.不同于基因突变,DNA甲基化修饰是一种可逆的修饰,这使得它成为疾病治疗时重要的潜在靶点[6,7].目前尽管有针对DNMTs的抑制剂如阿扎胞苷、地西他滨应用于临床上疾病的治疗,但药物特异性差,高剂量会诱发肿瘤转移等毒副作用限制了其使用.因而开发针对特定基因的靶向去甲基化策略和方法具有重要的科学意义和临床意义.本文首先讨论了DNA甲基化/去甲基化机制,接着描述了DNA甲基化的异常与疾病发生的相关性,最后总结了临床上与甲基化相关的治疗手段,提出具有靶向修饰能力的基因编辑技术在治疗各种异常甲基化模式的疾病中将有很好的应用前景.
1、 DNA甲基化
70年前,DNA甲基化修饰第一次在牛胸腺组织DNA中发现[8].直到1980s我们才确认DNA甲基化有调控基因表达和细胞分化的作用[9,10].甲基化的主要形式有5-甲基胞嘧啶(5mC)、6-甲基腺嘌呤(6mA)、7-甲基鸟嘌呤(7mG),后两者在调控基因表达方面的作用少有报道,因此本文主要探讨5mC.
在哺乳动物中,DNA甲基化大多发生在CpG中胞嘧啶的第5位碳原子上.哺乳动物中的CpG主要以两种形式存在:(1)分散存在于DNA序列中;(2)以高度聚集的CpG岛状态存在于转录调控区,如启动子区域.CpG岛为长度不小于500 bp, GC含量不少于55%的序列.在正常组织中,80%分散存在的CpG被甲基化修饰,而转录调控区域的CpG岛则是低甲基化的[11].当转录调控区域的CpG岛发生甲基化修饰时,可招募序列特异性甲基化结合蛋白(MeCP)与甲基化的CpG岛结合,MeCP与组蛋白去乙酰化复合物结合直接作用于组蛋白去乙酰化,接着染色体处于紧缩状态,阻碍转录因子与顺式作用元件的结合,使DNA组装成核小体后不能启动转录,从而下调相关编码基因的表达,最终影响细胞的分化以至造成疾病的发生,因而研究CpG岛的甲基化情况尤为重要[6,12,13,14],如图1所示[14].
图1 DNA甲基化抑制基因表达
Fig.1 DNA methylation inhibits gene expression
哺乳动物中,DNA甲基化是一种共价修饰过程,在DNA甲基转移酶(DNMTs)的作用下,以s-腺苷甲硫氨酸(SAM)为甲基供体,将甲基添加到胞嘧啶的第5位碳原子上,形成5-甲基胞嘧啶(5mC)[15,16].DMNTs主要包括两大类:一是催化未甲基化DNA双链从头甲基化的DNMT3a和DNMT3b; 二是维持DNA半保留复制后甲基化状态的DNMT1.研究发现,小鼠中缺乏DNMT1和DNMT3b具有胚胎致死性[15].另一方面,随着甲基胞嘧啶双加氧酶TET家族的发现,DNA去甲基化的研究实现重大进展[17].在TET的催化下,5 mC被氧化生成5 hmC、5 fC 5 caC,然后被TDG特异性识别剪切,最终被碱基修复重新形成胞嘧啶,实现去甲基化[15,16,18,19],如图2所示[19].研究发现TET去甲基化酶在小鼠早期胚胎发育和干细胞多能性的维持中发挥重要的作用.特别是TET3在小鼠受精卵原核期的雄原核中承担了主动去甲基化的作用[20].
图2 DNA的甲基化与去甲基化
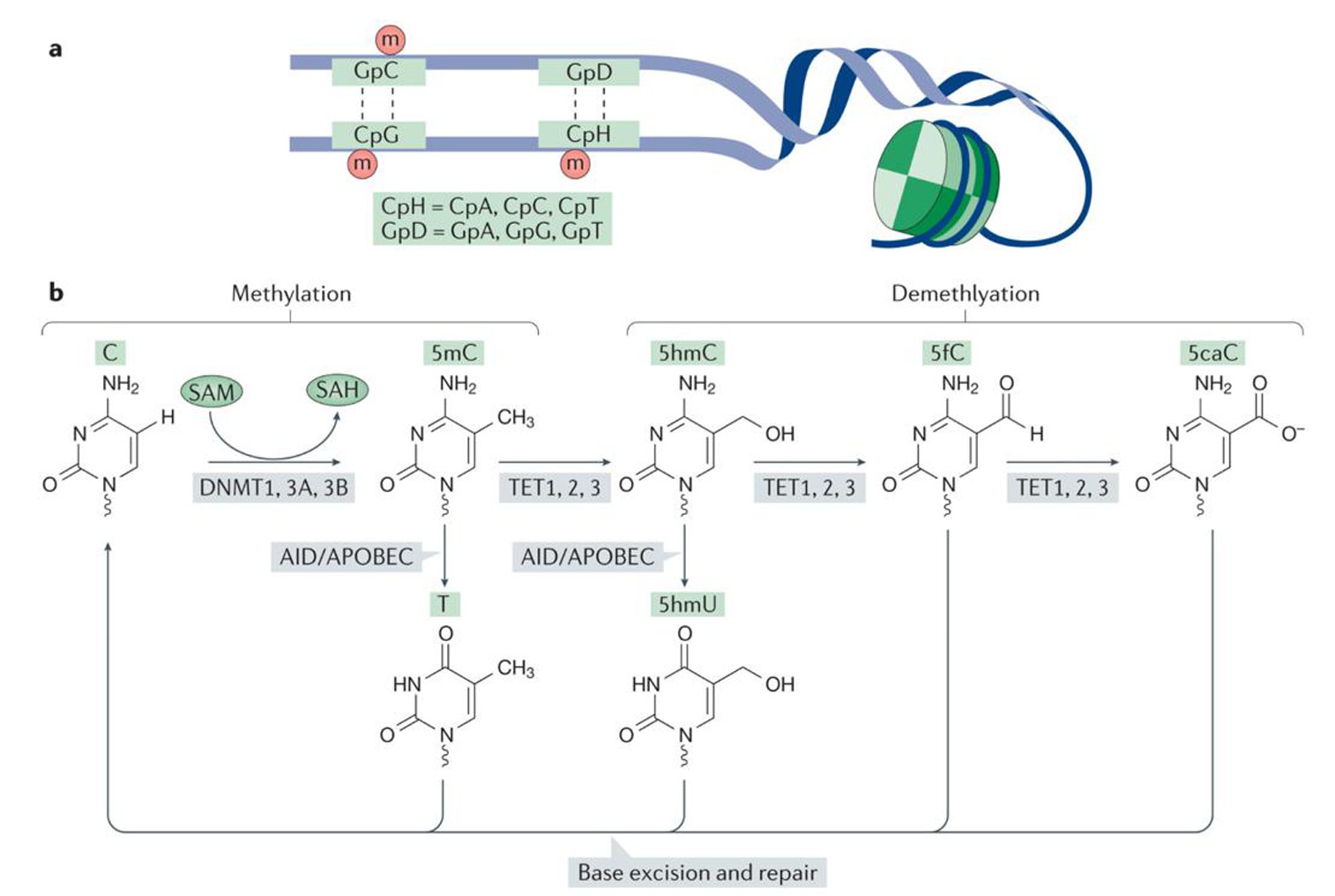
Fig.2 DNA methylation and demethylation
2 、DNA甲基化与疾病
大量研究表明,DNA甲基化异常往往会引起DNA构象、染色质结构及DNA稳定性的改变,从而抑制相关基因的转录调控,导致多种信号通路包括细胞周期、凋亡、DNA损伤和免疫识别等路径发生改变.这种异常的DNA甲基化状态最终容易造成多种疾病的发生,如肿瘤、血管类疾病,神经性疾病等.另一方面,DNA甲基化状态还可以作为疾病筛查、预防、诊断和预后的重要指标.
2.1、 肿瘤
肿瘤的发生常常是从单个细胞的异常开始的,肿瘤的生长与侵袭转移所需的表型很大程度取决于初始细胞中存在的基因突变或表观遗传尤其是DNA甲基化异常.大量医学研究表明,在各种致癌因素的作用下,正常细胞会出现整体甲基化程度降低以及某些抑癌基因和DNA修复基因启动子区域甲基化水平升高的情况[6].最终会造成原癌基因的表达激活,以及抑癌基因和修复基因的表达失活,导致肿瘤的发生[7,12].比如在卵巢癌和乳腺癌中由于抑癌基因RASSF1A启动子区域的高甲基化而使基因表达缺失[21,22];脑膜瘤中NF2、TRAF7、AKT1基因因甲基化异常成为高频突变基因[23];重要的DNA损伤修复基因GSTP1启动子区域发生甲基化异常也会缩短肝癌患者生存期[24].与甲基化有关的酶的突变也可造成肿瘤的发生,比如DNA甲基双加氧酶TET2基因异常会导致骨髓生成异常及恶性髓系疾病的发生[25];DNA甲基化转移酶DNMT3a中R878H的突变往往诱发AML[26];异柠檬酸脱氢酶IDH1和IDH2突变产生的异常代谢物会抑制去甲基化酶活性,这也是脑胶质瘤发生的重要原因[27].
启动子区域的甲基化情况亦可以作为肿瘤前期筛查和预后的临床指标,早在2005年,德国海涅大学的Schmiemann V通过发现肺癌中存在RASSF1A、APC、P16、MGMT等基因的异常甲基化,从而提出利用利用甲基化检测进行肺癌的早期筛选与诊断[28].目前为止,多家研究机构已经证实DNA甲基化可用于肺癌、乳腺癌、结肠癌、肝癌这4种常见肿瘤的诊断,准确率高达95%.DNA甲基化检测为肿瘤的风险筛查和预防提供了新的机遇[29].
2.2、 血管类疾病
心脑血管类疾病是一种常常发生在50岁以上人群中严重威胁人类健康的疾病.主要表现为,由于高血压、高脂血症或动脉粥样硬化引发血管内膜损伤以及形成动脉血栓,最终导致大脑、心及全身多器官组织发生出血或缺血性病变[30].
过去几年中,对血管类疾病研究的方向开始转向表观遗传学[31].研究发现DNA甲基化在血管类疾病的致病过程中扮演着重要的作用.比如,在体外实验中使用低密度脂蛋白LDL刺激人脐静脉内皮细胞(HUVEC)后将会上调细胞中DNMT1的表达,使抑炎因子KLF2启动子区域高甲基化.发生高甲基化的KLF2基因表达水平下调,增强了血管类疾病发病过程中炎性反应[32].Pfeiffer L采用全基因组甲基化芯片检测发现,ABCG1基因中cg06500161位点甲基化情况与甘油三酯水平有一定相关性[33].流行病学研究显示,白细胞中ALU基因的高甲基化与中国人群中CVD和肥胖现象密切相关[34].因此DNA甲基化通过调控相关基因的表达,从而调节脂质代谢以及血管类疾病的进程.
2.3、 自闭症
自闭症又称为孤独症,起病于婴幼儿期,主要表现为不同程度的语言发育障碍和人际交往障碍,是一种广泛性发育障碍亚型[35].在形成受精卵初期,源于配子的甲基化模式会被重置,除了大量启动子CpG岛被特异性识别维持未甲基化状态外,几乎整个基因组都被重新甲基化,随后在每个个体中建立新的一套甲基化图谱[36].这一过程对初期大脑神经发育尤为重要,异常的甲基化修饰将对胎儿发育造成严重后果.CpG位点甲基化差异与新生儿注意力、运动质量和发育有很紧密的联系.比如,编码糖皮质激素受体基因NR3C1的甲基化水平与新生儿注意力评分呈负相关;HSD11B2启动子区域的甲基化水平升高会抑制新生儿的肌张力,严重影响运动质量.然而自闭症并不是单基因致病疾病,随着对其研究的深入,已经发现上百个与自闭症相关的候选基因,比如OXTR、SHANK3、GAD65、RELN、UBE3A 和MECP2等[37,38,39].其中MECP2被认为是导致自闭症的关键基因,与启动子区域发生高甲基化的BDNF基因共同在大脑神经发育过程中扮演着重要的作用[39].
DNA甲基化在一些其他的人类疾病中也起着重要的作用.比如,在脆性X综合征患者中,由于早期发育时FMR1基因启动子区发生从头甲基化,导致FMR1基因CpG岛高甲基化,使得FMR1表达活性降低,并且这一基因抑制作用维持在整个生命过程中[40].另一方面,在某些印记基因疾病比如:Beckwith-Wiedemann syndrome、Rett syndrome、Angelmansyndrome中,来自父方或母方的基因会由于甲基化的调控而出现异常的表观修饰,一旦一方的染色体出现缺陷,又不能由另一方进行功能弥补时就会导致疾病发生.
3、 相关治疗
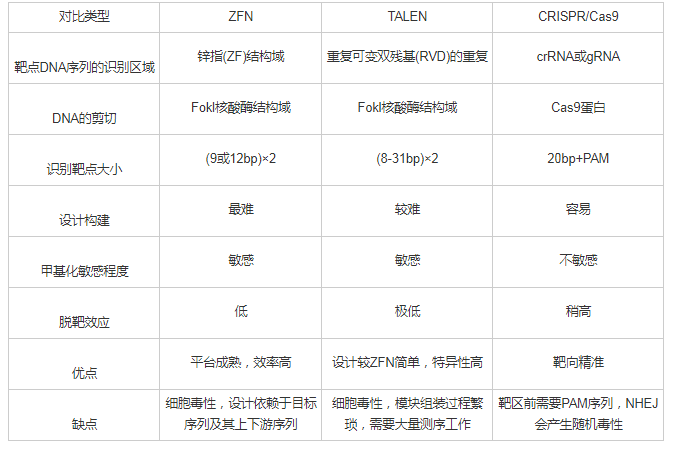
DNA甲基化不涉及基因序列的改变,只是碱基上发生甲基基团的修饰,它是一个可逆的表观遗传学修饰过程.使用药物调控DNA甲基转移酶DNMTs已经成为近年来疾病治疗的重要靶点.阿扎胞苷azacitidine(AZA)是第一个被美国食品药品监督管理局(FDA)批准用于MDS治疗的DNMTs抑制剂药物.紧接着,AZA类似物地西他滨decitabine(DAC)也获得了FDA批准治疗MDS[41,42].目前多种新型的药物联合治疗也进入大众的视野.比如,DNMTs抑制剂DNMTis联合组蛋白去乙酰化酶抑制剂HDACis用于治疗非小细胞肺癌,结果显示药物联用有效地抑制了MYC信号通路,并激活CCL5,显着改善了肿瘤微环境[43].然而这些广谱性去甲基化药物在临床治疗中存在不可忽视的毒副作用,比如缺乏靶向性,不能针对某一特定抑癌基因进行去甲基化;高剂量的会引起骨髓抑制、诱导肿瘤转移;并且药物毒性会损害人体正常细胞,具有潜在的致癌性[44,45].在AZA、DAC与其他药物联合过程中剂量的使用与疗效叠加的机理亦需要更多的临床前验证.因此开发针对特定靶点的特异性去甲基化策略和方法具有重要的科学意义和临床意义.随着基因编辑技术的发展,利用ZFN[46]、TALEN[47]、和CRISPR/Cas[48]这三大基因定点修饰技术对目的基因进行编辑已经开始越来越多地应用于生命科学领域[49],如图3所示[49].
图3 ZFN, TALEN和CRISPR的分子生物学途径示意图
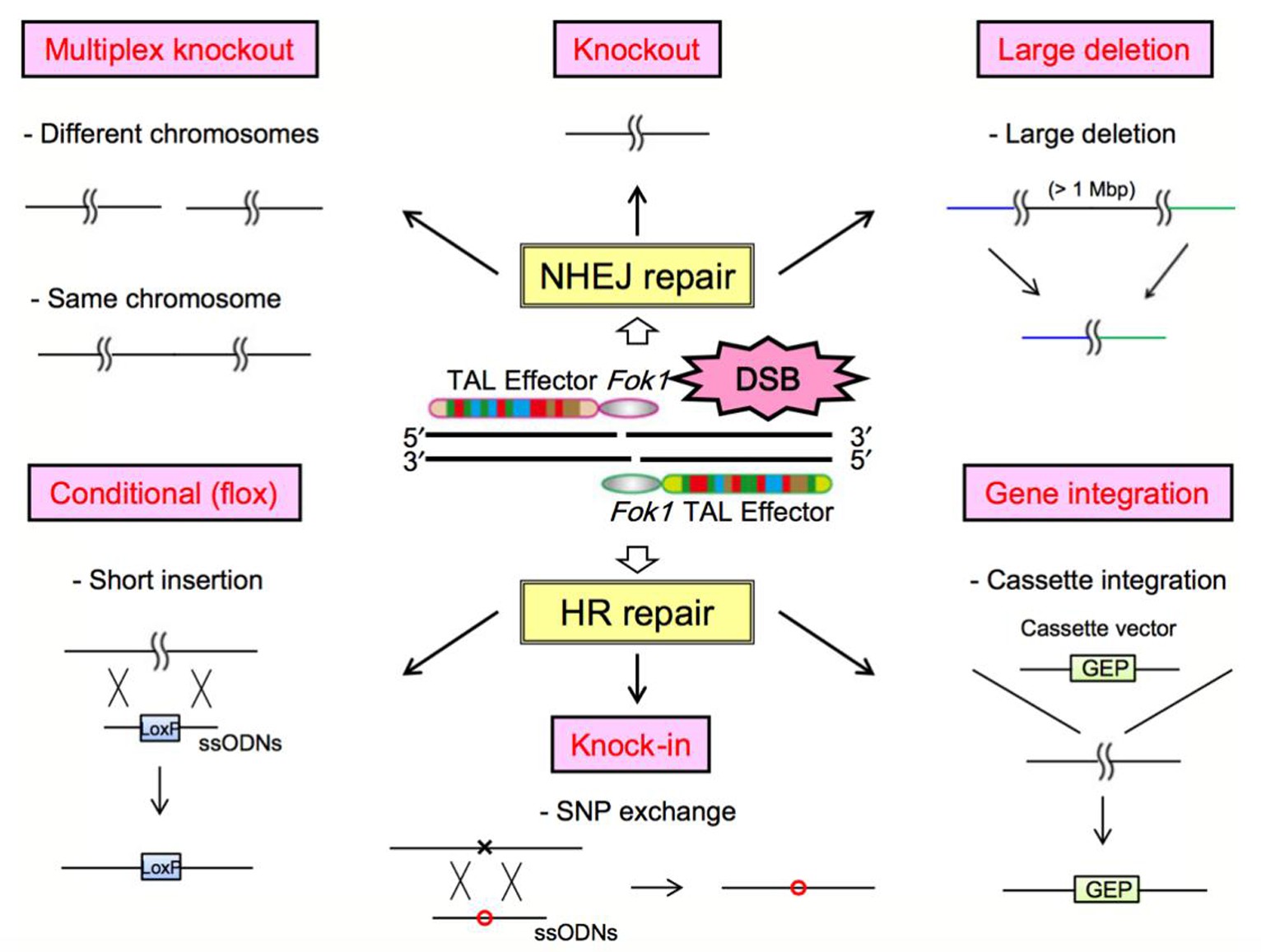
Fig.3 Molecular biological pathways of ZFN, TALEN, and CRISPR
3.1 、ZFN
锌指核酸酶(Zinc-finger nuclease, ZFN)是第一个使用DNA核酸内切酶进行靶向基因编辑的技术[50].ZFN是异源二聚体,包含负责特异性识别序列的锌指DNA结合域(ZFD)与非特异性的Fokl限制性内切酶.每个锌指DNA结构域包含3个独立锌指,每个锌指能单独识别3~4个碱基序列,因此可通过改造锌指DNA结构域而靶向定位于不同的DNA序列[51].从ZFN基因编辑技术诞生伊始,科学家们就研究如何将其应用于表观遗传学领域.约翰霍普金斯大学的Marc Ostermeier通过对ZFN进行改造,将一种裂开的CpG甲基转移酶M.SssI与锌指DNA结合域(ZFD)进行连接,靶向到人类细胞间粘附分子ICAM1基因启动子区的一个特定CpG位点上,结果显示该CpG位点被特异性高甲基化,可用于研究单一CpG位点的甲基化对基因表达的影响[52].另外,构建融合甲基化转移酶的ZFN,将其引导至原癌基因EpCAM启动子区,使EpCAM由于启动子高甲基化而表达失活,可用于研究伴随EpCAM高表达的肿瘤治疗的新方法[53,54].在植物的研究中,将甲基化双加氧酶TET1和ZFN融合后,靶向到FWA启动子区,FWA基因由于启动子区域发生去甲基化导致其表达水平增高,出现的花期延迟的现象[55,56].
3.2 、TALEN
由于ZFN制作繁琐、成本高,不久后一种结构相似的但更灵活的基因编辑系统诞生了,这就是转录激活样效应因子核酸酶技术TALEN[57].与ZFN相似,TALEN也是由可识别特定DNA序列的中央结构域和核酸内切酶组成.其中,DNA识别域由一系列重复的TALE蛋白串联而成,每个TALE蛋白可识别一个碱基,核酸内切酶Fokl一般以二聚体的形式行使功能.在表观遗传学的研究中,与ZFN一样,我们可以构建TALEN与甲基双加氧酶TET或甲基转移酶DNMT融合,然后靶向到基因启动子区重新编辑甲基化状态,最终实现目的基因表达的激活或失活[47].比如,近期研究在小鼠胰岛瘤βTC-6 β细胞中用TALE-DNMT靶向Meg3基因启动子,使基因由于高甲基化而失活,最终提高了β细胞的敏感性,这有助于我们对二型糖尿病发病原理进行进一步的研究[58].此外,还可以利用TALEN的靶向基因编辑技术,对K562细胞系进行DNMT3A R882H突变,甲基化转移酶突变后,一系列与谷胱甘肽合成有关的基因CTH、PSPH、PSAT1表达均上调,明显促进了细胞的增殖,这有利于后续实验中我们对细胞药物耐受机制的研究.
3.3、 CRISPR/Cas
CRISPR/Cas系统由CRISPR序列元件与Cas基因家族组成.成簇的规律间隔的短回文重复序列CRISPR最早是在细菌的天然免疫系统内发现,在其附近存在高度保守的具有核酸酶活性的Cas基因,可以在crRNA的引导下实现对DNA序列的靶向切割[59,60,61].CRISPR/Cas自发现起就被广泛应用于基因敲除、转基因模式动物的构建、基因治疗等生命科学领域[62].近年来,CRISPR系统也开始应用于表观遗传学中的DNA甲基化修饰.通过对Cas9进行改造,利用点突变使核酸酶Cas9蛋白的H840A和D10A位点失活,获得无切割活性而只有结合DNA能力的dCas9.dCas9起着桥梁连接作用,在sgRNA的引导下,将具有各种不同催化活性的功能酶靶向至目的基因,最终实现不同的基因编辑作用[63].比如,中科院上海生命科学院Xu等向传统的sgRNA中插入噬菌体MS2 RNA元件,然后将DNA甲基化双加氧酶Tet1与dCas9融合,靶向到目的基因位点,使基因启动子区域发生特异性去甲基化,最终上调RANKL、MAGEB2、MMP2基因的表达[48,55].另一方面,将甲基转移酶DNMT3a、DNMT3L与dCas9融合,也能实现对靶序列进行特异性甲基化编辑[64].如表1所示,和TALEN技术只能实现在距离靶序列30 bp范围内的进行DNA甲基化编辑能力相比,对CRISPR系统进行改造后能实现在距离靶序列100 bp范围内大于90%的去甲基化效果[63,65].
ZFN和TALEN都是由结构中的DNA结合域识别碱基序列发挥靶向作用的,ZFN技术是最早被广泛应用的基因定点修饰技术,但由于自身的三联属性,使得设计繁琐,并且ZFN具有细胞毒性,因此大大限制了它的推广.TALEN技术有比ZFN更低的细胞毒性和脱靶效率,很多商业公司可以提供组装好的三联密码子和四联密码子模块,缩短TALEN的构建周期.但TALEN模块组装过程繁琐,很多实验室难以自行构建TALEN,因此限制了它在基础医学研究领域的推广.传统的CRISPR/Cas由sgRNA进行引导,一般识别20 bp序列,与ZFN和TALEN相比更容易发生脱靶[66].但CRISPR/Cas具有易于构建以及能靶向多个基因位点的自身优势,使其迅速应用于哺乳动物细胞的基因编辑中[65].
表1 ZFN,TALEN和CRISPR/Cas9三种基因定点修饰技术的比较
目前对DNA甲基化在生命科学领域的重要性已经有了较为深刻的认识,但仍有许多问题值得我们去探讨.DNA甲基化是贯穿于整个发育过程中的一种动态平衡方式,身体内所有的细胞都包含相同的DNA序列,但它们的甲基化模式是不同的.如前文所述,异常的DNA甲基化与各种疾病的发生发展密切相关,然而这里面或许还隐藏着与DNA甲基化有关的更多的生物学秘密等待我们去挖掘.由于DNA甲基化是一种可逆的表观修饰,使其成为重要的治疗靶点,目前对DNA甲基化的基因编辑仍处于基础研究及临床初期阶段,安全问题不可忽视.希望随着基因编辑技术的发展,能帮助我们进一步理解DNA甲基化如何在特定背景下调节基因的表达,并且在将来可以治疗一部分让医学界至今束手无策的疾病.
参考文献
[1] DUPONT C,ARMANT D R,BRENNER C A. Epigenetics.definition,mechanisms and clinical perspective[J] Seminars in Reproductive Medicine. 2009,27:351-357.
[2] JAENISCH R,BIRD A. Epigenetic regulation of gene expression:how the genome integrates intrinsic and environmental signals[J].Nature Genetics 2003,33.245-254.
[3] TIRADO-MAGALLANES R.,REBBANI K,LIM R,et al.Whole genome DNA methylation:beyond genes silencing[J] Oncotarget,2017,8:5629-5637.
[4] MILLER C A.SWEATT J D.Covalent modification of DNA regulates memory formation[J.Neuron,2007,53:857-869.
[5] CUI D,XU X.DNA Methyltransferases,DNA Methylation, and Age-Associated Cognitive Function[J] International Journal of Molecular Sciences ,2018,19:16.
[6] BAYLIN S BJONES P A.A decade of exploring the cancer epigenome - biological and translational implications[J].Nature Reviews Cancer,2011.11:726-734.
[7] AHUJA N,EASWARAN H,BAYLIN S B.Harnessing the potential of epigenetic therapy to target solid tumors[J].The Journal of Clinical Investigation,2014,124:56-63.
[8] HOTCHKISS R D.The quantitative separation of purines, pyrimidines and nucleosides by paper chromatography[J]. The Journal of Biological Chemistry, 1948,175:315-332.
[9] HOLLIDAY R,PUGH J E DNA modification mechanisms and gene activity during development[J]. Science (New York,.NY),1975, 187:226-232.
[10] COMPERE S J,PALMITER R D.DNA methylation controls the inducibility of the mouse metallothionein-I gene lymphoid elsl[J]Cell,1981,25.233-240.
[11] JONES P A.Functions of DNA methylation:islands ,start sites,gene bodies and beyond[J] .Nature Reviews Genetics,2012,13:484-492.
[12] DOR Y,CEDAR H. Principles of DNA methylation and their implications for biology and medicine[J].Lancet (London, England),.2018,392:777-786.
[13] SANDOVAL J.ESTELLER M.Cancer epigenomics beyond genomics[J]. Current Opinion in Genetics & Development,2012.22:50-55.
[14] SHEN H,LAIRD P W.Interplay between the cancer genome and epigenome[J].Cell,2013, 153:38-55.
[15] WU H,ZHANG Y.Reversing DNA methylation:mechanisms, genomics, and biological functions[J]. Cll,2014,156.45-68.
[16] KOHLI R M,ZHANG Y.TET enzymes,TDG and the dynamics of DNA demethylation[J]Nature ,2013,502:472-479.
[17] LID,GUO B,WU H,et al.TET family of dioxygenases crucial roles and underlying mechanisms[J]. Cytogenetic and Genome Research,2015, 146:171-180.
[18] WU S C,ZHANG Y.Active DNA demethylation:many roads lead to Rome[J].Nature Reviews Molecular Cell Biology,2010,11:607-620.
[19] VOGEL CIERNIAA,LASALLE J.The landscape of DNA methylation amid a perfect storm of autism aetiologies([J] Nature Reviews Neuroscience,2016,17:411-423.
[20] KOTHARI R M,SHANKAR V.5-Methylcytosine content in the vertebrate deoxyribonucleic acids:species specificity[J].Journal of Molecular Evolution,1976,7:325-329.
[21] HAMPTON T.New markers may help predict prostate cancer relapse risk[J.Jama,2006.295.2234-2238.
[22] SAHM F,SCHRIMPF D,STICHEL D,et al. DNA methylation-based classification and grading system for meningioma:a multicentre,retrospective analysis[J].The Lancet Oncology.2017,18:682-694.





