
离子液体(Ionic liquids,ILs)具有几乎为零的蒸汽压、高的热稳定性、化学稳定性、宽的液态温度范围、较强的溶解性与催化活性等优异理化特性,因而被称为21世纪的“绿色溶剂”,现已被广泛应用于分离与萃取[1,2]、电化学[3,4]、纳米技术[5,6]、生物技术[7]以及工程技术[8,9]等各个领域中。
酶是活细胞产生的一类具有催化功能的生物大分子,酶催化的反应称为酶促反应。大量的研究表明:酶促反应具有高效、高选择性和反应条件温和等特性[10],作为一种绿色合成方法是现代合成方法学的重要发展方向之一。酶促反应的介质最初采用的是水,但在水中酶分子的空间结构容易改变而失去催化活力[11],另外许多有机反应难以在水相中进行;直至非水介质中酶促反应研究的出现,极大推动了酶在合成化学中的应用[12,13]。结合酶和ILs的优点,所以ILs中的酶促反应引起了研究者的关注。现在ILs中的酶催化反应主要包括有机合成反应[14]和聚合反应[15]两大类,由于酶和ILs两者都具备对环境友好的优点,所以在ILs中的酶促反应是极具研究意义的课题之一。本文对近年来在ILs中的酶促反应进行了综述。
1 离子液体中酶促有机合成反应
脂肪酶(Lipases)是由活细胞产生的具有催化功能的蛋白质分子,它通常具有催化活性,因此酶通常被作为催化剂。
近年来酶催化反应的研究越来越受到关注,其中酶应用于小分子催化反应主要包括:酯交换反应、水解反应和氧化还原反应等[16]。
Lazano P等[17]以脂肪酶催化丁酸乙烯酯与正丁醇的酯交换反应合成丁酸丁酯,反应介质采用4种ILs([C2MIm]-BF4、[C2MIm]NTf2、[C4MIm]PF6和[C4MIm]NTf2)以及2种有机溶剂(正丁烷、己烷),研究结果表明脂肪酶在ILs中的催化活性远高于其在有机溶剂中的活性,并且酶的活性随着ILs极性的增强而增大,在连续操作过程中脂肪酶也仍然保持着较高的活性。
Nara S J等[18]研究了2-羟甲基-1,4-苯丙二氧烷与乙酸乙烯酯在疏水性和亲水性ILs中进行的酯交换反应,亲水性ILs中酶的活性与其在有机溶剂中的活性相当,而疏水性ILs中酶的催化活性明显高于其在亲水性ILs中的活性。
酶具有高度的选择性,酶在不对称合成领域也有着广泛的应用。
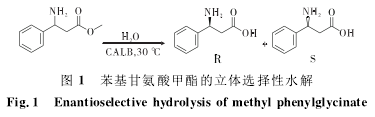
Liu Y Y等[19]采用酶催化水解的方法合成手性β-氨基酸(图1),结果表明,在ILs中的反应可以很好提高R构型产物的比例。
2 离子液体中酶促聚合反应
ILs中酶促聚合反应包括缩聚反应、自由基聚合反应和开环聚合反应等[10],酶催化聚合反应可以在温和的条件下高效专一地合成普通方法难以合成的功能高分子,且对环境友好,具有其它合成方法无可比拟的优越性。
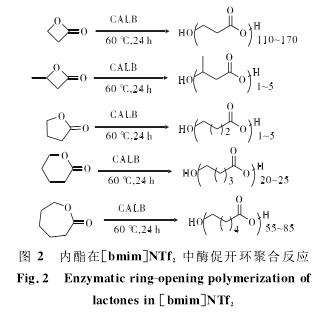
Gorke J T等[20]研究了5种不同的内酯(β-丙内酯、β-丁内酯、γ-丁内酯、δ-戊内酯和ε-己内酯)在[bmim]NTf2中,CALB(Candida antarctica lipase B)酶催化开环聚合反应(图2)。当单体(β-丙内酯、δ-戊内酯和ε-己内酯)与酶的比例为1∶100(质量比)时,聚合度分别为170、25和85;当单体为β-丁内酯、γ-丁内酯时,聚合度仅为5;β-丙内酯与β-丁内酯共聚所得聚合物的聚合度高达180;另外,实验还考察了水的含量对酶催化聚合反应的影响,当ILs中水的含量从1.95%减小到0.60%时,聚合物的分子量从8000g/mol增加到20000g/mol;实验还发现,聚合反应在强亲水性的ILs([bmim]-NO3、[bmim]N(CN)2、[bmim]EtSO4)中无法进行。
Yo-shizawa-Fujita M等[21]利用L-丙交酯在3种ILs([bmim]-BF4、[bmim]PF6、[bmim]NTf2、[bmim]N(CN)2)中进行开环聚合,实验发现聚丙交酯在 [bmim]BF4、[bmim]PF6、[bmim]NTf2中均能聚合,其中在[bmim]BF4中聚合的分子量最高为55000g/mol,其中在[bmim]PF6中聚合的分子量为4000g/mol,均比在甲苯中聚合的分子量要高,但是产率都较本体聚合的低,主要是因为ILs对聚合物有良好的溶解性,聚合物不能及时从ILs中分离出来。
Chanfreau S等[22]在[hmim]PF6中利用Novozyme-435分别催化丙交酯、丙交酯与乙交酯发生均聚和共聚反应,在90℃时聚丙交酯的产率为63%,分子量为37800g/mol;首次实现了在[hmim]PF6中Novozyme-435催化丙交酯与乙交酯共聚反应,同时对共聚物进行了表征。Marcilla R等[23]报道了己/辛二酸甲酯与丁二酸在[bmim]NTf2、[bmim]PF和[bmim]BF4中Novozyme-435酶催化缩聚反应(图3),比较了在ILs中敞开条件和本体真空条件下的聚合效果,实验表明在ILs中敞开条件下聚合,不仅简化了聚合操作,而且提高了聚合物的分子量(Mn)。
Dordick J S课题组[24]研究利用大豆过氧化酶(Soybean peroxidase,SBP)在ILs中催化酚类物质的聚合反应,聚合物的分子量在1200~4100Da之间,在90%(体积分数)[bmPy][BF4]的水溶液中,大豆过氧化酶表现出良好的活性。

3 ILs膜修饰的酶用于聚合反应
酶活性的维持需要在少量水分子的微环境中,疏水性ILs能够很好保护这种微环境,从而保持酶分子的二级结构不发生改变,酶的催化活性才能够得以维持。
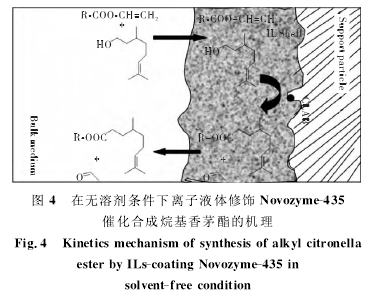
Lozano P等[25]利用ILs修饰的Novozyme-435(ILs-coating Novozyme-435)在无溶剂的条件下催化合成烷基香茅酯,研究表明烷基香茅酯的转化率和纯度竟达到100%,其酯化的机理如图4所示。
同样,Fischer F等利用ILs-coating Novozyme-435催化合成甲基葡萄糖脂肪酸酯,研究表明ILs-coating Novozyme-435的催化效率明显高于在ILs中Novozyme-435的,实验发现ILs的极性越大其催化产率越高。
Dang D T等[27]研究了ILs(亲水和疏水性两类)修饰后的酶催化水解反应,结果表明经ILs修饰后的酶的催化活性明显高于自由酶,并且具有良好的可循环利用性,可能原因是ILs的存在保持了酶的二级结构从而提高了酶的活性中心与底物的接触机会。
Lee JK等[28]利用[PPMim]PF6(PPMim=1-(3-苯丙基)-3-甲基咪唑)修饰的酶催化酯化反应,研究表明经ILs修饰的酶具有良好的立体选择性和催化活性。Dong F X等[29]利用[bmim]-PF6修饰的Novozyme-435催化1,4-二氧六环-2-酮(PDO)开环聚合,结果表明,聚1,4-二氧六环-2-酮(PPDO)的最大分子量可达182100g/mol,其分子明显高于以[bmim]PF6为溶剂时的分子量。
武汉大学贺枫教授课题组[30]系统地研究了ILs-coatingNovozyme-435催化ε-己内酯的开环聚合反应,实验发现经ILs修饰的Novozyme-435催化得到的聚合物的分子量(Mw)明显高于未经修饰的,酶的催化活性与ILs的物化性质(黏度、极性)有着一定关系,黏度越大,极性越小越有利于酶活性的保持。
4 ILs对酶催化活性和稳定性的影响
酶的活性和稳定性与其所处的溶剂微环境有着直接的关系[31]。由于ILs具有结构高度可设计性的特点,这就使得ILs的种类繁多,探究ILs的物化性质(阴阳离子的结构、黏度、亲疏水性、极性、阴离子的亲核性)与酶的活性和稳定性之间的关系,可以提高研究ILs中酶促反应的针对性,这样可指导设计合成出对酶的活性和稳定性有利的ILs可以说意义重大。
4.1阴阳离子的结构
ILs是由阴阳离子组成的,可以通过改变阴阳离子的结构来改变ILs的种类,不同种类的ILs对酶有着不同的作用。
Kl?hn M等[32,33]将CALB酶溶解在8种不同的ILs中,利用分子动力学模拟阴阳离子与酶分子的相互作用,认为阴离子与酶之间的作用是库仑作用,是主导作用。酶在不同阴离子的ILs的稳定性顺序是:PF6->BF4-?NO3-;阳离子与酶之间的作用是范德华作用,是次要作用,酶与离子之间的作用力大小由离子的尺寸大小、离子表面电荷密度的分布来决定,阳离子尺寸越小、表面电荷密度越大越容易使酶失活,另外,含有长烷基链或强极性的甲氧基链的胍盐型ILs更容易使酶失活。实验还发现离子会向酶分子极性一端聚集,带有长烷基链的离子会向酶分子非极性一端聚集。
4.2 ILs的黏度
ILs的黏度一般比普通有机溶剂的黏度要大[34],ILs的黏度对酶催化活性的影响,对于不同反应有着不同的结论。酶在ILs的溶解性较差,所以ILs中的酶催化反应大多数是异相反应,就必须考虑分子间和分子内的传质阻力。
van Ra-ntwijk等[7]认为ILs的黏度越大越有利于酶的空间结构的保持。然而,Lozano等研究ILs的黏度对胰凝乳蛋白酶活性的影响,发现胰凝乳蛋白酶在[emim]
NTf2(黏度34mPa·s)中的活性要高于在[mtoa]NTf2(黏度574mPa·s,mtoa为甲基三辛基铵)中的。而Zhao H等[35]在研究乙基丁酸与正丁醇在20多种ILs中发生酯化反应时,发现ILs的黏度不是影响酶活性的主要因素。
4.3 ILs的亲疏水性
ILs的亲疏水性用lgP(P表示ILs在水和溶剂中的分配系数)表示,lgP值越大说明ILs的疏水性就越大,ILs的疏水性越强越有利于酶的稳定性和催化活性的提高。Lou W Y等[36]研究不同ILs中酶催化(R,S)-1-三甲基硅乙醇与醋酸乙烯酯进行的酯化反应,实验发现Novozym-435的催化活性随着ILs的疏水性减弱 ([BMIm]BF4>[OMIm]BF4>[C7MIm]BF4>[HMIm]BF4>[C5MIm]BF4>[BMIm]BF4)而减弱。
Shen Z L等[37]报道利用酶催化醇类氰化反应,实验发现PS酶在疏水性的[OMIM]PF6中,立体选择性高达80%,而在亲水性的 [HMIM]BF4和 [HMIM]Cl中 只有5%。
4.4 ILs的极性
一般的ILs中烷基链越长,烷基的结构越复杂,极性越小;在阳离子结构相同的情况下,阴离子使ILs的极性降低的顺序是: NO3->BF4->NTf2->PF6-[38,39]。
Park S等[40]研究酶(Pseudomonas cepacia)催化1-苯基乙醇与醋酸乙烯酯的酯交换反应,实验发现酶的催化活性随着ILs的极性增强而减弱。而Lozano P等[41]
在研究Novozym-435催化甲基-α-D-吡喃葡萄糖苷与脂肪酸的酯化反应,酶的催化活性随ILs的极性增强而增强。
4.5阴离子的亲核性
阴离子对酶的催化活性有着重要的影响作用,一般的阴离子的亲核性越强对酶的活性影响越明显。Kaar J L等[42]研究自由Candida rugosa酶催化甲基丙烯酸甲酯与2-乙基-1-己醇的酯交换反应,结果发现酶只有在疏水性的[bmim] -PF6中才有活性,而在亲水性的 [bmim]X(X= NO3-,CH3COO-,CF3COO-)中失活,他认为后面三者对酶的亲核性要高于PF6-的,从而导致酶蛋白质分子的立体构性发生改变。同样Kato K等[43]报道了CALB催化1-苯乙基胺与4-戊烯酸的选择性酰化反应,实验发现反应的速率随着ILs中阴离子亲核性(OTf-> BF4-> PF6-)的减弱而逐渐降低。
Lee S H等[44]研究了3种酶 (Novozyme-435,Rhizomucormiehei lipase,Candida rugosa lipase)在不同ILs中催化酯交换反应的速率。实验结果表明反应的速率随着ILs中阴离子亲核性的增强(Tf2N-< PF6-< OTf-< SbF6-<BF4-)而降低。为了减小ILs的阴离子对酶活性的影响,通常采取的措施是:(1)将游离的酶固定化,可以有效提高酶的活性;(2)增大ILs中阳离子结构,减小阴离子在ILs中的物质的量比。例如,Kragl U课题组[45,46]研究Ammoeng类ILs中的酶催化反应时,酶表现出良好的催化活性。
5 结语
由于ILs中酶促反应具有环境友好性的特点,所以其研究领域不断得到拓展,近几年有关的报道也越来越多,但是ILs中酶促反应也面临着问题和挑战。首先,由于ILs的结构种类繁多为了寻找对酶稳定性良好的新型ILs面临着不少困难;其次,ILs的物化性质(黏度、极性、亲疏水性等)与酶的活性之间的定量关系还需要进一步研究,探明他们之间的定量影响关系将为合成ILs中酶促反应提供理论和现实上的指导。





