
生长分化因子(growth differentiation factor-15,GDF-15)又名 MIC-1、PDF、PLAB、PTGFB 或 NAG-1,是转化生长因子β(TGF-β)超家族成员[1].GDF-15是一种分泌型二聚体蛋白,其基因位于19号染色体的p12.1-13.1,翻译后的前体蛋白由308个氨基酸残基组成,经剪切生成2条含112个氨基酸残基的多肽链,再通过分子间二硫键形成同源二聚体的成熟形式后,分泌到胞外发挥功能[2].GDF-15高表达于胎盘和成人的前列腺组织中,而在其他组织中低表达。在病理和应激环境下,GDF-15的表达量明显升高。多项研究表明,GDF-15不但参与免疫反应[4-5],与多种心脏疾病的诊断、预后存在相关性[3],而且与多种肿瘤的发生发展密切相关[6,7].
大量文献表明GDF-15在许多肿瘤组织中高表达,可以作为结肠癌、前列腺癌、胰腺癌的血清早期诊断标志物[8].与其他 TGF-β超家族成员相似,GDF-15能够通过活化细胞表面TGF-βⅠ型和Ⅱ型受体,从而募集并激活下游Smad信号通路来发挥其相应的生物学功能,可能在肿瘤发生的早期阶段发挥抑瘤作用,而在晚期阶段转而促瘤[9-10].
本实验室前期研究发现,GDF-15与肿瘤免疫逃逸密切相关[6],是潜在的肿瘤治疗靶标,我们拟采用抗体特异性阻断的方法在动物水平检验其靶向治疗的可行性。但市售的GDF-15抗体种类少、价格高,难以满足实验需求。因此,在本研究中,我们通过基因工程技术构建重组融合蛋白GDF-15的原核表达系统,获得纯度较高的抗原蛋白,在此基础上制备了高滴度的GDF-15多克隆抗体,为后续靶向治疗研究的开展奠定基础。
1 材料与方法
1.1 材料
BALB/c小鼠来自第四军医大学实验动物中心;HT29、sw480、caco-2结肠癌细胞购自ATCC;大肠杆菌BL21、DH5α,pET-32a(+)载体由本实验室提供。反转录试剂盒、限制性内切酶、DNA聚合酶购自TaKaRa公司;质粒提取试剂盒及胶回收试剂盒购自OMEGA公司;抗GDF-15抗体购自Abnova公司;兔抗人β-actin一抗、HRP标记的二抗购自中杉金桥公司;其他试剂均为分析纯产品。据已报道的人GDF-15基因编码区序列设计上游引物(5'-CGGGATCCATGGCGCGTGCGCG-3‘)和下游引物(5'-CCCTCGAGCTATATGCAGTGGCAGTCTTTGG-3’),由上海生工公司合成。
1.2 重组质粒pET-32a(+)-GDF-15的构建
提取人结肠癌细胞 HT29的总 RNA,反转录成cDNA,设计GDF-15特征性引物,体外扩增,PCR产物经琼脂糖凝胶电泳,回收克隆片段,经BamHⅠ和XhoⅠ双酶切后连接到经同样双酶切的pET-32a(+)载体上,将连接产物用CaCl2法转入大肠杆菌DH5α感受态细胞中,接种到含氨苄西林的LB琼脂糖培养板中,37℃孵箱中培养12 h,筛选出阳性克隆,提取质粒进行双酶切鉴定和测序鉴定,将构建的质粒命名为pET32a(+)-GDF-15.
1.3 重组GDF-15的诱导表达和纯化
将测序正确的质粒转化大肠杆菌BL21菌株,筛选单克隆,将含pET-32a(+)-GDF-15质粒的大肠杆菌BL21接种于含氨苄西林的LB培养基中,37℃振荡培养,加入终浓度为1 mmol/L的IPTG诱导,培养6 h后收集菌体,加入5倍SDS-PAGE上样缓冲液,混匀煮沸 10 min,12 000 r/min 离心 5 min,SDS-PAGE鉴定GDF-15的表达。
经SDS-PAGE鉴定筛选出GDF-15高表达的菌落,诱导表达,离心收集菌体,将菌体重悬于细菌裂解缓冲液中,冰上超声波裂解(功率300 W,超声5s,间歇10 s),离心20 min,弃上清,用8 mol/L尿素溶解包涵体。离心后取上清进行Ni亲和层析纯化,以10倍柱体积的洗涤缓冲液洗涤3次,洗脱缓冲液洗脱重组蛋白并收集,SDS-PAGE 检测纯化后的GDF-15蛋白。
1.4 GDF-15蛋白的复性与鉴定
对变性的蛋白进行复性,分别用8、6、4、2 mol/L尿素和不含尿素的PBS溶液对GDF-15蛋白进行透析,每次6 h;对复性后的蛋白经SDS-PAGE鉴定相对分子质量;SDS-PAGE 后,用 300 mA 电流转膜 1h,室温封闭 2 h,用 1∶3000 稀释的 GDF-15一抗于4℃孵育过夜,用 1∶5000 稀释的二抗于室温孵育 1h,Western印迹鉴定是否为GDF-15蛋白。
1.5 GDF-15多克隆抗体的制备
将纯化的蛋白用PBS稀释并与等量完全弗氏佐剂混合,充分乳化后,经皮下多点注射免疫6~8周龄雄性BALB/c小鼠(80 μg/每只);2周后,将蛋白与等量不完全弗氏佐剂混合,充分乳化后加强免疫;每2周加强免疫一次,末次免疫14 d后取血,分离血清,分装后-20℃保存备用。
1.6 GDF-15多克隆抗体效价检测
采用间接 ELISA 检测抗体滴度。用 100 ng/200 μL GDF-15包被酶标板,4℃过夜后弃掉液体,加入 5 mg/L BSA 封闭缓冲液(0.1 mol/L NaHCO3,pH8.6)于37℃封闭2 h;倾去液体,用TBST(1 mL/LTween-20,TBS)洗 5次,每次 2 min;每孔加入 HRP标记的小鼠二抗抗体(1∶5000)100 μL,37℃孵育 1h;用 TBST 洗 3 次,加入 OPD 显色液,37℃显色 15min;加入 2 mol/L 硫酸终止反应,用酶标仪测定D490nm值,P/N大于2.1为阳性,设立阴性对照为无关蛋白包板。
1.7 GDF-15多克隆抗体特异性鉴定
取人结肠癌细胞sw480、caco-2,加入强效裂解液,冰上裂解 1 h,4℃、12 000 r/min 离心 20 min,BCA法定量蛋白浓度,加入5倍上样缓冲液煮沸10min,经常规 SDS-PAGE 后湿转至 PVDF 膜上,用5% BSA室温封闭 1 h,加入 1∶500稀释的抗血清,4℃孵育过夜,洗涤后用 1∶5000稀释的辣根酶标记的抗鼠二抗室温孵育1 h,洗涤后ECL显色,压片,保存结果。
2 结果
2.1 GDF-15 cDNA片段的扩增及重组质粒的制备
用特异的上下游引物从结肠癌细胞 HT29 的cDNA中扩增出GDF-15基因,PCR产物的琼脂糖凝胶电泳结果见图1,扩增片段约350 bp.将目的基因插入pET-32a(+)载体,构建重组质粒,用限制性内切酶BamHⅠ和XhoⅠ双酶切pET-32a(+)-GDF-15,也在约 350 bp 处可见 GDF-15 特异性条带(图2),与预期结果一致。将获得的pET-32a(+)-GDF-15质粒测序,结果正确,说明重组质粒构建成功。
2.2 GDF-15蛋白的诱导表达及纯化
将转化pET-32a(+)-GDF-15质粒的大肠杆菌BL21培养后用 1 mmol/L IPTG 诱导 6 h,用全菌进行 SDS-PAGE,结果见图 3,经 IPTG 诱导后在 Mr约28×103处出现明显的表达产物条带。超声波裂菌后,上清液经Ni亲和层析柱纯化,250 mmol/L咪唑洗脱获得目的蛋白峰(图 4),PBS 透析后行 SDS-PAGE,显示蛋白条带位置正确、纯度较好(图5)。
2.3 GDF-15蛋白的鉴定
将纯化的蛋白行Western印迹检测,结果显示原核表达的 GDF-15 融合蛋白能够被特异性抗体识别,抗原性良好(图6)。
2.4 GDF-15多克隆抗体的制备和效价检测
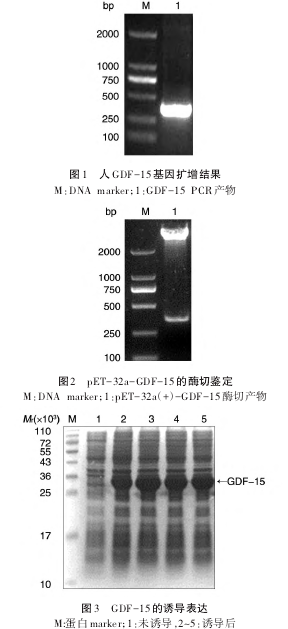
将纯化的 GDF-15蛋白混合弗氏佐剂,皮下多点注射免疫BALB/c小鼠,进行1次基础免疫和3次加强免疫,末次免疫后14 d取血,分离血清,ELISA检测抗血清效价达1∶100 000(图7)。
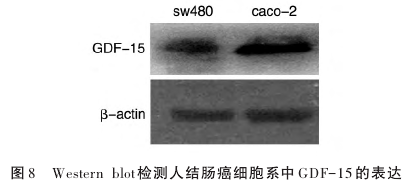
2.5 GDF-15 多克隆抗体检测肿瘤细胞内源性GDF-15的表达
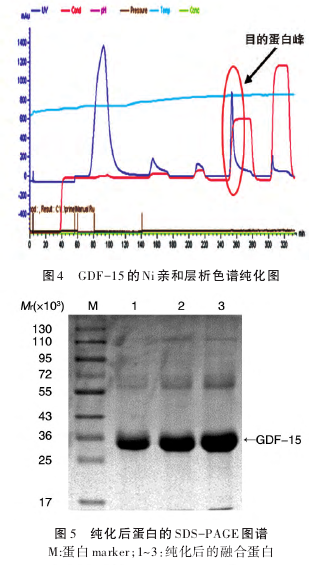
以人结肠癌细胞系sw480、caco-2为检测对象,采用本实验制备的GDF-15抗体进行检测。结果显示,抗体能够检测到胞内GDF-15,产生特异性条带(图8),说明GDF-15抗体制备成功,可应用于后续研究工作中。
3 讨论
GDF-15在调控细胞应激反应、炎症反应及成体急性损伤修复过程中发挥着重要作用[11],而在肿瘤发生和发展中的功能研究尤为人们关注。针对前列腺癌、乳腺癌和结肠癌的研究显示,GDF-15在血清中的含量与肿瘤组织恶性程度、细胞的增殖和转移能力都存在明显的相关性。还有文献报道,GDF-15能够介导肿瘤诱发的消瘦和厌食症。不仅说明循环系统中的GDF-15水平可以作为肿瘤诊断和预后的标志,而且这些表达于肿瘤细胞内的GDF-15也是肿瘤治疗的潜在靶点。
为了用抗体封闭GDF-15,以研究其在肿瘤中的功能及其靶向药物的应用前景,我们首先要获得大量的抗原蛋白。目前市售的GDF-15多为CHO细胞表达,成本高,生产周期长。因此,我们将人GDF-15序列克隆至原核表达载体pET-32a(+)中,构建了重组表达质粒,并建立了经济、高效的GDF-15原核表达系统。在此基础上,我们用传统方法制备了高滴度的GDF-15多克隆抗体,通过Western印迹检测了结肠癌细胞 sw480、caco-2中 GDF-15的表达,表明我们制备的抗体能有效识别人源GDF-15分子。以上结果为我们后续研究GDF-15靶向治疗及其生物学功能和信号传导通路奠定了基础。
参考文献
[1] Constam D B, Robertson E J. Regulation of bone morphogenetic protein activity by pro domains and proprotein convertases[J]. J Cell Biol, 1999,144(1):139-149.
[2] Unsicker K, Spittau B, Krieglstein K. The multiple facets ofthe TGF- β family cytokine growth/differentiation factor- 15/macrophage inhibitory cytokine- 1[J]. Cytokine Growth FactorRev, 2013,24(4):373-384.
[3] Schlittenhardt D, Schober A, Strelau J, et al. Involvement ofgrowth differentiation factor-15/macrophage inhibitory cytokine-1(GDF-15/MIC-1) in oxLDL-induced apoptosis of human macrophages in vitro and in arteriosclerotic lesions[J]. Cell TissueRes, 2004,318(2):325-333.
[4] Zhou Z, Li W, Song Y, et al. Growth differentiation factor-15suppresses maturation and function of dendritic cells and in hibits tumor-specific immune response[J]. PLoS One, 2013,8(11):e78618.
[5] Roth P, Junker M, Tritschler I, et al. GDF-15 Contributes toproliferation and immune escape of malignant gliomas[J]. ClinCancer Res, 2010,16(15):3851-3859.
[6] Strelau J, Schmeer C, Peterziel H, et al. Expression and puta?tive functions of GDF-15, a member of the TGF-beta super family, in human glioma and glioblastoma cell lines[J]. Can cer Lett, 2008,270(1):30-39.
[7] Staff A C, Trovik J, Zahl E A G, et al. Elevated plasmagrowth differentiation factor-15 correlates with lymph node me tastases and poor survival in endometrial cancer[J]. Clin Can-cer Res, 2011,17(14):4825-4833.





