摘 要: 纳米抗体(Nanobody,Nb)是一种新型基因工程抗体,因其分子量小、稳定性强、亲和力高、能识别隐蔽表位、组织穿透力强、易于制备、成本低廉且便于进行改造与修饰,是疾病诊断、治疗和研究的理想分子。因此,纳米抗体受到了的各国学者的广泛关注,在癌症、脑部神经性疾病、毒素中毒性疾病、艾滋病以及其它感染性疾病和蛋白质功能、晶体结构解析等领域已有大量的相关研究报道。本文主要就Nb在动物疫病防控中的研究与应用进行了总结,探讨了其在动物疫病诊断、治疗和研究方面的发展潜力,并对未来发展方向做出了展望。
关键词 : 纳米抗体;动物疫病;诊断;治疗;
Abstract: Nanobodies (Nbs) are novel kind of gene-engineered antibodies. Because of the small size, high stability, high affinity, hidden epitopes recognition ability, strong tissue penetration, easy to preparation, low cost, convenient for modification, Nb are ideal candidate molecules for disease diagnosis, treatment and research. Recently, Nb has attracted the attention of scholars from all over the world. And a large number of Nb related studies have been reported in the fields of cancer, neurological diseases of the brain, toxin diseases, AIDS and other infectious diseases, and protein function and crystal structure analysis. In this review, the research and application of Nbs in animal disease prevention and control were summarized. And Nb’s potential and prospect in animal disease diagnosis, treatment and research were also discussed.
Keyword: Nanobody; Animal epidemic disease; Diagnosis; Treatment;
动物疫病是影响养殖业健康发展,威胁人类健康与社会公共卫生安全的主要因素之一。近年来,包括我国在内的部分国家发生H1N1猪流感、H5N1高致病性禽流感和非洲猪瘟等,不仅给养殖业造成了巨大的经济损失,而且对人们生活造成了影响[1,2,3,4,5,6]。抗体作为一种理想的诊断和治疗试剂,在传染病防控中具有重要作用。抗体的发展经历了多克隆抗体、单克隆抗体,到目前的基因工程抗体三个阶段。单克隆抗体克服了多克隆抗体特异性低,均一性差的缺点;基因工程抗体是在单克隆抗体基础上,利用基因工程手段对抗体进行改造和修饰,通过构建嵌合抗体、小分子抗体、人源化抗体、多特异性抗体等,以改善抗体效力和功能[7,8]。纳米抗体作为一种新型基因工程抗体,衍生于Harmers等在骆驼科和鲨鱼科体内发现的重链抗体(Heavy chain antibody,HCAb)[9]。相对常规抗体而言,HCAb仅有两条重链组成,天然缺失轻链,且重链缺乏CH1区(图1A和1C)。克隆HCAb可变区(Variable domain of HCAb,VHH),由于其大小为纳米级,因此又被称为纳米抗体(Nanobody,Nb)(图1D)[9]。相比于传统的抗体而言,Nb具有许多无可比拟的优势[10,11]。如:(1)分子量小,约15 ku,仅为常规IgG抗体1/10;(2)稳定性强,水溶性高,不易聚集,且能在细胞内发挥作用;(3)亲和力高,Nb与抗原结合的亲和力可达nM,甚至pM级;(4)能耐受极端理化环境,如在90℃高温或胃蛋白酶存在下仍具有活性;(5)可识别半抗原、隐蔽表位,甚至酶的凹槽部等常规抗体不能识别的位点;(6)易于制备,可在多种原核细胞、真核中表达,表达量高,成本低廉;(7)组织穿透性强,能穿过实体瘤和血脑屏障;(8)比常规的抗体更易于进行工程化改造(图1B和1D)。因此,在疾病诊断、治疗和研究领域受到广泛关注[12,13]。2018年9月,用于治疗成人获得性血栓性血小板减少性紫癜(aTTP)的Nb药物Cablivi(Caplacizumab)获欧盟批准上市,成为全球首个Nb药物[14]。本文主要就Nb在动物疫病研究以及防控方面的应用进行总结,并对其应用前景进行了展望。

图1 抗体及抗体衍生物结构图
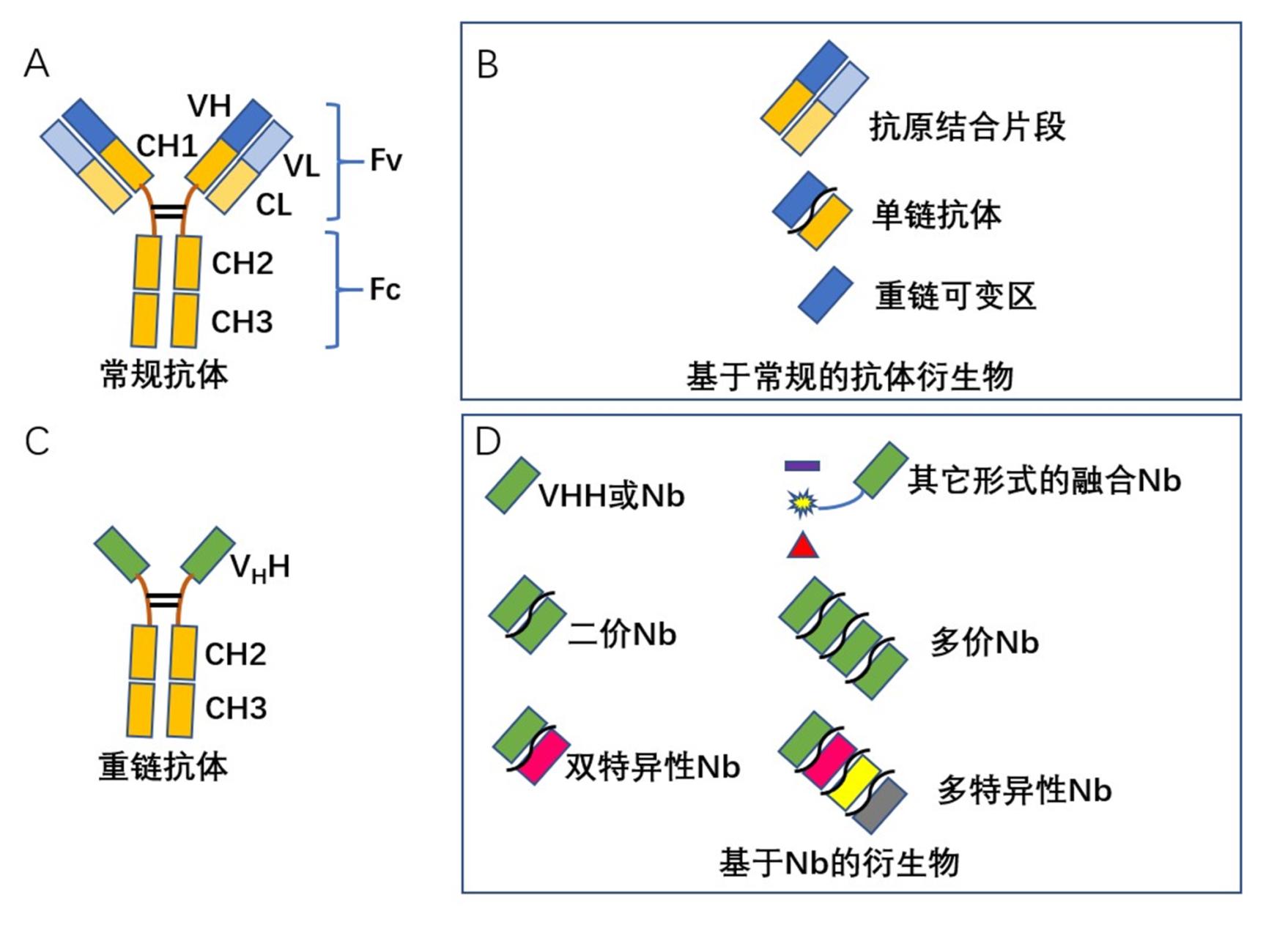
Figure 1 Structure of antibody and antibody derivatives
A: 常规抗体结构图. B: 常规抗体衍生物结构图. C: 重链抗体结构图. D: 纳米抗体及其衍生物结构图A: Structure of conventional antibody. B: Structure of conventional antibody derivatives. C: Structure of HCAb. D: Structure of HCAb derivatives
1、 诊断方面
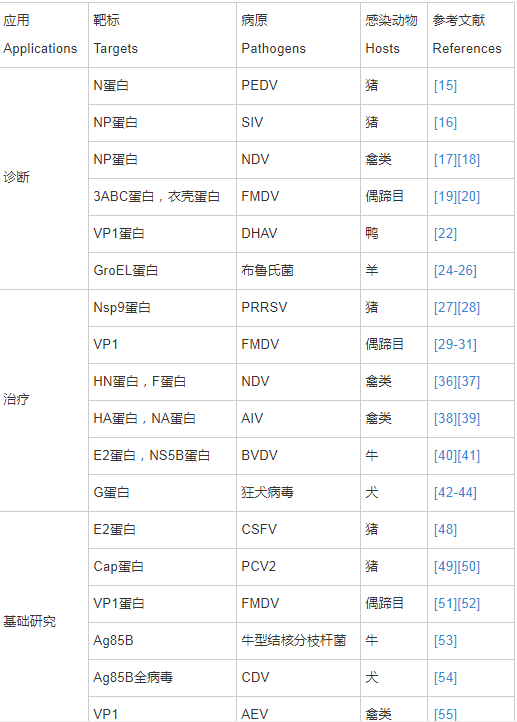
随着畜禽养殖规模的不断扩大,集约化养殖程度越来越高,以及畜禽跨区域调运频繁,动物疫病越来越复杂,新发病多、老病新发和混合感染成为常态,疫病已成为威胁养殖业健康发展的最主要因素。开发快速、廉价、特异性强、灵敏度高、稳定性强、易于保存和现场操作,且能区分野毒感染和疫苗免疫的兽用抗原抗体诊断试剂对迅速控制疫情至关重要。Nb在动物疫病诊断中优势明显,目前主要集中在以下几个方面(表1)。
表1 纳米抗体在动物疫病中的应用
1.1、 猪流行性腹泻
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种急性肠道致病性传染病,主要以水样腹泻、呕吐和脱水为特征,对新生仔猪危害巨大。然而,当前防控手段和技术无法有效应对 PED 带来的威胁,开发高效、廉价、灵敏的诊断制剂对PEDV防治具有重要作用。Ma等[15]利用噬菌体展示技术,从免疫文库中筛选出PEDV N蛋白特异性Nb,并对Nb进行了生物素化标记,建立了基于生物素化Nb的PEDV抗体阻断ELISA检查方法,检测效果与商品化检测试剂盒相当。
1.2、 猪流感
猪流感病毒(Swine influenza virus,SIV)是猪流感的主要病原,主要包括3种A型流感病毒(H1N1、H1N2、H3N2)。猪感染后主要症状为发热、咳嗽、食欲废绝和呼吸困难,虽然病死率不高,但对猪生产性能影响巨大,同时SIV可跨种属感染人,公共卫生学意义重大。血凝抑制试验是检测SIV的标准方法,但结果判定中主观性较大;基于单克隆抗体的ELISA检测方法成本较高,且操作过程较复杂,不适于大规模筛查。Du等[16]以H1N1病毒较保守的NP蛋白为抗原免疫双峰驼,通过噬菌体展示技术获得6株NP蛋白Nb。将其中反应性最强的纳米抗体sdAb5生物素化后,建立了基于生物素化Nb的H1N1病毒抗体阻断ELISA检测方法,且该方法的检测灵敏性优于商品化试剂盒。
1.3、新城疫
新城疫(Newcastle disease, ND)是由新城疫病毒(Newcastle disease virus, NDV)引起的一种严重危害鸡和多种禽类的急性高度接触性传染病,至今仍流行于世界各地,给各国养禽业造成巨大经济损失,同时也严重威胁着野生鸟类的健康。Sheng等[17]从噬菌体展示文库中筛选了NDV NP蛋白的Nb,构建了辣根过氧化物酶融合纳米抗体Nb5-HRP,在此Nb5-HRP基础上,建立了检测NDV抗体的超灵敏竞争性ELISA。Ji等[18]将筛选的抗NDV纳米抗体通过基因工程手段融合至铁蛋白表面,构建了5株亲和力高、半衰期长的Fenobody,将HRP融合至Nb上构建酶标纳米抗体RANbody,建立了基于NDV-Fenobody-4和NDV-RANbody-49的NDV病毒夹心ELISA检测方法。
1.4 、口蹄疫
口蹄疫(Foot and mouth disease,FMD)传播性强、病毒变异快,防控难,疫苗免疫仍是预防口蹄疫的重要手段。在FMD流行地区,如何有效区分野毒感染和疫苗株免疫是防控FMD的关键。虽已有商品化试剂盒,但灵敏性和特异性参差不齐,且价格较高,不适于发展中国家。Gelkop等[19]以原核表达的O型病毒3ABC蛋白和基于7种不同血清型毒株3ABC保守表位合成的短肽为免疫原免疫双峰驼,筛选出6株3ABC蛋白特异性纳Nb,挑选其中反应活性最强的Nb94,建立了检测血清中抗3ABC抗体的竞争性ELISA方法,与现有商品化FMD非结构蛋白检测试剂盒在特异性和灵敏性上无差异,并可检测多种不同型的FMDV抗体。Dash等[20]筛选了O型、A型和Asia 1型FMDV的Nb,并建立了用Nb做捕获抗体的FMDV抗原液相阻断ELISA检测方法。
1.5、 鸭病毒性肝炎
鸭病毒性肝炎(Duck virus hepatitis,DVH)是一种急性致死性传染病,主要危害3周龄以内雏鸭,以肝脏出血和坏死为主要特征,是危害养鸭业最主要的疫病之一。该病的主要病原鸭甲肝病毒(Duck hepatitis A virus,DHAV)属于小RNA病毒科禽肝炎病毒属,其基因组为单股正链RNA,只有一个开放阅读框,编码一个大多聚前体蛋白,随后可裂解为3种成熟的结构蛋白和9种非结构蛋白,其中VP1结构蛋白是主要抗原蛋白,与病毒致病性和毒力密切相关[21]。鸭甲肝病毒包括三个血清型,分别为1型鸭甲肝病毒(DHAV type 1,DHAV-1)、2型鸭甲肝病毒(DHAV-2)和3型鸭甲肝病毒(DHAV-3),DHAV-1流行最广、毒力最强。Xue等[22]用DHAV-1活疫苗免疫双峰驼,以表达纯化的DHAV-1 VP1蛋白为抗原,从构建的Nb噬菌体展示文库中筛选出1株VP1蛋白VHH抗体,该株VHH只与DHAV-1反应,不与DHAV-2和DHAV-3反应;经鉴定,其识别靶点为VP1蛋白上一个保守的B细胞表位,是建立区分不同型鸭甲肝病毒血清学方法的候选分子。
1.6 、布鲁氏菌病
布鲁氏菌是革兰氏阴性细胞内寄生菌,能引发布鲁氏菌病。主要损害人、畜的生殖系统和关节,对畜牧业和人类健康有较大危害。由于该菌为胞内寄生菌,致病机制复杂,传播途径多,且可形成气溶胶,易造成广泛感染。目前,学者已经建立了几种不依赖细菌培养的快速诊断方法,其中最常用的一种方法是基于靶向布鲁氏菌脂多糖的抗体免疫诊断法,但布鲁氏菌脂多糖与耶尔森菌等部分细菌脂多糖具有相同表位,导致该诊断法特异性和准确性较差[23]。Abbady等[24]用羊种布鲁氏菌灭活疫苗免疫单峰驼,采集免疫后的单峰驼血液,构建Nb噬菌体展示文库,从中筛选出3株羊布鲁氏菌的Nb。其中1株Nb能特异性识别羊布鲁氏菌和牛布鲁氏杆菌抗原,与包括小肠结肠耶尔森菌在内的多种细菌无交叉反应性,为提高现有诊断试剂盒的特异性和准确性奠定基础。随后,该团队用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)方法对NbBruc02株纳米抗体所识别的靶标进行了鉴定,发现GroEL伴侣蛋白是NbBruc02株纳米抗体的靶点[25,26]。
2 、治疗方面
动物养殖过程中,考虑到成本问题,疫病防疫往往以疫苗免疫和生物安全措施为主,但部分动物疫病由于血清型众多、病原变异性强、致病和传播机制复杂,以及疫苗效果欠佳,研发高效、廉价、广谱的治疗试剂意义重大。Nb是一种理想的被动免疫制剂,学者们研发和制备了多种形式的Nb用于人类疾病的治疗。然而Nb在动物疫病方面的研究相对较为滞后,主要集中在表1所示的几个方面。
2.1 、猪繁殖与呼吸综合征
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖和呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种病毒性传染病,对世界养猪业造成巨大经济损失。由于该病毒抗原变异性强,且存在抗体依赖性增强作用,现有疫苗不能完全阻止该病的发生。Liu等[27]以PRRSV相对保守的Nsp-9蛋白作为靶标,通过噬菌体展示技术,筛选出8株抗PRRSV Nsp-9蛋白的Nb,选择其中反应活性最强的Nb6株为代表,构建了稳定表达Nb6的MARC-145细胞系,发现该稳转细胞系可抑制PRRSV病毒基因组复制和转录,并且在病毒感染细胞中时不出现病变。随后,Wang等将反式激活转导肽(trans-activating transduction peptide, TAT)的序列融合至Nb6上,构建了可穿透细胞膜的TAT-Nb6纳米抗体,并证明TAT-Nb6进入MARC-145和PAMs细胞呈剂量和时间依赖性,该穿膜Nb可抑制多种基因2型和1种基因1型的PRRSV感染靶细胞[28]。
2.2 、口蹄疫
在无FMD欧洲地区,由于采取非免疫措施,发生FMD后,往往采取紧急接种方式来控制该病,但是免疫后至少需要4 d,猪只才能产生保护性抗体抵抗FMDV感染。如何在疫苗的空窗期保护动物免受FMDV感染是急需解决的问题。Harmsen等[29]筛选了24株O型FMDV Nb,其中6株中和活性最强的Nb通过识别VP1蛋白GH-loop区来阻止病毒与细胞受体结合,进而发挥中和作用。将M8株和M23株Nb进行聚乙二醇化修饰后,给豚鼠单独肌肉注射上述两种Nb不能保护其抵抗FMDV攻击,混合注射上述两种Nb可提供部分保护力,推测完全保护与免疫调理有关。随后,该团队筛选了抗猪免疫球蛋白VHH抗体VI-4,并将VI-4 VHH抗体分别融合至先前筛选的M3,M8和M23株VHH抗体构建3株双特异性抗体(VHH2s),此3株双特异性VHH抗体半衰期比单价VHH抗体延长了100倍。攻毒后24 h,给猪肌肉注射双特异性VHH抗体(M23ggsVI-4株)可显着降低病毒血症以及排毒,但未能阻止FMDV传播以及出现临床症状[30]。为此,Harmsen等[31]又将2个靶向FMDV的VHH和一个靶向猪免疫球蛋白的VHH抗体融合,构建了3价VHH抗体(VHH3s)。发现攻毒前24 h,给猪混合注射2株VHH3s能显着减低病毒血症、排毒量、延迟临床症状出现、延缓FMD传播。
2.3 、新城疫
严格的疫苗免疫使ND的流行得到了有效控制,然而免疫鸡群发生ND及非典型ND的情况仍然存在,表明现有疫苗并不能完全阻止ND的传播[32,33,34,35]。Gao等[36]以截短的HN蛋白为诱饵,从构建的Nb酵母双杂交文库中筛选出7株NDV HN蛋白的Nb,挑选其中ELISA反应活性较强的VHH6为代表,进行了免疫细胞化学和中和试验。结果表明,VHH6具有部分中和活性,且能识别NDV感染的DF-1细胞。高小龙等[37]以NDV F蛋白中和表位为诱饵,从酵母双杂交文库中筛选了2株可与NDV病毒粒子和F蛋白反应的Nb,并具有一定的中和活性。
2.4 、禽流感
禽流感病毒(Avian influenza virus, AIV)属于正黏病毒科中的甲型流感病毒属,主要危害家禽及野鸟。H5N1高致病性禽流感不仅对家禽养殖业造成了巨大的经济损失,而且可跨种属传播,对人类健康构成严重威胁。由于流感病毒基因组为分节段的单股负链RNA,易发生重组,导致流感病毒变异性强,防控难度大。Ibanez等[38]筛选了H5N1 AIV病毒HA蛋白的Nb,并评价了单价Nb和构建的二价Nb抗病毒活性,发现鼻内给药可有效抑制肺内H5N1病毒复制,同时保护小鼠免受致死性攻毒,且二价Nb抑制病毒复制能力比单价Nb高60倍以上。Cardoso等[39]的研究结果表明,靶向NA蛋白的Nb二聚化后抑制H5N1病毒增殖的能力可提高30~240倍,且给药一次即可保护小鼠抵抗致死性H5N1攻毒。如何筛选和制备具有广谱中和作用的Nb将是后期努力的重要方向。
2.5 、牛病毒性腹泻
牛病毒性腹泻(Bovine viral diarrhea disease,BVD)是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的一种传染病。病牛以粘膜发炎、糜烂、坏死和腹泻为特征,对养牛业威胁巨大。目前,BVDV感染率呈上升趋势,且有流行的风险,由于该病毒致病机制复杂,且存在持续感染,尚无有效防治方法。Li等[40]用BVDV全病毒免疫双峰驼,构建Nb噬菌体展示文库,筛选了5株可以和BVDV E2蛋白特异性结合的Nb。选择与BVDV E2蛋白反应性最强的VHH15进行病毒中和实验后,发现其可在MDBK细胞上抑制BVDV增殖。Duan等[41]筛选了8株BVDV NS5B蛋白的Nb,利用慢病毒系统构建了稳定表达Nb1的MDBK细胞系,该稳转细胞系可显着抑制BVDV病毒复制。
2.6 、狂犬病
狂犬病毒属于弹状病毒科狂犬病毒属,基因组为单股、负链不分节段RNA,是一种人畜共患烈性传染病,多见于犬、狼、猫等肉食动物,人多因被病兽咬伤而感染。临床表现为特有的恐水、怕风、咽肌痉挛、进行性瘫痪等,又名恐水症。人被患犬咬伤后,第一时间注射疫苗和抗血清可有效预防发病,但注射抗血清价格较高,致使部分被咬者望而却步。Boruah等[42]从非免疫天然Nb噬菌体展示文库中,筛选到狂犬病毒G蛋白的Nb。将Nb融合至人软骨基质低聚蛋白上(COM48)上,构建了五聚化Nb,发现相比单体Nb而言,五聚化Nb在体外中和狂犬病毒活性提高85倍,且中和效力可达商品化人源狂犬病毒抗血清的90%~95%。Terryn等[43]构建了抗狂犬病毒G蛋白Nb二聚化纳米抗体(Rab-C12)和双特异性纳米抗体Rab-E8/H7,发现二聚化和双特异性纳米抗体中和活性显着高于单价纳米抗体,可达皮摩尔级,且Rab-E8/H7抗体抗病毒活性最强。为延长半衰期,将抗白蛋白纳米抗体偶联Rab-E8/H7后,进一步改善了治疗效果,腹腔注射1.5 mg可将攻毒小鼠半数生存期从9天延长至15天。狂犬病毒感染小鼠后24 h,相比单独注射Rab-E8/H7纳米抗体而言,采用Rab-E8/H7纳米抗体结合疫苗免疫的方法,可将小鼠半数生存期从14天延长至35天,存活率从19%提高至60%[44]。为开发高效、廉价的治疗试剂奠定基础。
3 、研究方面
作为一种研究蛋白质互作与功能、表位鉴定、示踪和显影的有力工具,抗体在过去几十年得到广泛应用。学者们筛选和制备多种靶抗原的抗体,包括Nb。这些抗体在疾病研究和细胞功能揭示上发挥了巨大作用[45,46]。纳米抗体在动物疫病研究上主要集中在以下方面。
3.1、 猪瘟
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种以严重出血和高热为特征的高度接触性传染病,可导致猪群大规模发病和死亡,给全球养猪业造成了巨大经济损失,严重威胁猪相关产品贸易,是危害养猪业最主要的传染病之一。虽然已有部分国家消灭了该病,但由于野猪带毒,增加了CSF消灭和维持种群净化状态的难度[47]。因此,CSF的防控任重而道远,但该病原研究上工具较少,主要为单克隆抗体,且为各实验室自己制备,缺乏统一的标准化抗体。Yang等[48]用截短的CSFV E2蛋白免疫双峰驼,构建Nb噬菌体展示文库,筛选出2株靶向E2蛋白的Nb,用量子点和AF488分别对2株Nb进行标记后,可在ST细胞中示踪CSFV。同时,用磁珠标记该Nb构建纳米免疫磁珠,用此纳米免疫磁珠可很好地捕获和富集CSFV病毒粒子和E2蛋白。为CSFV研究提供了新工具。
3.2 、猪圆环病毒病
猪圆环病毒2型(Porcine circovirus type 2, PCV2)是引发断乳仔猪多系统衰弱综合征的主要病原。PCV2感染猪只后,可损伤机体免疫系统,造成免疫抑制,进而诱发多种细菌和病毒的混合感染,是猪传染病难防难治的重要原因。Fu等[49]利用PCV2免疫后的骆驼血液,构建了Nb酵母双杂交文库,通过酵母双杂交技术筛选出7株反应活性较强的PCV2 Cap蛋白的Nb,选择ELISA反应活性最强的VHH3抗体对PCV2感染FPRC细胞进行免疫细胞化学染色。Yang等[50]用噬菌体展示技术,筛选出3株PCV2 Cap蛋白高亲和力Nb,且3株Nb能够识别Cap蛋白的不同表位。其中两株Nb与PCV1、CSF和PRRSV无交叉反应,特异性高。随后该团队又构建了碱性磷酸酶融合Nb,并建立了基于碱性磷酸酶融合Nb的检测PCV2的免疫细胞化学方法。
3.3 、口蹄疫
Yin等[51]用Asia 1型FMDV病毒样颗粒(Virus like particle,VLP)免疫双峰驼后,通过噬菌体展示技术获得5株抗FMDV的Nb,其中3株可在大肠杆菌中可溶性表达,并且能和Asia 1 FMDV VP1蛋白特异性反应。选取sdAb-C6株Nb进行量子点标记后,可在BHK-21细胞中对FMDV进行示踪。Wang等[52]采用O型FMDV灭活疫苗免疫双峰驼后,采取与Yin相同的策略,以O型FMDV VLP为抗原对构建的噬菌体展示文库进行筛选后,获得2株可与O型FMDV特异性反应的Nb,用量子点对2株Nb进行标记后,同样可在BHK-21细胞中对FMDV进行示踪。
3.4 、牛结核病
牛结核病是由牛型结核分枝杆菌引起的一种人兽共患传染病,我国将其列为二类动物疫病。由于结核病病原可感染50多种哺乳动物,以及奶牛场养殖水平参差不齐,检疫淘汰措施无法有效落实等,致使该病长期存在。杨艳丽等[53]采用结核分枝杆菌Ag85B蛋白免疫双峰驼,构建了纳米抗体T7噬菌体展示文库,通过三轮淘选得到2株VHH抗体,用Western blot证明VHH抗体可与Ag85B蛋白反应,但ELISA结果发现抗体亲和力欠佳。
3.5 、犬瘟热
犬瘟热(Canine distemper,CD)是一种以发热、呕吐、腹泻、咳嗽及神经症状为主的犬类传染病。该病传染性强,死亡率高,病原为犬瘟热病毒(Canine distemper virus,CDV)。随着人们生活水平的不断提高和改善,饲养宠物的人也越来越多,虽有商品化疫苗用于CDV预防,但宠物犬发生犬瘟热疫情仍然不容乐观,急需开发廉价的治疗性制剂用于犬瘟热的治疗。王召阳等[54]用CDV病毒免疫羊驼,以采集的羊驼血液为起始材料,构建VHH噬菌体展示文库,经过三次淘选得到两株的VHH,通过毕氏酵母表达后,间接ELISA结果证明这两株VHH抗体与CDV反应性良好,但未进行病毒中和试验。
3.6、 禽脑脊髓炎
禽脑脊髓炎(Avian encephalomyelitis,AE)是一种以侵害幼禽的中枢神经系统为主的传染病,由小RNA病毒科、震颤病毒属中的禽脑脊髓炎病毒(Avian encephalomyelitis virus, AEV)引起。雏鸡、火鸡、鹌鹑等禽类感染后出现共济失调、麻痹和头颈震颤等神经症状。产蛋鸡感染后虽无明显症状,但可引起生产性能下降。范文涛等[55]以AEV病毒主要结构蛋白VP1为诱饵,从非免疫双峰驼Nb酵母双杂交文库中筛选出了8株Nb,用间接ELISA反应对Nb与AEV病毒反应活性进行了鉴定,获得2株反应性较好的Nb。
4 、总结与展望
尽管常规单克隆抗体仍然是目前生物研究、疾病诊断与治疗领域的最主要分子,但其制备成本高、稳定性差、分子量大,以及组织通透性差的缺点限制了单克隆抗体在部分领域的应用。Nb作为一种新型抗体片段,克服了常规抗体的上述缺陷,在癌症、脑部疾病、自身免疫型性疾病、呼吸道疾病、HIV等感染性疾病、毒素中毒性疾病的诊断与治疗以及基础研究领域备受关注[45,46,56,57]。在动物疫病上,各国学者以全病原、病毒结构蛋白、非结构蛋白和病毒相关复制酶等为靶标,通过噬菌体展示技术、酵母杂交和细菌展示技术筛选了多种病原的Nb,推动了动物疫病防控技术的发展。诊断方面,基于常规抗体的动物疫病的诊断试剂热稳定性差,往往需要冷链运输,增加了检测成本。同时部分试剂盒特异性和灵敏性差,无法对某些病原进行鉴别诊断和早期诊断[26,50,58]。Nb优异的热稳定性和高亲和力使开发成本低廉、特异、灵敏的试剂盒成为可能。治疗方面,FMDV和AIV等病原血清型多、抗原变异性强,主动免疫后动物仍有发病风险。对于利用相同细胞受体感染动物的同种病毒而言,其核衣壳蛋白或囊膜蛋白上存在一些决定蛋白功能的保守性隐蔽表位,这些表位通常位于蛋白构象的凹陷和裂隙处,被其它优势表位遮挡,常规抗体由于分子量大,无法识别和结合关键性隐蔽表位。Nb由于分子量小、具有较长的CDR3区,可很好识别一些隐蔽表位,是开发广谱中和治疗制剂的理想分子[59,60]。同时,Nb能耐受胃蛋白酶、糜蛋白酶和极端理化条件,使其可以通过雾化吸入或口服方式大剂量给药,适用于畜禽大规模给药,在治疗呼吸道和消化道疫病上潜力巨大,如呼吸道合胞体病毒、PEDV。作为一种极具优势的胞内抗体形式,Nb在胞内抗病毒病方面已有报道,后续可尝试筛选布鲁氏菌等胞内寄生菌的Nb,通过胞内抗体防控该类疫病。但安全、高效的胞内Nb给药方式是限制胞内Nb应用的主要瓶颈,基于腺病毒等病毒载体的给药方式为胞内Nb大规模应用带来希望。筛选和制备多种动物疫病病原的Nb也将有力推动相关传染病的研究。但Nb在应用中仍有以下问题需要解决:(1)如何获得更高亲和力的Nb;(2)如何提高Nb穿透细胞膜能力;(3)用于疾病治疗时,如何延长Nb半衰期;(4)如何解决主要依靠细胞免疫发挥抗病毒作用的病原感染问题;(5)如何高效筛选具有广谱中和能力的Nb;(6)怎样降低Nb对不同动物的免疫原性。构建多聚化、多价和双特异性的Nb,以及偶联Fc端和穿膜肽(Cell penetrating peptides, CCPs)融合Nb为上述问题解决提供了新思路,相信在不远的将来,Nb定将在动物疫病防控中大放异彩。
参考文献
[1] Barman S, Turner J C M, Hasan M K, et al. Continuing evolution of highly pathogenic H5N1 viruses in Bangladeshi live poultry markets[J]. Emerg Microbes Infect, 2019, 8(1):650-661.
[2] Quan C S, Wang Q L, Zhang J, et al. Avian infuenza A viruses among occupationally exposed populations, China, 2014-2016[J]. Emerg Infect Dis, 2019, 5(12): 2215-2225.
[3] Chauhan R P, Gordon M L. A systematic review analyzing the prevalence and circulation of infuenza viruses in swine population worldwide[J]. Pathogens, 2020, 9(5): 355.
[4] Cai M, Huang J, Bu D, et al. Molecular evolution of H1N1 swine infuenza in Guangdong, China, 2016-2017[J]. Infect Genet Evol, 2018, 60: 103-108.
[5] Schulz K, ConrathsF J, Blome S, et al. African swine fever: fast and furious or slow and steady?[J]. Viruses, 2019, 11(9): 866.
[6] Fekede R J, van Gils H, Huang L, et al. High probability areas for ASF infection in China along the Russian and Korean borders[J]. Transbound Emerg Dis, 2019, 66(2): 852-864.
[7] Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries[J]. Protein Cell, 2018, 9(1): 33-46.
[8] Strohl W R. Current progress in innovative engineered antibodies[J]. Protein Cell, 2018, 9(1):86-120.
[9] Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains[J] Nature, 1993, 363. 446-448.
[10]Muyldermans S. Nanobodies: natural single-domain antibodies[J]. Annu Rev Biochem, 2013, 82(1): 775-797.
[11] Ingram J R, Schmidt F 1, Ploegh H L. Exploiting nanobodies' singular traits[J]. Annu Rev Immunol, 2018, 36: 695-715.
[12] Salvador J P, Vilaplana L, Marco M P. Nanobody outstanding features for diagnostic and therapeutic[J]. Anal Bioanal Chem, 2019, 411(9): 1703-1713.
[13] Beghein E, Gettemans J. Nanobody Technology: A versatile toolkit for microscopic imaging, protein-protein interaction analysis, and protein function exploration[J]. Front Immunol, 2017, 8: 771.
[14] Duggan S. Caplacizumab: First Global Approval[J]. Drugs, 2018, 78(15): 1639-1642.
[15] Ma Z, Wang T, LiZ, et al. A novel biotinylated nanobody-based blocking ELISA for the rapid and sensitive clinical detection of porcine epidemic diarrhea virus[J]. J Nanobiotechnology, 2019,17(1): 96.
[16] Du T, Zhu G, Wu X. et al. Biotinylated single -domain antibody-based blocking ELISA for detection of antibodies against swine influenza virus[J]. Int J Nanomedicine, 2019, 14: 9337-9349.
[17] Sheng Y, WangK, Lu Q, et al. Nanobody-horseradish peroxidase fusion protein as an ultrasensitive probe to detect antibodies against Newcastle disease virus in the immunoassay![J]. J Nanobiotechnology, 2019, 17(1): 35.
[18]JiP, ZhuJ, LiX, et al. Fenobody and RANbody-based sandwich enzyme-linked immunosorbent assay to detect Newcastle disease virus[J]. J Nanobiotechnology, 2020, 18(1): 44.
[19] Gelkop S, Sobarzo A, Brangel P, et al. The development and validation of a novel nanobody based competitive ELISA for the detection of foot and mouth disease 3ABC antibodies in cattle[J]. Front Vet Sci, 2018, 5: 250.
[20] Dash L, Subramaniam S, Khulape S A, et al. Development and utiliation of VHH antibodies derived from camelus dromedarius against foot-and-mouth disease virus[J]. AnimBiotechnol, 2019, 30(1): 57-62.
[21] Zhang R, Zhou G, Xin Y, et al. Identification of a conserved neutralizing linear B-cell epitope in the VP1 proteins of duck hepatitis A virus type 1 and 3[J]. Vet Microbiol, 2015,180: 196-204.
[22] Xue W, Zhao Q, LiP, et al. ldentification and characterization of a novel nanobody against duck hepatitis A virus type 1[0]. Virology, 2019, 528: 101-109.
[23] Pappas G, Akritidis N, Bosilkovski M, et al. Brucellosis[J]. N Engl J Med, 2005, 352: 2325-2336.
[24] Abbady A Q, AI-Mariri A, Zarkawi M, et al. Evaluation of a nanobody phage display library constructed from a Brucella-immunised came[J]. Vet Immunol Immunopathol, 2011,142(1-2): 49-56.
[25] Abo Assali L, AI-Mariri A, Hamad E, et al. Immunodetection of the recombinant GroEL by the nanobody NbBruc02[J]. World J Microbiol Biotechnol, 2012, 28(10): 2987-2995.
[26] Abbady A Q, Al-Daoude A, AI-Mari A, et al. Chaperonin GroEL a brucella immunodominant antigen identified using nanobody and MAL DI-TOF-MS technologies[J]. Vet Immunol Immunopathol, 2012, 146(3-4): 254-263.
[27]Liu H, Wang Y, Duan H, et al. An intracellularly expressed Nsp9-specific nanobody in MARC- 145 cells inhibits porcine reproductive and respiratory syndrome virus replication[J]. Vet Microbiol, 2015, 181(3-4): 252-260.
[28] Wang L, Zhang L, Huang B, et al. A Nanobody targeting viral non-structural protein 9 inhibits porcine reproductive and respiratory syndrome virus replication[J]. J Virol, 2019,93(4): e01888-18.
[29] Harmsen M M, van Solt C B, FitenH P, et al. Passive immunization of guinea pigs with lama single -domain antibody fragments against foot-and-mouth disease[J]. Vet Microbiol, 2007, 120(3-4): 193-206.
[30] Harmsen M M, Fiten H P, DekkerA, et al. Passive immunization of pigs with bispecific lama single- domain antibody fragments against foot-and-mouth disease and porcine immunoglobulin[J]. Vet Microbiol, 2008, 132(1-2): 56-64.
[31] Harmsen M M, Fiten H P, Engel B, et al. Passive immunization with lama single -domain antibody fragments reduces foot- and-mouth disease transmission between pigs[J]. Vaccine, 2009, 27(13): 1904-1911.
[32] ChoS H, Kim S J, Kwon H J. Genomic sequence of an antigenic variant Newcastle disease virus isolated in Korea[J]. Virus Genes, 2007, 35(2): 293-302.
[33] DielD G, SustaL, Garcia S C, et al. Complete genome and clinicopathological characterization of a virulent Newcastle disease virus isolate from South America[J]. J Clin Microbiol, 2012, 50(2): 378-387.
[34] MilerP J, Estevez C, Yu Q, et al. Comparison of viral shedding fllowing vaccination with inactivated and live Newcastle disease vaccines formulated with wild-type and recombinant viruses[J] Avian Dis, 2009, 53(1): 39-49.
[35] HuSL, Ma HL, WuY T, et al. Avaccine candidate of attenuated genotype VII Newcastle disease virus generated by reverse genetics[J]. Vaccine, 2009, 27(6): 904-910.
[36] Gao X, Hu X, Tong L, et al. Construction of a camelid VHH yeast two-hybrid library and the selection of VHH against haemagglutinin-neuraminidase protein of the Newcastledisease virus[J]. BMC Vet Res, 2016, 12: 39.
[37]高小龙,胡湘云,付向晶,等新城疫病毒F蛋白纳米抗体的筛选及活性鉴定[J].畜牧兽医学报, 2016, 47(8): 1645-1651.
[38] Ibafiez L I, De Filette M, Hultberg A, et al. Nanobodies with in vitro neutralizing activity protect mice against H5N1 influenza virus infection[J]. J Infect Dis, 2011, 203(8): 1063-1072.
[39] Cardoso F M, IbafezL I, Van den Hoecke S, et al. Single-domain antibodies targeting neuraminidase protect against an H5N1 influenza virus challenge[J] J Virol, 2014, 88(15): 8278-8296.
[40] Li T, Huang M, Xiao H, et al. Selection and characterization of specific nanobody against bovine virus diarrhea virus (BVDV) E2 protein[J]. PLoS One, 2017, 12(6): e0178469.
[41] DuanH, Ma Z, XuL, et al. A novel intracllulrly expressed NS5B- specific nanobody suppresses bovine viral diarrhea virus replication[J]. Vet Microbiol, 2020, 240:108449.
[42] BoruahB M, LiuD, Ye D, et al. Single domain antibody mutimers confer protection against rabies infection[J]. PLoS One, 2013, 8(8): e71383.
[43] Terryn S, FrancartA, Lamoral S, et al. Protective effect of dfferent anti-Rabies virus VHH constructs against rabies disease in micel[J]. PLoS One, 2014, 9(10): e109367.
[44] Terryn S, Francart A, Rommelaere H, et al. Post-exposure treatment with anti-rabies VHH and vaccine significantly improves protection of mice from lethal rabies infection[J].PLoS Negl Trop Dis, 2016, 10(8): e0004902.
[45] Aguilar G, Matsuda S, Vigano M A, et al. Using Nanobodies to Study Protein Function in Developing Organisms[J]. Antibodies (Basel), 2019. 8(1): 16.
[46] Bastos Soares E A, Sousa R M 0, Gomez AF, et al. Single domain antibodies in the development of immunosensors for diagnostics[J]. Int J Biol Macromol, 2020, 165(Pt B):2244-2252.
[47] Isoda N, Baba K, Ito S, et al. Dynamics of classical swine fever spread in wild boar in 2018-2019, Japan[J]. Pathogens, 2020, 9(2): 119.
[48] Yang S, Yuan L, Shang Y, et al. Selection and characterization of CSFV-specific single -domain antibodies and their application along with immunomagnetic nanobeads and quantum dots[J]. Biomed Res Int, 2020, 2020: 3201630.
[49] FuX, Gao X, He S, et al. Design and selection of a camelid single-chain antibody yeast two-hybrid library produced de novo for the Cap protein of porcine circovirus type 2PCV2)[J]. PLoS One, 2013, 8(3): e56222.
[50] YangS, Shang Y, Yin S, et al. Selection and identification of single-domain antibody fragment against capsid protein of porcine circovirus type 2 (PCV2) from C. bactrianus[J]. Vet Immunol Immunopathol, 2014, 160(1-2): 12-19.
[51] YinS, Yang S, Shang Y, et al. Characterization of asia 1 sdAb from camels bactrianus (C. bactrianus) and conjugation with quantum dots for imaging FMDV in BHK-21 cells[J]. PLoS One, 2013, 8(5): e63500.
[52] Wang D, YangS, Yin S, et al. Characterization of single domain antibodies against foot and mouth disease virus (FMDV) serotype 0 from a camelid and imaging of FMDV inbaby hamster kidney-21 cells with single-domain antibody-quantum dots probes[J]. BMC Vet Res, 2015, 11: 120.
[53]杨艳丽,张齐,张星星,等. 抗牛结核分枝杆菌VHH抗体T7噬菌体库的构建与筛选[J].中国兽医学报, 2019, 39(10): 1987-1993.
[54]王召阳,蒋亚君,刘雪婷,等.抗犬瘟热病毒VHH抗体噬菌体库的构建与筛选[J].中国畜牧兽医,2020, 47(6): 1685-1693.
[55]范文涛,杜恩岐,高小龙,等禽脑脊髓炎病毒VP 1蛋白纳米抗体的筛选及活性检测[J].中国兽医学报,2016, 36(1): 12-17.
[56] Bao G, Tang M, Zhao J, et al. Nanobody: a promising toolkit for molecular imaging and disease therapy[J]. EJNMMI Res, 2021, 11(1): 6.
[57] Jovcevska 1I, Muyldermans S. The Therapeutic Potential of Nanobodies[J]. BioDrugs, 2020, 34(1): 11-26.
[58] Nielsen K, Yu W L, Lin M, et al. Prototype single step lateral flow technology for detection of avian influenza virus and chicken antibody to avian infuenza virus[J]. J Immunoass Immunochem, 2007, 28: 307-318.
[59] Forsman A, Beinaert E, Aasa-Chapman M M, et al. Llama antibody fragments with cross subtype human immunodeficiency virus type 1 (HIN-1)-neutralizing properties and high afinity for HIV-1 gp120[J]- J Virol, 2008, 82(24): 12069-12081.
[60] Tung Yep A, Takeuchi Y, Engelhardt 0 G, et al. Broad reactivity single domain antibodies against influenza virus and their applications to vaccine potency testing and immunotherapy[J]. Biomolecules, 2021, 11(3): 407.





