
布鲁菌病(brucellosis) 是一种全球性分布、危害严重的人兽共患传染病,能侵害多种家畜、野生动物和人类等。B. Melitensis、B. Abortus、B. suis 和Brucella canis 这 4 种布鲁菌对人致病。布鲁菌病在我国近30 个省、自治区和直辖市均有分布,且近年来疫情呈明显上升趋势。我国自 2000 年以来,全国兽医部门检出的布鲁菌病阳性牲畜数量呈逐年上升趋势。2009 年,据阿巴嘎旗等 10 个国家级畜间布鲁菌病疫情监测县数据统计,血清学检查羊41 736 只,阳性 626 只,平均阳性率 1. 49% (阳性率1. 00% ~ 7. 01% ) ; 血清学检查牛 62 843 头,阳性852 头,平均阳性率 1. 36% (阳性率 0 ~ 7. 17% ) 。
这些数据表明,我国布鲁菌病对人和动物造成的危害已经达到非常严重的程度了。
除羊、牛、猪对布鲁菌敏感外,马、骆驼、鹿、犬、猫、鸭、野鸟、水貂、蜱等也可感染或带菌。野生动物如羚羊、野牛、野鹿、牦牛、野猪等对布鲁菌都易感。熊、狼、狐狸、貉、野兔、小家鼠、姬鼠、蝉、海豹、海豚、水貂等亦可感染。这些动物长期带菌传播,成为地区间生物相互传染的因素。四川省是小熊猫的集中分布区,由于受犬瘟热、心丝虫病及人类活动等因素影响,种群数量锐减。成都大熊猫繁育研究基地是全国最大的小熊猫圈养基地,也是全球最大的大熊猫繁育基地。目前,缺乏对小熊猫等野生动物布鲁菌病的监测,增加了野生动物疾病向人类传播的风险。为此,笔者对成都大熊猫繁育研究基地内进入繁殖期的 16 只小熊猫进行布鲁菌病血清学监测,弥补小熊猫布鲁菌病血清学的监测数据,杜绝小熊猫成为布鲁菌病传播的源头。
1、 材料
1. 1 样品
16 只产房小熊猫(编号为 49,56,57,59,61,62,63,64,65,66,67,68,69,70,71,72) 的血液样品,于 2013 年 3月16 日和22 日采自成都大熊猫繁育研究基地四川省林业厅小熊猫保护研究中心的小熊猫饲养馆。
1. 2 主要试剂
布鲁菌病虎红凝集抗原及试管凝集抗原、布鲁菌阴性血清、布鲁菌阳性血清,均购自中国兽医药品监察所; 0. 5% 石炭酸生理盐水,由四川农业大学动物医学院动物疫病与人类健康四川省重点实验室配制。
2、 方法
2. 1 布鲁菌病血清学检测
先采用布鲁菌虎红平板凝集试验(RBPT) 进行初筛,对阳性或疑似阳性样品运用试管凝集试验(SAT) 进一步确诊。
RBPT 试验: 于洁净玻板上滴加 30 μL 抗原,随后加入 30 μL 受检血清,搅拌混匀; 同时设阳性和阴性血清对照。SAT 试验: 参照国家标准 GB18646—2002 进行。RBPT 试验的判断标准: 在阳性和阴性血清对照成立的前提下,受检血清在 4 min 内出现肉眼可见的凝集现象者判为阳性; 无凝集现象,呈均匀粉红色者判为阴性。此方法得到的结果为初筛结果。
SAT 试验的判断标准: 在阳性和阴性血清对照成立的前提下,以出现 50% 以上凝集现象的最高稀释度作为血清抗体效价。血清效价在 1∶80 以上判为阳性;1∶20 和 1∶40 判为疑似反应; 无凝集现象,液体均匀混浊者判为阴性。
2. 2 血液细菌 DNA 提取及 PCR 鉴定
无菌抽取 RBPT 试验判断为布鲁菌抗体阳性的小熊猫静脉血,采用 Qiagen 公司的 QIAamp UCPPathogen Mini Kit 试剂盒提取血液细菌总 DNA,然后扩增布鲁菌属特异性基因 BCSP31。
参照参考文献设计扩增布鲁菌属特异性的BCSP31 引物,引物由上海生工生物工程技术服务有限公司合成。引物序列: F - BCSP31 5' - TGGCTCG-GTTGCCAATATCAA - 3',R - BCSP31 5' - CGCGCTT-GCCTTTCAGGTCTG - 3',扩增片段大小为 223 bp。
PCR 反应体系: 10 × Buffer 5 μL,2. 5 mmol / L dNTPs8 μL,上、下游引物(25 μmol / L) 各 2 μL,Taq 酶 2 U,模板 DNA 1 μL。PCR 反应程序: 95 ℃ 5 min; 94 ℃1 min,60 ℃ 1. 5 min,72 ℃ 1. 5 min,共 28 个循环; 最后 72 ℃再延伸 10 min。扩增产物用 1. 5% 琼脂糖凝胶进行电泳鉴定。
3、 结果与分析
3. 1 小熊猫布鲁菌病血清学检测(结果见 209 页彩图 1、图 2)
由图 1 可知,56 号(左 1) 及 72 号(右 7) 样品出现颗粒状沉淀,说明这 2 个样品呈 RBPT 阳性反应。对 RBPT 阳性的 56 号及 72 号样品采用 SAT 试验进一步验证,结果液体均匀混浊,均无凝集现象,说明 SAT 试验结果为阴性。
3. 2 血液细菌 DNA 的 PCR 鉴定
由于血清学存在一定比例的假阳性或阴性结果,试验又对 RBPT 阳性样品(56 号和 72 号) 的血液细菌总 DNA 进行 PCR,扩增布鲁菌属特异性基因 BC-SP31,结果见图 3。
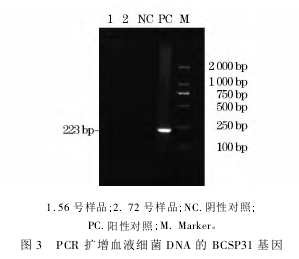
由图 3 可知,2 个样品都未扩增出特异性条带,说明扩增样品内不存在布鲁菌 DNA。综合 RBPT、SAT 及 BCSP31 - PCR 结果,排除了 2 只小熊猫感染布鲁菌病的可能性。
4、 讨论
关于动物布鲁菌病的处置,国家规定对牛、猪、羊及其他临床检查疑似布鲁菌病的动物进行血清学或病原学检测。检疫呈阳性的动物按照 GB16548—2006《病害动物和病害动物产品生物安全处理规程》的规定进行销毁处理,将布鲁菌病患畜消灭在产地,严防疫畜及其产品进入流通环节。但这些措施在珍惜野生动物、濒危动物甚至是国家保护动物中执行却面临挑战。
到目前为止,掌握的关于野生动物布鲁菌病的流行资料非常有限。虽然布鲁菌主要感染家畜和人类,但无论在有效实施布鲁菌病控制的国家,还是已宣布消灭布鲁菌病的国家,野生动物布鲁菌病的存在仍然对畜牧业和人类是一种潜在危害。鉴于野生动物疫病尤其是人兽共患传染病与人类健康密切相关,发达国家已建立了较为完善的野生动物疫病监测预警体系、管理体系和制度。但在我国这项工作尚处于起步阶段,现行的《中华人民共和国动物防疫法》、《中华人民共和国传染病防治法》、《中华人民共和国野生动物保护法》等法规对野生动物疫病监测与预警还属空白或较少,使国家在野生动物疫病种类、分布范围、扩散途径和发生动态方面缺乏最基本的资料,给野生动物保护和人类健康带来极大隐患。因此,鉴于布鲁菌病的流行特征及其对畜牧业发展和人类健康的巨大危害,对野生动物布鲁菌病的监测应该纳入动物疫病监测网络,研究制订野生动物病原学本底调查工作规划,确定野生动物布鲁菌病监测与防控的重点对象和区域范围,有选择性地进行采样和初步检测分析,进行病原学、血清学监测,并在此基础上建立样本检测数据库,对野生动物疫情发生和发展趋势进行科学分析和预警,争取做到防患于未然。国外研究者对采用口服疫苗控制野生动物布鲁菌病进行了研究,结果表明,野牛、糜鹿口服布鲁菌弱毒株 RB51,可起到一定免疫效果,这为开发野生动物口服布鲁菌疫苗提供了一定基础。我国自行研制的 S2 和 M5 疫苗可口服免疫家畜,但能否免疫野生动物值得商榷。此外,目前很多圈养及野生动物的布鲁菌病诊断都是发病后才开始进行检疫,这时往往已造成很大的经济损失。而对于动物园或者诸如成都大熊猫繁育研究基地这样的教育基地,每年都接待数以万计的旅游者。
如果动物园里的动物存在人兽共患病,势必会严重威胁旅游业的发展。因此,了解人类活动频繁地区的动物人兽共患病状况,将有助于对这类疾病的防控。
由于四川农业大学动物医学院动物疫病与人类健康四川省重点实验室不具备分离布鲁菌病原菌的条件,在本研究中仅采用血清学及分子生物学方法对2 例RB-PT 为阳性的疑似布鲁菌病进行了鉴别,而未进行布鲁菌病原菌培养。BCSP31 是布鲁菌属特异性基因,6 个种的布鲁菌 DNA 都有清晰的扩增条带,而对与布鲁菌有共同抗原、并具有血清交叉凝集的耶尔森菌、大肠埃希菌和沙门杆菌的 DNA 扩增反应都呈阴性。因此,很多研究对布鲁菌的鉴定都建立在以 BCSP31 为靶基因基础上。本研究对 RBPT 阳性样品进一步采用 SAT 试验及血液细菌的 PCR 鉴定排除样品布鲁菌病感染,避免对病例的误诊。目前,四川农业大学动物医学院动物疫病与人类健康四川省重点实验室正在对国内一些动物园的野生动物进行布鲁菌病血清学排查,进一步摸清西南地区野生动物布鲁菌病血清学感染资料,为珍惜野生动物、濒危动物甚至是国家保护动物是否存在布鲁菌病感染,以及是否需要进行免疫提供基础数据。
参考文献:
[1] 钟志军,于爽,徐杰,等. 布鲁菌进化和分类学研究进展[J]. 中国兽医学报,2011,31(8) : 1228 -1235.
[2] DAVIS D S,ELZER P H. Brucella vaccines in wildlife[J]. VetMicrobiol,2002,90(1 /2 /3 /4) : 533 - 544.
[3] 钟志军,于爽,徐杰,等. 布鲁氏菌比较基因组学研究进展[J].中国人兽共患病学报,2011,27(4) : 346 -350.





