
卵母细胞体外成熟(IVM)是指将不成熟的卵母细胞,在体外模拟体内成熟的微环境,培养至成熟卵子(MⅡ)的过程。此项技术开始于动物实验,早在1935年Pincus发现兔子的不成熟卵可以在体外成熟,并且这个成熟过程是自发的。
30年后,Edwars提出人类的不成熟卵母细胞可以体外发育成熟,并且通过实验证实其成熟过程需要至少24h.在卵母细胞的成熟过程中颗粒细胞通过缝隙连接传递多种信号,参与卵母细胞减数分裂的启动以及卵胞浆的成熟。有研究表明,对颗粒细胞卵母细胞复 合体(Cumulus-oocyte comeplexes,COCs)行IVM时,体外成熟率与受精率显着提高[1].不过,也有试验证明,颗粒细胞存在与否,并不能影响IVM的结局,甚至对卵母细胞的成熟与受精有负面影响[2].本文以颗粒细胞与卵母细胞的联系及信号传递为切入点,探讨在不同培养条件下的DOs能 否 达 到 和COCs相近的效果,更深层次研究颗粒细胞在IVM过程中的影响及作用,从而为DOs体外成熟创造更适合的培养环境。
1资料与方法
1.1实验动物
8~12周龄体重>25g健康CD-1小鼠(雌性40只,雄性10只)购自北京维通利华实验动物技术有限公司,饲养在控温控湿及人工光照的条件下,自由饮水、采食。
1.2 IVM培养基IVM基础培养
液购自瑞典vitrolife公司的卵裂期培养液(G1);促卵泡生成素由瑞士Serono公司生产,剂量为75IU/支;HCG由瑞士Serono公司生产,剂量 为5 000IU/支。将 上 述 试 剂 配 置 成 含FSH75IU/L和HCG150IU/L的IVM培养液[3],并用配好的培养液制备四孔皿,每孔放0.5~0.8ml覆盖矿物油,放在37℃、CO2浓度为6%培养箱中温浴不少于6h备用。
1.3卵母细胞收集
雌鼠腹腔注射HMG10IU,48h后颈椎脱臼处死并取出卵巢。清除卵巢表面的结缔组织置 于MOPS工作液中反复清洗。用1ml注射器穿刺卵巢表面,收集COCs.
1.4雄鼠精子收集选取8~12周、体重>25g健康活跃的雄性小鼠,脱臼处死,打开腹腔用拉细的玻璃管刺破附睾,将获取的精子移入到预先平衡好的G-IVF中,培养2h以上备用。
1.5卵母细胞体外培养
培养箱设定温度37℃,CO2浓度6%.卵母细胞培养24h后,观察成熟度,排出第一极体的视为成熟卵[4],实施单精子显微注射技术(intracytoplasmicsperm injection,ICSI),受精后移入卵裂期培养液(G1)继续培养观察。
1.6观察指标
培养24h后观察卵母细胞成熟度。胞浆均匀清晰,有第一极体(first polar body,PB1)排出的卵为成熟卵(MⅡ期卵)。没有PB1排出,也没有生发泡(germinal vesicle,GV)的为MⅠ期卵。胞浆颗粒较粗,颜色较深,有一个完整的细胞核,核膜清晰,核仁单个折光明显,此为GV期卵。
ICSI后16~18h出现双原核视为受精。胚胎评级依据卵裂球的大小、形态、发育速率,胞浆均匀情况及无核碎片的量,分为4个等级:分为4个等级:
1级:卵裂球大小均匀、形态规则,透明带完整;胞质均匀清晰;胚胎内无核碎片<10%.2级:卵裂球大小略不均匀、形态略不规则;胞质可有颗粒现象;胚胎内碎片10%~20%.
3级:卵裂球大小明显不均匀、可有明显形态不规则;胞质可有明显颗粒现象;胚胎内碎片21%~50%.4级:卵裂球大小严重不均匀;胞质可有严重颗粒现象;胚胎内碎片>50%.培养至第三天,卵裂球数目≥7且评级≥2级为优质胚胎。
1.7统计学方法应用SPSS 11.0软件包进行统计学分析,计量资料用单向方差分析(One-Way ANOVA),计数资料采用χ2检验。检验水准α=0.05.
2结果
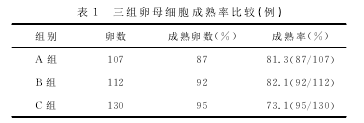
2.1三组卵母细胞成熟率的比较三组成熟率比较差异无统计学意义 (P >0.05)。但A、B二组的成熟率略高。见表1.
2.2三组卵母细胞受精率及后续发育比较A、B二组相对于C组有较高的受精率和优质胚胎率,差异有统计学意义(P<0.05),A、B二组之间的差异无统计学意义(P<0.05)。见表2.

3讨论
哺乳动物的卵母细胞表面包绕着多层排列紧密的颗粒细胞,它们与卵母细胞存在广泛而复杂的联系,在卵母细胞生长发育及成熟分裂过程中起着非常重要的作用。通过电镜观察,卵母细胞的细胞膜(卵黄膜)有许多微绒毛突向透明带,与外层的颗粒细胞形成联系。通过这些结构,颗粒细胞可以向卵母细胞提供营养物质、传递信号,这是多种激素、因子作用于卵母细胞的媒介[5]:
①促性腺激素作用于颗粒细胞,调节cAMP的合成及传递,调节卵母细胞成熟的进程。
②颗粒细胞在促性腺激素的作用下分泌甾体激素,体外培养中在有甾体激素的存在下卵母细胞后期发育更好,这可能与胞浆更成熟有关。
③颗粒细胞中cAMP依赖的MAPK通路激活是卵母细胞核成熟所必要的。
④颗粒细胞合成的激活素和抑制素能调节促性腺激素特别是FSH的分泌,在卵母细胞成熟中发挥重要作用。体外培养过程中,低浓度的颗粒细胞可以促进卵母细胞成熟分裂,高浓度的颗粒细胞作用则相反。这可能因为,更多的颗粒细胞能合成更多的cAMP,导致 卵母细 胞内cAMP升高,抑制减数分裂的重启。所以,有学者主张培养液中加入颗粒细胞,用以延缓核成熟,从而让胞浆与胞核成熟更加同步。
大量数据证明颗粒细胞能促进卵母细胞胞浆的成熟[6],脱去颗粒的未成熟卵母细胞即使发育成熟,也不能正常受精及发育[7].卵母细胞在体外的培养环境与体内不同,在处理卵母细胞和脱颗粒的过程中,丢失了卵泡膜细胞、卵丘细胞和卵泡液,这会导致减数分裂抑制因子尤其是cAMP的合成减少,又由于卵泡液中抑制成分丢失,失去了抑制成分的卵母细胞可以激发减数分裂,核成熟的进程不被控制。
由此可见,离体的未成熟卵母细胞可自发的核成熟,这可能是一个自动程序。尽管卵母细胞的生长依赖于颗粒细胞,但在成熟分裂的过程中颗粒细胞不被依赖。本次实验证实DOs与COCs有相近的成熟率。卵母细胞表明没有促性腺激素的受体,失去了激素及颗粒细胞的作用DOs的胞浆很难成熟,而细胞核成熟仍可自发进行。
此时的卵母细胞胞浆与胞核发育极不同步,导致了受精率低下、多精受精、发育潜能差等诸多问题,严重影响成功率。因此我们需要采取措施来延缓核成熟的进程及促进卵胞浆的成熟:将DOs与COCs混合培养,希望颗粒细胞合成的cAMP、雌孕激素以及自分泌和旁分泌的活性因子能对DOs产生影响。本次试验显示,单独培养的DOs虽有不错的成熟率,但其成熟后的胚胎发育不佳。这是因为缺乏了颗粒细胞对卵母细胞成熟的调控,卵胞浆和细胞核成熟很难同步,出现了胞浆不成熟但细胞核却率先成熟的卵子。同时本此试验也证实与COCs混合培养的DOs与单独培养的COCs有相近的成熟率及发育潜能。这可能因为COCs体外培养中,在Gn的作用下颗粒细胞自分泌和旁分泌的活性物质可以影响临近的DOs[8],并且裸卵仍有颗粒细胞埋入透明带的部分,用来传递各种信号[91.
这些信号调控了卵母细胞的成熟,使胞浆与胞核发育更加同步。
4参考文献:
[1]人未成熟卵母细胞培养体系研究进展[J].生殖与避孕,2014,(5):388-394.
[2]Takashi Nauai,Nobuhiko Yamauchi,Kazuhiro Kiku-chi.Nuclear and cytoplasmic maturation in vitro ofporcine oocytes[J].Journal of Reproduction and De-velopment,2001,147:55-61.
[3]洪焱,黄绘,骆荣,等.培养液中添加不同促性腺激素对卵母细胞体外成熟的影响[J].生殖与避孕,2011,31(12):833-837.





