
MSC 具有多项分化潜能,容易分离培养,是组织工程研究常用种子细胞之一[1].bFGF 基因转染 MSC 的过程、转染时限、效率、评估手段一直临床亟待解决的问题。探讨通过以病毒为载体,体外构建 bFGF 基因转染 MSC 的方法,为进行 MSC 相关研究提供实验基础。具体报道如下。
1 材料和方法
1.1 研究对象
选取 SD 大鼠(中国医科大学提供),体重为 150 g.
1.2 主要试剂及仪器
DMEM(美国 GIBCO);FBS(美国 ExCell Biology);bFGF(武汉博士德生物);CO2培养箱(日本 SANYO);生物倒置显微镜(日本 OLYMPUS);高速冷冻离心机(德国 Sorvall);WesternBlot 抗体清除缓冲液(南京凯基生物科技发展有限公司)。
1.3 研究方法
1.3.1 细胞培养 取健康成年 SD 大鼠,断颈处死后,常规消毒,取双侧股骨和胫骨,去掉附着在骨表面的软组织后,暴露骨髓腔,吸取 DMEM 培养液,洗净骨髓腔后,抽取骨髓,制成单细胞悬液,离心处理 20 min,去除上清,添加完全培养液进行重悬,将细胞悬液接种在培养瓶中,防置在 37℃、5%CO2饱和湿度中进行细胞培养。每 3 天换液 1 次,待细胞汇合 80%时,添加胰蛋白酶和EDTA 进行消化,依据 1 :2 进行传代培养。取 3 代细胞,分为正常组、阴性组和 bFGF 组。
1.3.2 病毒转染细胞 bFGF 组将 MSC 细胞配制成细胞悬液后,滴加到细胞培养孔中,加入优化培养基和 Ad.bFGF 液,终浓度达 5 μg/ml 时,混匀,培养 24 h 后,更换培养基继续培养 48 h.
1.3.3 免疫组化染色检测 bFGF 表达 细胞样本经多聚甲醛固定液浸泡后,用 PBS 浸洗 3 次,滴加即用型山羊血清,室温孵育,滴加一抗,37℃下湿盒孵育 2 h,添加增强剂,室温湿盒孵育 30 min,添加二抗,室温孵育 30 min,添加 DAB 显色剂,常规复染、脱水和封固后,镜下观察细胞形态和染色深浅。
1.4 观察指标
应用显微镜观察细胞形态改变,并应用 Western- Blot 法分析bFGF 基因表达情况。
1.5 统计学方法
应用 SPSS14.0 软件,计量数据组间比较用单因素方差分析,P < 0.05,差异具有统计学意义。
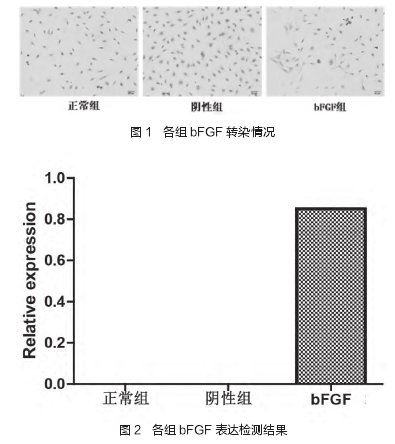
2 结果
正常组原代细胞体外培养 24 h 后,可见微量圆形贴壁细胞;72 h 后,贴壁细胞增多,具有成纤维细胞的典型形态。传代培养24 h 后,基本完成贴壁;5 天后细胞成梭形,胞体饱满,保持原代细胞形态特征。阴性组和正常组均未见转染 bFGF.bFGF 组 MSC细胞胞浆呈黄色,出现细胞染色现象。见图 1.Western-Blot 分析显示阴性组和正常组未见 bFGF 表达,bFGF 组样本可见特异性条带,其表达量为 0.85,与 bFGF 分子量一致,转染细胞 bFGF 阳性表达高于正常组及阴性组,P > 0.05,差异不具有统计学意义。见图 2.
3 讨论
BFGF 能够促进 MSC、成骨细胞以及血管内皮细胞增殖,对于细胞发育以及组织修复具有积极作用,是调控 MSC 定向分化的主要生长因子之一[2].如何利用 BFGF 调控 MSC 定向分化一直是研究热点。本实验通过病毒转染方法,将外源性 bFGF 基因导入MSC,免疫组化染色结果发现,转染细胞能够成功表达 bFGF,并且其阳性主要位于细胞浆,Western-Blot 分析正式转染细胞样本能够特异性表达 bFGF,而正常组和阴性组则未见 bFGF 特异性条带。
综上所述,采用病毒将bFGF基因转染MSC中,具有操作相对简单,目的基因遗传稳定的特点。
参考文献
[1] 郑有华,张志光,苏凯,等 . 体外培养条件下人骨髓间充质干细胞碱性成纤维细胞生长因子基因的转染与鉴定 [J]. 中国组织工程研究与临床康复,2010,14(19):3507-3512.
[2] 郑彬,孙峰,赵戈 . 碱性成纤维细胞生长因子基因转染对鼠胎肝干细胞培养的优化作用 [J]. 中华移植杂志(电子版),2013,7(2):89-93.





