
将已分化的体细胞重编程为类胚胎干细胞样细胞的技术完成于 2006 年. Takahashi 等[1]通过外源表达一组选择性的转录因子导入成体小鼠成纤维细胞, 最终确定最少有 4 种转录基因组合---Oct4 (也称 Pou5f1、Oct3 / 4)、Sox2、Klf4 和 c-Myc 可将成纤维细胞重编程为诱导性多潜能干细胞(iPS细胞).从此 iPS 细胞的研究开始成为干细胞研究领域的热门,并且 iPS 细胞的来源也越来越广泛.利用iPS 细胞诱导技术将终末分化细胞先诱导成 iPS 细胞,再进一步诱导成具有特定功能的细胞,如神经细胞,心肌细胞等,称为诱导性细胞. 时至今日研究者已经开始尝将 iPS 细胞应用于临床治疗.
1、诱导性多潜能干细胞的研究进展
从 iPS 细胞诞生之日起,iPS 细胞的研究就成为细胞研究领域的热门. 起初, 研究者诱导 iPS 细胞时,iPS 细胞的诱导效率极低,而且他们用的是 4 个转录因子 Oct4、Sox2、Klf4 和 c-Myc,其中 c-Myc 还具有一定的致癌作用. 后来经过科学家们的不断尝试, 开始用小分子化合物、miRNA、mRNA 或蛋白质等导入细胞来诱导 iPS 细胞[1-6],转录因子的个数也从 4 个减少到 1 个,甚至只用小分子化合物等物质来诱导 iPS 细胞[7-9]. 近年来 iPS 细胞研究取得了突破性进展,如建立了人类疾病特异的 iPS 细胞,借助锌指核酸酶和转座子等介导的转基因技术高效制备了无病毒的 iPS 细胞[10-13].
从 2007 年 Takahashi 等[2]和 Yu 等[3]先后将人的体细胞重编程为 iPS 细胞开始, 多种人类成体干细胞被重编程为诱导性多潜能干细胞, 但是直到2013 年 Trokovic 等[14]才将人类骨骼成肌细胞重编程为 iPS 细胞,他们通过逆转录病毒载体(图 1)或仙台病毒载体介导目的基因的异位表达,在无饲养层且含有适宜的培养基条件下,可以使人类骨骼成肌细胞达到和人类成纤维细胞一样的重编程效率,再加入组蛋白脱乙酰酶抑制剂丙戊酸钠 (VPA)、丁酸钠(NaB)和 ALK4/5/7 抑制剂 SB431542(SB),能明显提高人类骨骼成肌细胞重编程为 iPS 细胞的诱导效率.
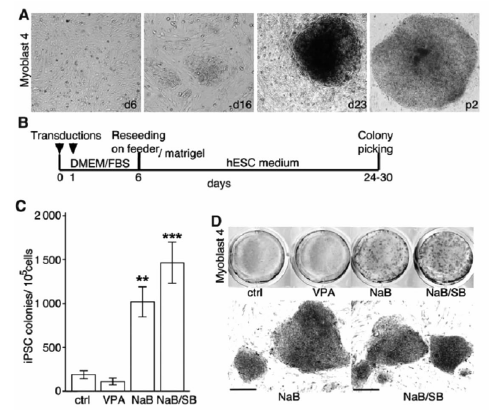
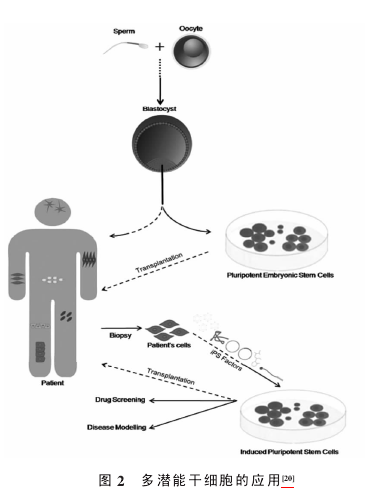
到目前为止,除了人之外,小鼠、大鼠、猴子、绵羊、猪的 iPS 细胞系均已建立[15-19].iPS 细胞研究的意义重大, 它不仅为多潜能干细胞[20]的获取提供了新的途径,而且避免了传统胚胎干细胞研究中存在的伦理问题,同时还解决了免疫排斥反应问题,为细胞的体外培养和诱导提供了平台(图 2),使人们在细胞和分子水平上研究人类多种疾病及其发病机理成为可能(图 3),也为相应药物的研发提供了便利. 正是由于 iPS 细胞技术使得整个细胞生物学研究发生了质的飞跃, 所以 Ya-manaka 荣获了 2012 年的诺贝尔医学奖. 当然,目前iPS 细胞的发生机制还不是十分明确, 还有待深入了解,iPS 细胞的诱导效率仍然很低,整个诱导过程相对繁琐,费用比较昂贵,达到商业化、大众化应用的地步还有些遥远,这一切都有待进一步研究和开发.

2、诱导性细胞的研究进展
利用 iPS 细胞诱导技术, 通过导入特定的转录因子组合,再加入一些小分子化合物等物质,将终末分化细胞先诱导成 iPS 细胞, 再进一步诱导成具有特定功能的细胞,如神经细胞、心肌细胞等,称为诱导性细胞或诱导性功能细胞. 到目前为止,已经在多种具有重要功能的细胞上诱导成功[21-23].
2.1 诱导性造血和血管祖细胞Park 等[21]在改进的无饲养层的内皮培养条件下, 利用了一组重组生长因子 [骨形态发生蛋白 4(BMP4)、血管内皮生长因子(VEGF)和 纤维母细胞生长因子 2(FGF2)]的最适组合,然后在成分明确的内皮细胞生长培养基(EGM-2)中附着低密度培养,用人类胚胎干细胞和人类诱导多潜能干细胞培育出大量的 CD34+CD45+造血祖细胞(表 1). 这些造血祖细胞出现在附着于内皮或基质的细胞层周围,从某种意义上来说,这种方式与体内胚胎生血内皮的造血方式类似. 虽然之前已经证实由成纤维细胞衍生而来的 hiPSC 细胞系并不具备有效分化为造血内皮的能力, 但是这个培养体系能够使 hiPSC 具有和 hESC 一样分化为造血内皮的能力. 这个有效的分化体系可用于直接延时摄像和造血发生过程的时间进程研究等.

2.2诱导性神经细胞Kuo 等.在由海藻酸和多聚 γ-谷氨酸(γ-PGA)以及表面神经生长因子构成的水凝胶中将 iPS 细胞诱导成神经元. 这种由海藻酸和多聚 γ-谷氨酸(γ-PGA) 以及表面神经生长因子构成的水凝胶在整个诱导过程中发挥着重要作用,而孔隙结构、孔隙度和溶胀比也有一定的影响. 在这种水凝胶中,iPS 细胞分化的形态学图像(图 4)展示出神经元的特点.
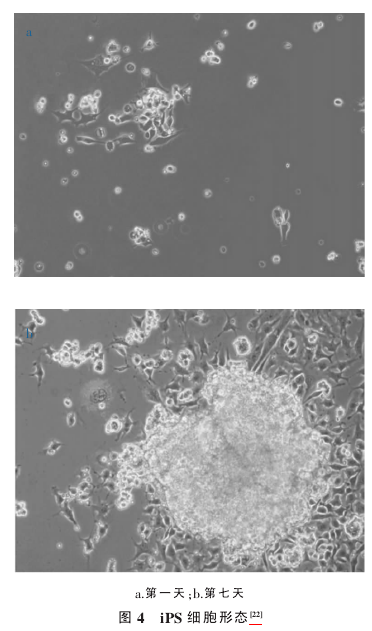
在诱导 iPS 细胞向神经元分化的过程中, 表面神经生长因子可以增强 β Ⅲ微管蛋白的表达强度而抑制 SSEA-1 的表达强度.iPS 细胞在这种水凝胶中的分化可以通过 SSEA-1 和 β Ⅲ微管蛋白的表面抗原免疫化学染色和扫描电子显微镜来观察鉴定.
2.3诱导性心肌细胞Jiang 等[23]使用从 Oct4-GFP-C57 小鼠身上获得的心脏成纤维细胞(Cardiac fibroblasts,CFs)感染逆转录表达重组因子(Oct4、Sox2、Klf4 和 c-Myc)来诱导功能性心脏细胞(Cardiomyocytes,CMs).以初代的小鼠胎儿成纤维细胞(MEFs)作为对照,试验发现由 CFs 衍生而来的 iPS 细胞(CF-iPS)与胚胎干细胞(EBs)及 MEF 衍生而来的 iPS 细胞(MEF-iPS)具有同样的生理学特性. 他们使用经典拟胚体的方法和Transwell CM 共 培养体系来模拟心肌旁分泌微环境,进而将 CF-iPS 向功能性心肌细胞诱导. 在模拟的心肌旁分泌微环境中,CF-iPS 自发地形成可以跳动的 EBs. 这些分化而来的能够自发跳动的细胞可以表达心脏特有的组织特异性转录和结构因素,而且显示出典型的心肌形态学和电生理特征.
当然,除了上述诱导性造血和血管细胞、诱导性神经细胞和诱导性心肌细胞外,还有其他的诱导性功能细胞也已经被人们所发现并认知. 如 Yam-aguchi 等[24]将小鼠的 iPS 细胞诱导成肥大细胞.
3、展望iPS 细胞
自诞生之日起即受到人们的关注,iPS细胞的研究开创了细胞生物学的新篇章,也极大地促进了表观遗传学和胚胎生物学的发展,为人类再生医学和特异的细胞治疗带来了更美好的希望.如果供体细胞是来源于病人自身的体细胞,就可以避免免疫排斥反应问题,将这些体细胞先诱导成 iPS 细胞, 进而再诱导成具有特定功能的目的细胞,理论上就可以用于临床医学和再生医学,这样就有望实现个性化治疗. 然而,到目前为止,诱导性功能细胞的种类有限,诱导效率也有待提高,并且细胞的功能仍需要大量动物模拟试验验证.目前,如何获取更多的从终末分化细胞诱导而来的 iPS 细胞, 并进一步诱导成具有特定功能的细胞成为热点, 对多种体细胞衍生的 iPS 细胞和多种新的培养诱导方法[25-28]也已经进行了尝试.
尽管这种诱导的功能性体细胞在将来可能具有较高的应用价值,但是其中的详细机理仍需要探索明确. 相信在胚胎干细胞研究、iPS 细胞研究、现代基因组学和 RNA 组学以及蛋白质组学的发展和带动下,在不远的将来,越来越多的诱导性功能细胞有望在临床医学和生物学基础研究上发挥重要作用, 从而加快再生医学和动物组织工程的发展,同时,也能促进发育生物学、表观遗传学和细胞生物学等基础研究的发展.
参考文献:
[1] TAKAHASHI K, YAMANAKA S. Induction of pluripotent stemcells from mouse embryonic and adult fibroblast cultures bydefined factors[J]. Cell,2006,126(4):663-676.
[2] TAKAHASHI K, TANABE K, OHNUKI M, et al. Inductionof pluripotent stem cells from adult human fibroblasts by de-fined factors[J]. Cell, 2007,131(5):861-872.
[3] YU J, VODYANIK M A, SMUGA-OTTO K, et al. Inducedpluripotent stem cell lines derived from human somatic cells[J].Science, 2007,318(5858):1917-1920.
[4] ZHAO Y, YIN X L, QIN H, et al. Two supporting factorsgreatly improve the efficiency of human iPSC generation [J].Cell Stem Cell, 2008,3(5):475-479.
[5] LI W, WEI W, ZHU S, et al. Generation of rat and humaninduced pluripotent stem cells by combining genetic reprogram-ming and chemical inhibitors [J]. Cell Stem Cell, 2009,4(1):16-19.
[6] ANOKYE-DANSO F, TRIVEDI C M, JUHR D, et al. Highlyefficient miRNA-mediated reprogramming of mouse and humansomatic cells to pluripotency[J]. Cell Stem Cell,2011,8 (4):376-388.





