摘 要: 背景:寻找促进骨髓间充质干细胞增殖及向成骨细胞分化的方法, 可以为治疗骨质疏松类疾病提供治疗思路。目的:探讨氯化锂调控大鼠骨髓间充质干细胞增殖分化的机制。方法:实验采用全骨髓细胞接种法和贴壁纯化培养大鼠骨髓间充质干细胞, 分别给予0, 2, 5 nmol/L氯化锂进行干预;采用CCK-8法检测大鼠骨髓间充质干细胞的增殖情况, 茜素红染色法检测钙化结节形成情况, PNPP法测定碱性磷酸酶活性, Western blot法检测大鼠骨髓间充质干细胞中GSK3β, p-GSK3β, β-catenin蛋白含量变化。结果与结论:①2, 5 nmol/L氯化锂均能促进大鼠骨髓间充质干细胞增殖, 5 nmol/L氯化锂促增殖能力最强;②2, 5 nmol/L氯化锂组矿化结节与碱性磷酸酶活性均比0 nmol/L氯化锂组明显, 且5 nmol/L氯化锂促成骨分化更为显着;③2, 5 nmol/L氯化锂能够显着增加p-GSK3β、β-catenin蛋白表达, 而各组GSK3β蛋白表达差异无显着性意义;④结果表明, 氯化锂能够促进大鼠骨髓间充质干细胞的增殖及向成骨细胞分化, 其可能机制是通过调控Wnt/β-catenin信号通路相关蛋白表达实现的。
关键词: 氯化锂; 骨髓间充质干细胞; 细胞增殖; 成骨分化; 钙化结节; 碱性磷酸酶活性; Wnt/β-catenin信号通路; 国家自然科学基金;
Abstract: BACKGROUND: Seeking proper methods to promote the proliferation and osteogenic differentiation of bone marrow mesenchymal stem cells can provide therapeutic ideas for the treatment of osteoporosis.OBJECTIVE: To study the mechanism of lithium chloride on the proliferation and differentiation of rat bone marrow mesenchymal stem cells.METHODS: Rat bone marrow mesenchymal stem cells were cultured with the whole bone marrow cell inoculation and adherent purification, followed by intervention with 0, 2, 5 nmol/L lithium chloride. Cell counting kit-8 was used to detect the effect of lithium chloride on the proliferation of bone marrow mesenchymal stem cells. Alizarin red staining was used to determine calcified nodules.PNPP method was applied to measure alkaline phosphatase activity. The contents of glycogen synthase kinase 3β, phosphorylated glycogen synthase kinase 3β and β-catenin in rat bone marrow mesenchymal stem cells were determined by western blot.RESULTS AND CONCLUSION: Lithium chloride, 2 and 5 nmol/L, promoted the proliferation of bone marrow mesenchymal stem cells and5 nmol/L lithium chloride had the strongest proliferative effect. Compared with 0 nmol/L group, more calcified nodules and higher alkaline phosphatase activity were observed in the 2 and 5 nmol/L groups, especially in the 5 nmol/L group. Both 2 and 5 nmol/L lithium chloride upregulated the expression of phosphorylated glycogen synthase kinase 3β and β-catenin proteins, but showed no difference in the expression of glycogen synthase kinase 3β. In conclusion, lithium chloride can promote the proliferation and osteogenic differentiation of rat bone marrow mesenchymal stem cells, and the possible mechanism is through the regulation of Wnt/β-catenin signaling pathway-related protein expression.
Keyword: lithium chloride; bone marrow mesenchymal stem cells; cell proliferation; osteogenic differentiation; calcified nodules; alkaline phosphatase activity; Wnt/β-catenin signaling pathway; National Natural Science Foundation of China;
0、引言Introduction
骨髓间充质干细胞具有自我更新、增殖潜能和分化成多种细胞类型的能力, 包括成骨细胞、脂肪细胞、软骨细胞、神经元等[1,2,3]。骨髓间充质干细胞向脂肪细胞和成骨细胞的分化是竞争性调节的[4,5], 在骨微环境平衡中起着关键的作用。在正常条件下, 骨髓间充质干细胞成脂分化和成骨分化之间的平衡趋向成骨分化, 维持正常骨形成[6,7,8];但是在非正常情况下, 如骨质疏松患者骨髓间充质干细胞分化的平衡可能被破坏, 骨髓间充质干细胞具有较低的生长速度, 并表现出以减少成骨为代价的脂肪细胞分化, 导致低骨量和高骨髓脂肪量[9,10,11]。因此, 骨髓间充质干细胞的增殖和分化已经成为骨质疏松的治疗靶点。
骨髓间充质干细胞的增殖和分化受到多种信号通路和相关蛋白的调控, 其中经典Wnt/β-catenin信号通路通过调节下游相关蛋白表达对成骨细胞分化和成骨脂肪源性反向分化进行调节[12,13]。研究发现氯化锂能够通过调节Wnt信号通路中β-catenin、GSK3β和cyclinD1蛋白表达诱导毛囊干细胞的定向分化[14], GSK3β作为Wnt/β-catenin通路中关键的调控蛋白参与细胞内糖代谢过程, 对于干细胞的增殖、分化和凋亡具有重要的调控作用[15,16,17]。前期研究发现氯化锂能够促进骨髓间充质干细胞向成骨细胞分化, 然而其作用机制并不明确。因此, 该研究采用不同浓度的氯化锂对大鼠骨髓间充质干细胞进行处理, 探讨氯化锂诱导骨髓间充质干细胞向成骨细胞分化的作用机制。

1、 材料和方法Materials and methods
1.1、 设计
随机分组, 对比观察体外细胞实验。
1.2、 时间及地点
实验于2017年1月至2018年5月在黑龙江中医药大学方剂实验室完成。
1.3、 材料
1.3.1、 实验动物
4周龄SPF级健康雌性SD大鼠10只, 体质量180-200 g, 由黑龙江中医药大学提供, 动物合格证编号SCXK黑2015004。
1.3.2、 实验药物与试剂
氯化锂 (Sigma, 美国) ;胎牛血清、α-MEM培养基、青霉素-链霉素混合液和胰酶 (Hyclone, 美国) ;CCK-8 (同仁, 日本) ;GSK3β、p-GSK3β、β-catenin、GAPDH抗体 (Abcm公司) ;维生素C、β-甘油磷酸钠、地塞米松 (Sigma, 美国) ;茜素红染液 (索莱宝, 中国) ;对硝基苯磷酸二钠 (PNPP) (大连美伦, 中国) 。
1.4 、实验方法
1.4.1、 骨髓间充质干细胞的分离和培养[18]
SD大鼠采用颈椎脱臼法处死浸泡于体积分数为75%乙醇中10 min, 无菌条件下取双侧股骨、胫骨以及肱骨, 置于无血清培养液中, 剪断双侧干骺端, 暴露出骨髓腔, 用1 mL注射器吸取培养基反复冲洗骨髓腔, 收集细胞冲洗液于离心管中, 800 r/min离心10 min, 弃上清, 用含有体积分数为10%胎牛血清的完全培养液重悬细胞, 于体积分数为5%CO2、37℃培养箱内培养, 12 h后换液, 去除未贴壁细胞, 以后每3 d换液1次, 当细胞长满后传代, 应用倒置显微镜对细胞形态进行观察。

1.4.2、 CCK-8法检测骨髓间充质干细胞的增殖能力
将第3代骨髓间充质干细胞浓度调整为1×107 L-1, 接种于96孔培养板, 每孔200μL, 置于体积分数为5%CO2的37℃培养箱中进行培养, 待细胞长满瓶底80%以上时, 每孔分别加入0, 2, 5 nmol/L氯化锂继续培养24 h, 每孔加入10μL CCK-8继续培养4 h, 用酶标仪在490 nm波长下测定吸光度值。
1.4.3、 采用茜素红染色法检测成骨细胞钙化结节形成情况[19]
将细胞传代3次后, 在矿化诱导培养基 (100 nmol/L抗坏血酸, 10 mmol/Lβ-甘油磷酸, 7 mol/L地塞米松) 中对细胞进行成骨性诱导培养。待细胞贴合至80%后, 按终浓度分别为0, 2, 5 nmol/L加入氯化锂培养21 d, 弃培养液, PBS冲洗细胞3次, 体积分数为95%乙醇固定15 min, 加入0.1%茜素红染色, 37℃孵育1 h, 双蒸水冲洗3次, 观察并照相。
1.4.4、 采用PNPP法测定成骨细胞的碱性磷酸酶活性[20]
细胞培养和处理方式同1.4.3。细胞培养21 d弃培养液, PBS漂洗2遍, 1%Triton X-100反复冻融3次, 细胞裂解物在37℃孵育于磷酸盐底物中30 min, 然后加入1 mol/L NaOH终止反应, 405 nm下测定吸光度值。
1.4.5、 采用Western blot法检测骨髓间充质干细胞中wnt信号通路相关蛋白含量
取第3代对数期的大鼠骨髓间充质干细胞, 以每孔2×104个接种于6孔培养板, 每孔2 mL, 待细胞贴壁后弃上清液, 按照实验分组给予0, 2, 5 nmol/L氯化锂干预, 每孔2 mL。药物干预2 d后, 提取各组细胞总蛋白进行蛋白定量, 经12.5%SDS-PAGE电泳分离, 转移至PVDF膜上, 用含5%脱脂奶粉的Tris-HCl缓冲液室温孵育1 h后, 加入GSK3β, p-GSK3β, β-catenin一抗4℃过夜, 用含吐温-20的TBS洗膜3次, 每次10 min, 加山羊抗兔二抗室温孵育1 h, TBST洗膜3次, 每次1 min, 加入辣根过氧化物酶标记的链霉卵白素, 室温孵育1 h, TBST洗膜3次, 每次10 min, 采用ECL法显色。凝胶成像系统摄片并分析, 结果以目的条带与内参条带 (GAPDH) 吸光度比值表示。
1.5、 主要观察指标
(1) 不同浓度氯化锂对骨髓间充质干细胞增殖作用的影响; (2) 不同浓度氯化锂对骨髓间充质干细胞成骨能力的影响; (3) 不同浓度氯化锂对骨髓间充质干细胞中wnt信号通路相关蛋白含量的影响。
1.6、 统计学分析
所有数据均采用SPSS 22.0统计软件进行方差分析及t检验, 结果以±s表示, P<0.05为差异有显着性意义。
2、 结果Results
2.1、 骨髓间充质干细胞形态分析
接种24 h后可见少量星形、梭形细胞贴壁生长, 见图1A;培养6 d后可见梭形细胞呈现放射状排列, 见图1B。
2.2、 氯化锂对大鼠骨髓间充质干细胞增殖的影响
如表1所示, CCK-8法检测结果显示一定浓度的氯化锂能对骨髓间充质干细胞增殖产生促进作用, 并且不同浓度组的生长率差异有显着性意义, 细胞增殖率随着氯化锂的浓度升高而增加。
表1 不同浓度氯化锂对骨髓间充质干细胞增殖作用影响 (±s, n=8)
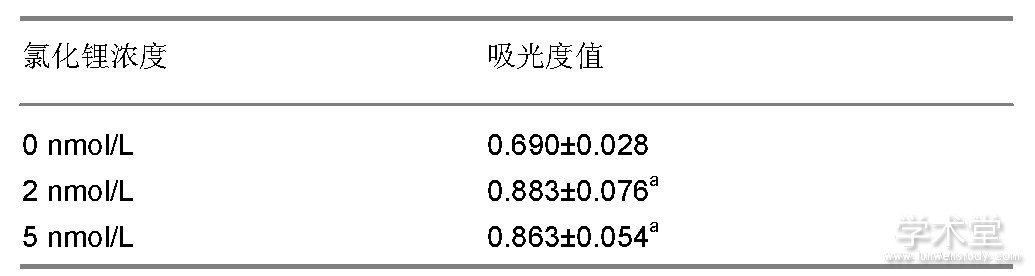
表注:与0 nmol/L比较, aP<0.05。
2.3、 不同浓度氯化锂对骨髓间充质干细胞成骨能力的影响
如图2所示, 细胞汇合时均呈多层重叠生长, 细胞局部堆积成灶状, 形成钙结节, 茜素红染色后钙结节染成橘红色, 说明此方法得到的细胞具有典型成骨细胞形态学和生物学活性。如图3所示, 2, 5 nmol/L氯化锂组矿化结节与碱性磷酸酶活性均比空白组明显, 且5 nmol/L氯化锂的矿化结节与碱性磷酸酶活性更为显着。
2.4、 氯化锂对骨髓间充质干细胞中GSK3β, p-GSK3β, β-catenin含量的影响
如图4所示, 2, 5 nmol/L氯化锂能够显着增加p-GSK3β蛋白的含量, 而各组GSK3β蛋白含量差异无显着性意义;2, 5 nmol/L氯化锂能够显着提高β-catenin的含量。
3 、讨论Discussion
在哺乳动物整个生命周期中骨骼的不断更新过程称为骨重塑, 在这个过程中既包括破骨细胞骨吸收过程也包括成骨细胞骨再生过程[21]。生理条件下, 骨的吸收和形成处于平衡状态。随着年龄的增长, 骨吸收和骨形成的平衡被破坏使得骨量减少。骨量及机械强度下降导致骨脆性增加形成的症候群称之为骨质疏松症。临床上治疗骨质疏松主要通过促进成骨细胞增殖分化[22], 在骨微环境中骨髓间充质干细胞可以分化成为成骨细胞[23]。有报道指出, 锂具有提高骨髓间充质干细胞增殖的能力[24]。此研究也得到类似的结果, 不同浓度的氯化锂均具有提高大鼠骨髓间充质干细胞增殖的能力, 5 nmol/L氯化锂促进大鼠骨髓间充质干细胞增殖能力最强。
研究发现锂钙复合盐具有促进大鼠骨髓间充质细胞向成骨细胞分化的作用[25]。在此研究中, 对成骨细胞的钙化结节和碱性磷酸酶活性的研究结果发现, 5 nmol/L氯化锂能够明显增强大鼠骨髓间充质干细胞的矿化能力和碱性磷酸酶活性, 说明氯化锂能够定向诱导骨髓间充质干细胞向成骨细胞分化。该实验结果与王斌等[14]研究氯化锂具有诱导毛囊干细胞定向分化结果相似, 表明氯化锂具有诱导干细胞定向分化的能力。
GSK3β是一种调节代谢的激酶, 也是wnt信号通路中关键的调节蛋白[26,27]。β-catenin是wnt信号通路中重要的下游功能性蛋白, 进入细胞核后可以诱导骨髓间充质干细胞向成骨细胞分化, 如果β-catenin受到抑制则会导致骨质疏松[28]。GSK3β可以与β-catenin结合从而抑制wnt信号通路[29]。有研究表明, 锂可以直接或间接抑制GSK3β的活性, 从而对wnt信号通路进行负调控[30]。Western blot结果发现不同浓度的氯化锂处理大鼠骨髓间充质干细胞能够明显增加p-GSK3β和β-catenin蛋白表达, GSK3β蛋白表达没有变化, 表明氯化锂能够调节骨髓间充质干细胞向成骨细胞分化相关蛋白p-GSK3β和β-catenin的表达。综上所述, 氯化锂具有促进骨髓间充质干细胞增殖及诱导其向成骨细胞分化的能力, 其可能机制是通过调控Wnt/β-catenin信号通路相关蛋白表达实现的。
图1 大鼠骨髓间充质干细胞形态 (×100)
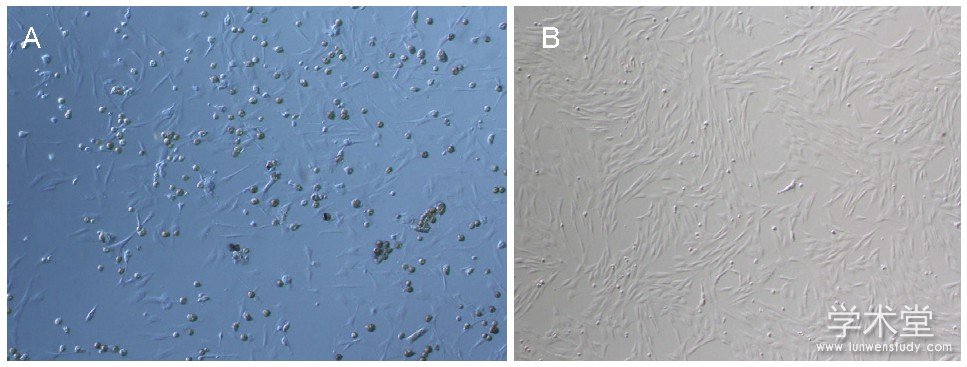
Figure 1 Morphology of rat bone marrow mesenchymal stem cells (×100)
图注:图中A为培养1 d, 可见少量星形、梭形细胞贴壁生长;B为培养6 d, 可见梭形细胞呈现放射状排列。
图3 各组骨髓间充质干细胞碱性磷酸酶活性Figure 3 Alkaline
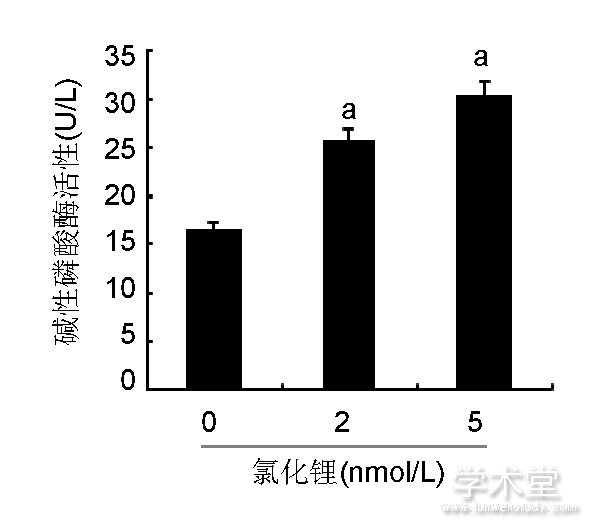
phosphatase activity of bone marrow mesenchymal stem cells
图注:与0 nmol/L氯化锂组比较, aP<0.05。
图2 各组骨髓间充质干细胞钙化结节染色 (×100)
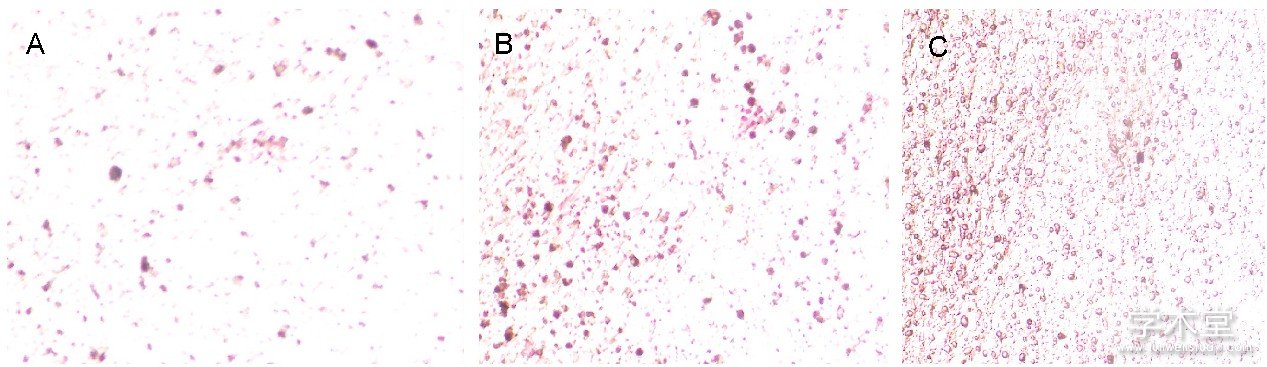
Figure 2 Calcified nodule staining of bone marrow mesenchymal stem cells (×100)
图注:图中A-C分别为0, 2, 5 nmol/L氯化锂组, 由图可见2, 5 nmol/L氯化锂组矿化结节均多于0 nmol/L氯化锂组, 且5 nmol/L氯化锂组矿化结节最多。
图4 各组骨髓间充质干细胞中GSK3β、p-GSK3β、β-catenin蛋白含量
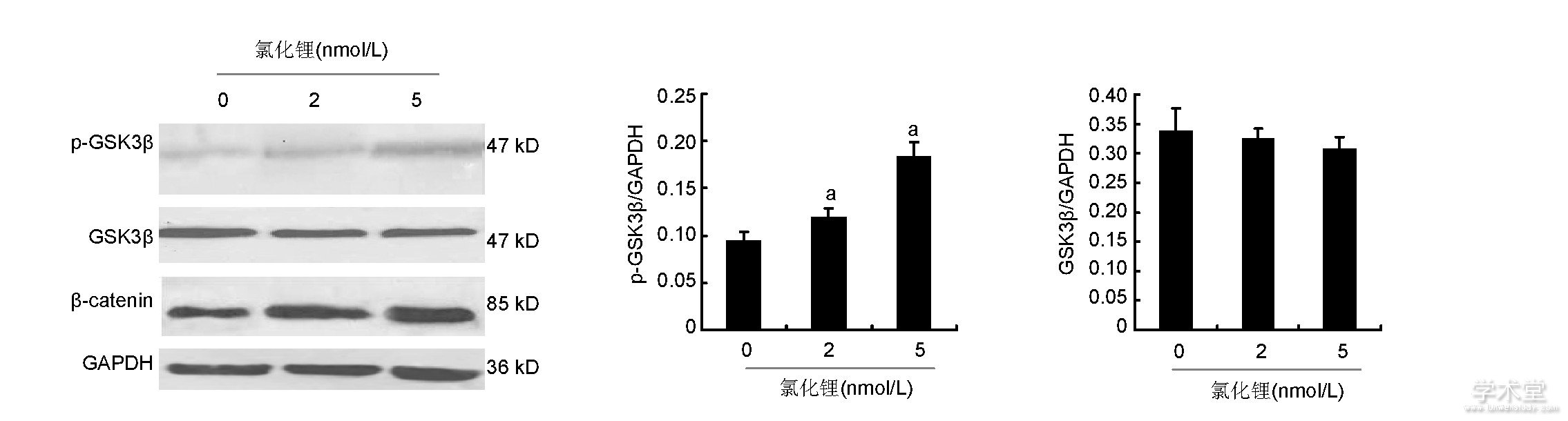
Figure 4 Expression of glycogen synthase kinase 3β, phosphorylated glycogen synthase kinase 3βandβ-catenin proteins in bone marrow mesenchymal stem cells
图注:与0 nmol/L氯化锂组比较, aP<0.05。
图4 各组骨髓间充质干细胞中GSK3β、p-GSK3β、β-catenin蛋白含量
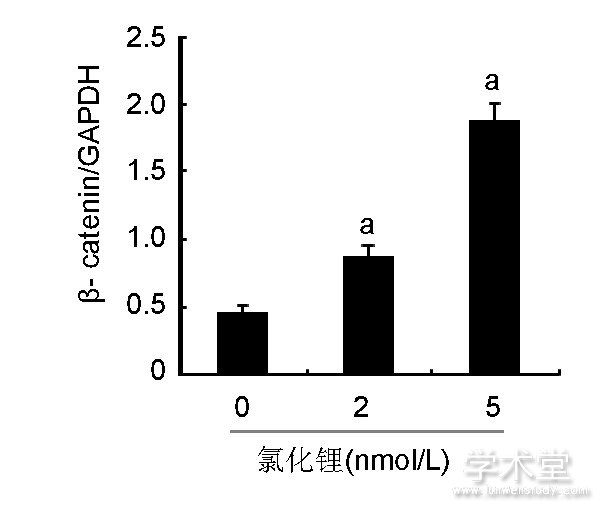
Figure 4 Expression of glycogen synthase kinase 3β, phosphorylated glycogen synthase kinase 3βandβ-catenin proteins in bone marrow mesenchymal stem cells
图注:与0 nmol/L氯化锂组比较, aP<0.05。
参考文献
[1] Phinney DG, Kopen G, Isaacson RL, et al. Plastic adherent stromal cells from the bone marrow of commonly used strains of inbred mice:variations in yield, growth, and differentiation.J Cell Biochem. 1999;72 (4) :570-585.
[2] Cohen MA, Markoulaki S, Jaenisch R. Matched Developmental Timing of Donor Cells with the Host Is Crucial for Chimera Formation. Stem Cell Reports. 2018;10 (5) :1445-1452.
[3] Ali EHA, Ahmed-Farid OA, sman AAE.Bone marrow-derived mesenchymal stem cells ameliorate sodium nitrite-induced hypoxic brain injury in a rat model.Neural Regen Res. 2017;12 (12) :1990-1999.
[4] Atashi F, Modarressi A, Pepper MS. The role of reactive oxygen species in mesenchymal stem cell adipogenic and osteogenic differentiation:a review. Stem Cells Dev. 2015;24 (10) :1150-1163.
[5]王皓沿, 海鑫.白藜芦醇对小鼠骨髓间充质干细胞成骨/成脂分化的影响[J].哈尔滨医科大学学报, 2018, 52 (2) :99-104.
[6] Yamaguchi M, Zhu S, Weitzmann MN, et al. Curcumin analog UBS109 prevents bone marrow osteoblastogenesis and osteoclastogenesis disordered by coculture with breast cancer MDA-MB-231 bone metastatic cells in vitro. Mol Cell Biochem. 2015;401 (1-2) :1-10.
[7] Azuma K, Zhou Q, Kubo KY. Morphological and molecular characterization of the senile osteoporosis in senescenceaccelerated mouse prone 6 (SAMP6) . Med Mol Morphol.2018;51 (3) :139-146.
[8] Abuna RP, Stringhetta-Garcia CT, Fiori LP, et al. Aging impairs osteoblast differentiation of mesenchymal stem cells grown on titanium by favoring adipogenesis. J Appl Oral Sci. 2016;24 (4) :376-382.
[9] Ghali O, Broux O, Falgayrac G, et al. Dexamethasone in osteogenic medium strongly induces adipocyte differentiation of mouse bone marrow stromal cells and increases osteoblast differentiation. BMC Cell Biol. 2015;16:9.
[10] Patel R, Rodriguez A, Yasmeen T, et al. Impact of Obesity on Osteoporosis:Limitations of the Current Modalities of Assessing Osteoporosis in Obese Subjects. Clinical Reviews in Bone and Mineral Metabolism. 2015;13 (1) :36-42.
[11] Li J, Liu X, Zuo B, et al. The Role of Bone Marrow Microenvironment in Governing the Balance between Osteoblastogenesis and Adipogenesis. Aging Dis. 2015;7 (4) :514-525.
[12]谢小伟, 裴福兴, 康鹏德, 等.锶盐联合淫羊藿苷对大鼠骨髓基质干细胞成骨及成脂分化影响的研究[J].中国矫形外科杂志, 2015, 23 (5) :450-457.
[13] Chen Y, Chen L, Yin Q, et al. Reciprocal interferences of TNF-αand Wnt1/β-catenin signaling axes shift bone marrow-derived stem cells towards osteoblast lineage after ethanol exposure. Cell Physiol Biochem. 2013;32 (3) :755-765.
[14]杨斌, 向萌娟.氯化锂诱导毛囊干细胞定向分化中Wnt信号通路介导基因的调控[J].中国组织工程研究与临床康复, 2011, 15 (49) :9202-9206.
[15] Wils J, Favre J, Bellien J. Modulating putative endothelial progenitor cells for the treatment of endothelial dysfunction and cardiovascular complications in diabetes. Pharmacol Ther. 2017;170:98-115.
[16] Esfandiari F, Fathi A, Gourabi H, et al. Glycogen synthase kinase-3 inhibition promotes proliferation and neuronal differentiation of human-induced pluripotent stem cell-derived neural progenitors. Stem Cells Dev. 2012;21 (17) :3233-3243.
[17] Huang J, Guo X, Li W, et al. Activation of Wnt/β-catenin signalling via GSK3 inhibitors direct differentiation of human adipose stem cells into functional hepatocytes. Sci Rep. 2017;7:40716.
[18] Zhang L, Chan C. Isolation and enrichment of rat mesenchymal stem cells (MSCs) and separation of single-colony derived MSCs. J Vis Exp. 2010; (37) :1852.
[19]聂义珍, 闫朝岐, 付红梅, 等.冷刺激对骨髓间充质干细胞增殖及成骨分化的影响[J].中华骨质疏松和骨矿盐疾病杂志, 2018, 11 (6) :577-583.
[20]李忠海.不同浓度锶对MC3T3-E1细胞增殖、ALP活性及成骨分化的影响[J].中国骨与关节杂志, 2016, 5 (3) :221-225.
[21]董冰子, 孙晓方.骨质疏松症治疗新进展:从分子机制到药物靶点[J].中华骨质疏松和骨矿盐疾病杂志, 2018, 11 (6) :620-627.
[22] Varela A, Chouinard L, Lesage E, et al. One Year of Abaloparatide, a Selective Activator of the PTH1 Receptor, Increased Bone Formation and Bone Mass in Osteopenic Ovariectomized Rats Without Increasing Bone Resorption. J Bone Miner Res. 2017;32 (1) :24-33.
[23] Song L, Liu M, Ono N, et al. Loss of wnt/β-catenin signaling causes cell fate shift of preosteoblasts from osteoblasts to adipocytes. J Bone Miner Res. 2012;27 (11) :2344-2358.
[24] Neth P, Ciccarella M, Egea V, et al. Wnt signaling regulates the invasion capacity of human mesenchymal stem cells.Stem Cells. 2006;24 (8) :1892-903.
[25]李理.新型氯化锂复合磷酸钙骨水泥对成骨细胞增殖及分化的影响[D].南宁:广西医科大学, 2016.
[26] Sieber MH, Thomsen MB, Spradling AC. Electron Transport Chain Remodeling by GSK3 during Oogenesis Connects Nutrient State to Reproduction. Cell. 2016;164 (3) :420-432.
[27] Weng J, Wang YH, Li M, et al.GSK3βinhibitor promotes myelination and mitigates muscle atrophy after peripheral nerve injury.Neural Regen Res. 2018;13 (2) :324-330.
[28] Desiderio V, Tirino V, Papaccio G, et al. Bone defects:molecular and cellular therapeutic targets. Int J Biochem Cell Biol. 2014;51:75-78.
[29] Kim do Y, Park EY, Chang E, et al. A novel miR-34a target, protein kinase D1, stimulates cancer stemness and drug resistance through GSK3/β-catenin signaling in breast cancer.Oncotarget. 2016;7 (12) :14791-14802.
[30] Li VS, Ng SS, Boersema PJ, et al. Wnt signaling through inhibition ofβ-catenin degradation in an intact Axin1 complex.Cell. 2012;149 (6) :1245-1256.





