摘 要: 背景:力生长因子在多种组织中表达, 能够促进多种组织细胞的增殖和迁移。目的:观察力生长因子对原代培养兔软骨细胞增殖和迁移的影响, 以及内在机制探讨。方法:取北京市维通利华实验动物技术有限公司提供的新西兰大白兔的膝关节软骨, 剪碎后, 采用酶消化法原代分离培养软骨细胞, 取处于对数生长期第3代细胞随机分5组, 分别以0, 1, 2, 4, 8μg/L力生长因子进行干预24, 48, 72 h。结果和结论:不同质量浓度的力生长因子均能促进兔软骨细胞的增殖和迁移, 且效应具有剂量依赖性, 当质量浓度为4μg/L时力生长因子促增殖和迁移的效应最大。且随着力生长因子质量浓度逐渐增加, 可明显增强兔软骨细胞中转化生长因子β1的表达, 刺激Smad2/3的磷酸化。提示力生长因子对原代培养兔软骨细胞具有促增殖和迁移的作用, 且具有剂量依赖性, 可能是通过激活转化生长因子β1/Smad信号通路得以实现的。
关键词: 软骨细胞; 力生长因子; 增殖; 迁移; 转化生长因子β1; 软骨细胞; 成骨细胞; 韧带细胞; 膝关节软骨;
Abstract: BACKGROUND: Mechano growth factor exists in a wide variety of tissues, and it can enhance the proliferation and migration of cells in different tissues. OBJECTIVE: To investigate the effect of mechano growth factor on the proliferation and migration of primary rabbit knee articular chondrocytes, and to explore the underlying mechanism. METHODS: Knee cartilage was shredded after being harvested from New Zealand white rabbits (provided by Beijing Vital River Laboratory Animal Technology Co., Ltd.) , and then chondrocytes were isolated and cultured by enzyme digestion. Passage 3 cells in logarithmic growth phase were harvested and divided into five groups, and then intervened by 0, 1, 2, 4 and 8 μg/L mechano growth factor for 24, 48 and 72 hours, respectively. RESULTS AND CONCLUSION: Mechano growth factor could promote the proliferation and migration of rabbit knee articular chondrocytes in a concentration-dependent manner, and mechano growth factor at 4 μg/L exhibited the strongest efficacy. Mechano growth factor could increase the expression of transforming growth factor β1 and phosphorylation of Smad2/3 with concentration increasing. In summary, mechano growth factor can promote the proliferation and migration of rabbit knee articular chondrocytes dose-dependently, which may be via the transforming growth factor β1/Smad signaling pathway.
Author: Zhao Hui, MD, Attending physician, Department of Orthopedics, Beijing Chao-Yang Hospital, Capital Medical University, Beijing 100020, China;
0引言
力生长因子是由胰岛素样生长因子基因编码的, 在组织或者细胞处于应激和损伤修复时, 通过对胰岛素样生长因子基因的mRNA进行剪接编码而翻译产生的选择性剪接变异体蛋白[1]。力生长因子可有效促进肌肉细胞的增殖, 诱导成肌细胞向肌管细胞的分化, 同样也可促进成骨细胞的增殖和诱导分化[2,3], 但是目前尚没有力生长因子对软骨细胞作用的文章报道。
膝关节软骨是一种透明软骨, 是由蛋白多糖组成的细胞外基质和紧密的胶原网络构成的, 对机械载荷具有高度抗性, 但是关节软骨的损伤修复能力很差, 同时由于其位置比较特殊, 如何才能更好地修复关节软骨以最大限度恢复临床患者的功能, 是骨科医生和组织工程师所面临的挑战[4,5]。

为了观察力生长因子对软骨细胞增殖和迁移的影响, 作者采用不同质量浓度的力生长因子处理原代培养兔膝关节软骨细胞, 并对其增殖和迁移情况进行检测, 同时评估其对转化生长因子β1/Smad信号通路的影响。
1材料和方法Materials and methods
1.1设计随机对照动物实验。
1.2时间及地点实验于2017年3月至2018年3月在河北省廊坊市蓝梦科技有限公司完成。
1.3材料
实验动物:雄性清洁级新西兰白兔1只, 兔龄3周, 体质量2.13 kg, 购自北京市维通利华实验动物技术有限公司, 动物许可证号SYXK京2016-0035。实验方案中有关动物伦理问题已经得到首都医科大学附属北京朝阳医院动物伦理学委员会的批准, 批准号:2017-科-13。
实验用主要试剂及仪器:力生长因子购自美国Phoenix Pharmaceuticals公司, 胎牛血清、DMEM培养基、胰蛋白酶、Ⅱ型胶原酶购自美国Gibco公司, CCK-8购自北京天恩泽基因科技有限公司, 转化生长因子β1抗体、Beta-actin抗体 (购自美国Abcam公司, Smad2/3抗体、P-Smad3抗体购自美国Santa Cruz公司, 荧光倒置显微镜购自日本Nikon公司, i MAX酶标仪购自美国Bio-Rad公司,
1.4方法
1.4.1软骨细胞的分离与培养耳缘静脉空气针注射空气栓塞法处死新西兰大白兔, 局部备皮, 碘酒消毒后, 无菌条件下打开膝关节, 用剪刀小心地切除兔的膝关节, 并使用镊子收集软骨组织, 充分漂洗后, 并将其剪碎至1 mm3大小, 置于含有体积分数10%胎牛血清的DMEM培养基中进行培养, 荧光倒置显微镜观察原代细胞从软骨组织中的爬出生长情况, 在培养的第3天更换培养基, 并维持组织碎片以允许更多的软骨细胞长出, 待细胞增殖至瓶底80%左右时, 弃培养基及组织碎屑, PBS反复冲洗3次, 0.25%胰蛋白酶及0.2%Ⅱ型胶原酶消化后, 应用含有体积分数10%胎牛血清的DMEM培养基进行传代培养[6,7,8]。
1.4.2力生长因子对软骨细胞增殖的影响取对数生长期的3代软骨细胞, 常规消化离心后, 用含有体积分数10%胎牛血清和1%青霉素-链霉素的DMEM培养液稀释并计数成5×106 L-1后, 然后以每孔200μL接种于96孔板中, 置于37℃体积分数5%CO2培养箱中培养, 12 h后软骨细胞贴壁, 将接种细胞的培养孔随机分为5组, 分别加入含有0, 1, 2, 4, 8μg/L的力生长因子的标准DMEM培养基, 每组设5个复孔, 37℃体积分数5%CO2培养箱分别孵育24, 48, 72 h后, 每孔加入10μL CCK-8, 孵育1 h后终止培养, 吸去培养液, 于iMAX酶标仪检测450 nm处吸光度值, 实验至少重复3次[9,10,11]。结果以测试孔与对照孔的吸光度比值表示。
1.4.3力生长因子对软骨细胞迁移的影响首先应用划痕实验检测力生长因子对软骨细胞迁移的影响, 将软骨细胞以6×107 L-1的细胞浓度接种在6孔板中。培养24 h后, 分别加入100μL含有0, 1, 2, 4, 8μg/L的力生长因子的标准DMEM培养基, 并培养直至细胞聚合用于随后的实验。通过刮擦塑料移液管的尖端来制造伤口。同以PBS洗涤2次, 然后将细胞与完全生长培养基一起温育。当细胞迁移到受损的空白区域时, 分别在培养24 h时取出细胞, 显微镜观察并测量划痕的宽度, 并拍摄照片。
进一步应用具有8.0μm孔径膜的Transwell小室进行迁移实验, 用以检测力生长因子对软骨细胞迁移的影响。选取对数生长期的软骨细胞, 并用含有0, 1, 2, 4, 8μg/L力生长因子的无血清DMEM培养液将细胞浓度调整为5×107 L-1。然后加入上室内, 将600μL含有体积分数10%胎牛血清的培养基加入下室中。37℃体积分数5%CO2培养箱分别孵育3 h后, 将附着在底部的细胞用40 g/L多聚甲醛固定30 min, 并0.1%结晶紫染色15 min, 并在每孔4个随机选择的400倍视野中进行观察, 计数染色的细胞[12]。1.4.4 Western blot检测转化生长因子β1/Smad信号通路的变化选取对数生长期的软骨细胞以5×105/孔接种在六孔板中, 加入含有0, 1, 2, 4, 8μg/L力生长因子的培养基, 培养48 h后, 收集细胞, 并使用含有蛋白酶抑制剂的裂解缓冲液 (150 mmol/L NaCl, 50 mmol/L Tris-HCl, pH7.4的2 mmol/L EDTA, 1%NP-40) 在培养皿中进行裂解, 然后通过Bradford方法定量总细胞蛋白质。将等量的总蛋白质 (每泳道50-100μg) 在12%SDS-PAGE中电泳, 后电转移至硝酸纤维素膜上, 在室温下用8%无脂奶粉将膜封闭2 h, 并在4℃下与一抗孵育过夜。在PBS-Tween 20中洗涤3×15 min后, 将膜用辣根过氧化物酶结合的二抗在室温下孵育1 h。在PBS-Tween 20中再次洗涤膜, 化学发光法检测蛋白表达[13]。
1.5主要观察指标软骨细胞增殖、迁移以及β1/Smad信号通路的表达变化。
1.6统计学分析所有数据均采用SPSS 13.0统计软件 (美国SPSS公司) 进行分析, 重复测量用于分析增殖实验结果, 单因素方差分析用于分析迁移实验结果, Student's t检验用于组间比较分析。数据表示为x_±s。P<0.05为差异有显着性意义。
2结果Results
2.1兔膝关节软骨细胞的形态兔软骨细胞原代培养24 h后, 逐渐有软骨细胞从滑膜组织中爬出, 见图1A, 并贴壁生长, 形态呈现不规则多边形, 培养72 h后, 细胞增殖明显增多, 并逐渐铺满培养瓶, 见图1B, 传代培养后软骨细胞生长速度明显加快, 见图1C, 每96 h传代一次, 使用第3代细胞用于后续实验。
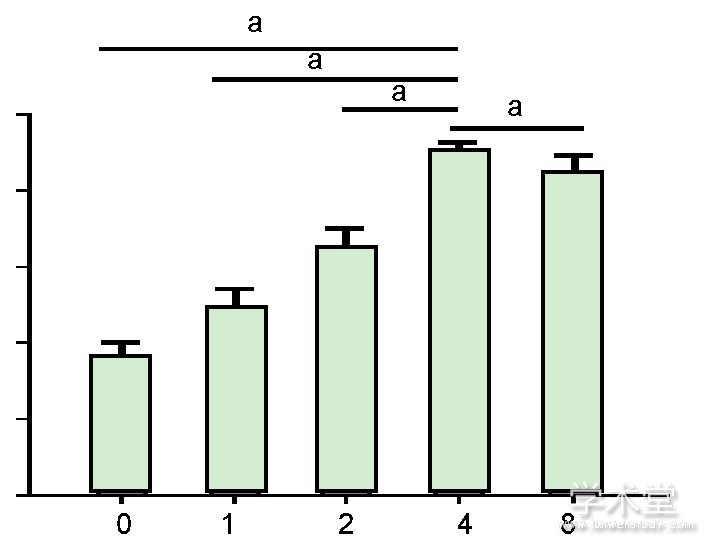
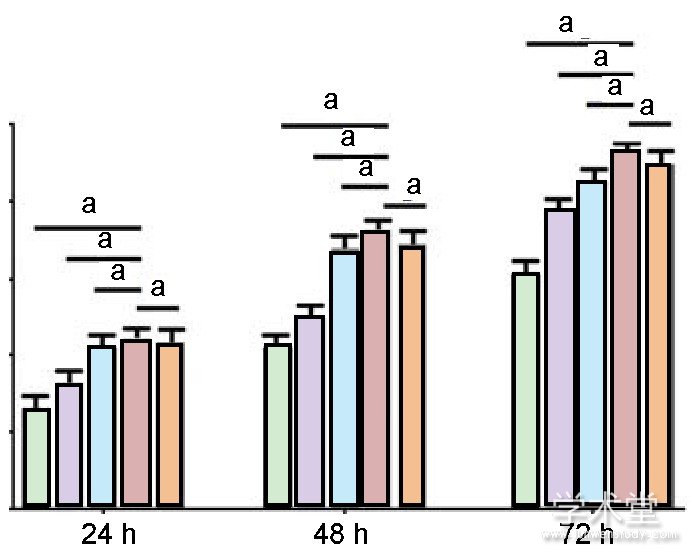
2.2力生长因子促进兔软骨细胞的增殖CCK-8检测结果显示, 力生长因子可以促进兔软骨细胞的增殖, 且随着力生长因子质量浓度的增加, 而细胞增殖逐渐增强。当力生长因子质量浓度达到4μg/L时, 其促进增殖的作用最强 (P<0.05) , 见图2。
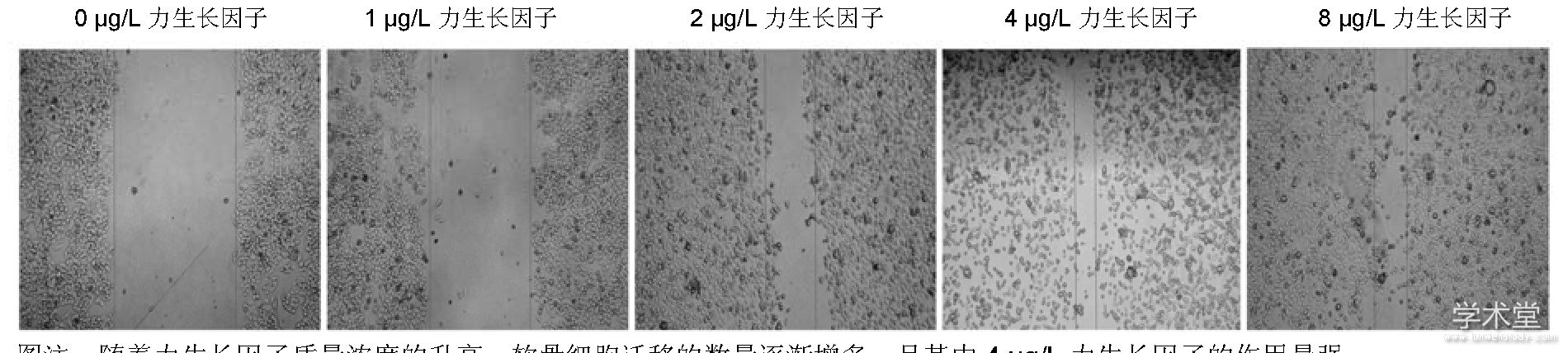
2.3力生长因子促进兔软骨细胞的迁移划痕实验发现, 随着力生长因子质量浓度的升高, 软骨细胞迁移的数量逐渐增多, 见图3。迁移实验也得到相似的数据, 细胞计数发现随着力生长因子质量浓度的增加, 其促迁移的作用逐渐增强, 在质量浓度为4μg/L时, 迁移的细胞数目最多 (P<0.05) , 见图4, 5。
2.4力生长因子激活转化生长因子β1/Smad信号通路Western blot检测结果显示, 随着力生长因子质量浓度逐渐增加, 转化生长因子β1和磷酸化的Smad2/3表达水平逐渐增加, 而Smad2/3表达水平没有明显变化。提示力生长因子可以增强转化生长因子β1的表达, 同时刺激Smad2/3的磷酸化, 见图6。
3讨论Discussion
力生长因子是一种自分泌和内分泌的生长因子, 是一种胰岛素样生长因子1的一类剪接变异体, 其在许多组织中表达[1]。以往的研究报道, 力生长因子可以调节多种类型组织的增殖、分化和迁移, 可以在应激条件下对机体发挥保护作用。然而, 力生长因子发挥其功能的分子机制尚不完全清楚。此外, 力生长因子对软骨细胞作用的相关研究也不多[1,2,3]。
关节软骨属于透明软骨, 在关节中起负重和运动缓冲的作用, 关节软骨内没有血管和神经支配, 不同于其他组织, 维持关节软骨的营养主要依赖于关节滑液的渗透交换作用, 这些特征导致了关节软骨损伤后其自身修复的机会很小, 关节软骨一旦遭到破坏, 易发生不可逆的病理改变, 再生十分困难[4,5]。如果发生关节软骨损伤, 如何最大限度的修复软骨以恢复患者的关节功能, 是创伤骨科和运动医学科医生永恒不变的话题。
目前研究显示, 力生长因子可以促进多种细胞的增殖和迁移, 但是在不同组织和种属中, 力生长因子促增殖和迁移的效应质量浓度是不一样的, 力生长因子在50μg/L时可以促进人前列腺癌细胞增殖[14], 力生长因子在3μg/L时可以促进小鼠成骨细胞的增殖和迁移且具有最大作用效应[15], 而在猪卫星细胞, 力生长因子为1.5μg/L时达到最大的促增殖和迁移的作用效应[16]。在人软骨椎板干细胞, 力生长因子为4.5μg/L时达到最大的促增殖和迁移的作用效应[17]。作者首次应用力生长因子对兔膝关节原代培养的软骨细胞进行增殖和迁移效应的研究, 发现力生长因子可以有效促进兔软骨细胞的增殖和迁移, 而且随着质量浓度的增加, 其作用也随之增强, 当力生长因子质量浓度达到4μg/L时, 其作用效能达到最大, 随后效能逐渐降低。其中8μg/L的作用效能低于4μg/L, 推测可能达到最大效应质量浓度后, 再增加力生长因子质量浓度反而有一个剂量抑制作用。
为了研究力生长因子调节增殖和迁移的调控机制, 应用Western blot分析了转化生长因子β1/Smad信号通路, 发现随着力生长因子质量浓度的升高, 转化生长因子β1的表达水平, 和磷酸化Smad3水平逐渐升高, 力生长因子质量浓度为4μg/L时候, 转化生长因子β1和磷酸化Smad3水平达到最高, 而力生长因子质量浓度为8μg/L时候, 转化生长因子β1和磷酸化Smad3水平反而比力生长因子质量浓
图注:图中A为培养24 h的兔软骨细胞, B为培养72 h的兔软骨细胞, C为第3代的兔软骨细胞。软骨细胞均呈不规则多边形。图1原代培养兔软骨细胞的形态 (倒置显微镜, ×100)
Figure 1 Morphology of primary rabbit chondrocytes (inverted contrast microscope, ×100)
图注:4μg/L力生长因子的促进增殖作用最强。aP<0.05。图2不同质量浓度力生长因子对兔软骨细胞增殖的影响
Figure 2 Effect of different concentrations of mechano growth factor on the proliferation of rabbit chondrocytes
图注:随着力生长因子质量浓度的升高, 软骨细胞迁移的数量逐渐增多, 且其中4μg/L力生长因子的作用最强。图3不同质量浓度力生长因子对软骨细胞划痕实验的影响 (倒置显微镜, ×40)
Figure 3 Effect of different concentrations of mechano growth factor on scratch test of rabbit chondrocytes (inverted contrast microscope, ×40)
图注:随着力生长因子质量浓度的增加, 其促迁移的作用逐渐增强, 且其中4μg/L力生长因子的作用最强。图4不同质量浓度力生长因子对兔软骨细胞迁移的影响 (倒置显微镜, ×400)
Figure 4 Effect of different concentrations of mechano growth factor on the migration of rabbit chondrocytes (inverted contrast microscope, ×400)
图注:Transwell小室检测显示质量浓度达到4μg/L力生长因子时, 兔软骨细胞迁移数量最多。aP<0.05。
图5不同质量浓度力生长因子对兔软骨细胞迁移数量的影响Figure 5 Effect of different concentrations of mechano growth factor on the number of migrated rabbit chondrocytes
图6不同质量浓度力生长因子对兔软骨细胞转化生长因子β1/Smad信号通路的影响
Figure 6 Effect of different concentrations of mechano growth
factor on transforming growth factorβ1/Smad signaling pathway in rabbit chondrocytes
0 1 2 4 8
力生长因子质量浓度 (μg/L)
转化生长因子β1
Smad2/3
p-Smad3
Beta-actin
100806040200
) 野视倍00/4 (n量数胞细移迁
1.00.80.60.40.20
值比值度光吸
0μg/L1μg/L2μg/L4μg/L8μg/L
培养时间
力生长因子质量浓度 (μg/L)



度为4μg/L时候略低, 同时力生长因子质量浓度的变化对Smad2和Smad3的本底表达水平没有影响, 说明力生长因子可以活化转化生长因子β1/Smad信号通路, 促进Smad3的磷酸化, 从而激活下游的增殖和迁移相关的后续细胞表观事件的发生, 同时当质量浓度为8μg/L时候, 反而促增殖和迁移效应下降, 说明还有其他的调节机制对其进行反向作用, 需要进一步的研究。
对于力生长因子分子是如何调节组织的损伤修复以及骨骼肌肉组织的增殖的机制, 目前的研究虽然有一定的发现, 但整体来说尚不清楚[18]。力生长因子属于胰岛素样生长因子家族衍生分子, 通常认为力生长因子在细胞内的转导通路是通过与细胞膜上的胰岛素样生长因子受体结合, 激活细胞内相关通路, 引发生物学效应[19,20,21]。然而, 在以往的动物实验和细胞实验中, 发现通过机械应力的加强, 可以导致外周肌肉组织中力生长因子表达水平升高, 而在其他动物实验中发现增加动物血浆中力生长因子水平, 却没有发现明显的肌肉和骨骼刺激生长, 说明力生长因子除了和胰岛素样生长因子经典受体结合以外, 可能还存在其他的细胞内信号激活途径[22,23,24,25,26,27,28,29]。胰岛素样生长因子的活性具有生长激素依赖性, 而研究表明力生长因子则没有生长激素依赖性。进一步说明了力生长因子存在着不同于胰岛素样生长因子的信号转导途径[30]。细胞内信号的激活, 最终的表现是不同的转录因子作用于基因组上顺式作用元件上, 影响染色体上相关的基因转录, 从而导致不同生物学效应的发生。力生长因子作用于效应细胞, 是如何激活相关基因转录表达的呢?它在细胞内会发生什么故事呢?目前的研究还远不能进行解释。
实验结果证实了力生长因子对兔软骨细胞具有促增殖和迁移的作用, 且具有剂量依赖性, 当质量浓度为4μg/L时可以达到最大作用效应, 同时会对转化生长因子β1/Smad信号通路, 上调转化生长因子β1的表达水平, 促进Smad2/3的磷酸化, 而对Smad2和Smad3的本底表达水平没有影响。这一研究结果对于力生长因子相关软骨修复研究打下基础, 也为临床软骨修复提供一个可能的潜在选择。
作者贡献:实验设计为赵会和周君琳, 实验实施为赵会、杨铁军、李一汉, 实验评估为郭蒙。赵会成文, 杨铁军审校, 赵会对文章负责。
经费支持:该文章接受了“国家自然科学基金项目 (81202124) ”、“北京市医院管理局“青苗”计划 (QML20160302) ”的资助。所有作者声明, 经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
利益冲突:文章的全部作者声明, 在课题研究和文章撰写过程, 没有因其岗位角色影响文章观点和对数据结果的报道, 不存在利益冲突。
机构伦理问题:实验过程中对动物的处置符合2009年《Ethical issues in animal experimentation》相关动物伦理学标准的条例, 实验方案中有关动物伦理问题已经得到首都医科大学附属北京朝阳医院动物伦理学委员会的批准。
文章查重:文章出版前已经过专业反剽窃文献检测系统进行3次查重。
文章外审:文章经小同行外审专家双盲外审, 同行评议认为文章符合期刊发稿宗旨。
生物统计学声明:本文统计学方法已经首都医科大学附属北京朝阳医院生物统计学专家审核。
文章版权:文章出版前杂志已与全体作者授权人签署了版权相关协议。
开放获取声明:这是一篇开放获取文章, 根据《知识共享许可协议》“署名-非商业性使用-相同方式共享4.0”条款, 在合理引用的情况下, 允许他人以非商业性目的基于原文内容编辑、调整和扩展, 同时允许任何用户阅读、下载、拷贝、传递、打印、检索、超级链接该文献, 并为之建立索引, 用作软件的输入数据或其他任何合法用途。

文题释义:
力生长因子:是由胰岛素样生长因子基因编码的, 在组织或者细胞处于应激和损伤修复时, 通过对m RNA进行剪接编码而翻译产生的选择性剪接变异体蛋白, 力生长因子可以有效促进肌肉细胞增殖, 诱导成肌细胞向肌管细胞分化, 同样也可以促进成骨细胞和韧带细胞的增殖和诱导分化。
转化生长因子β1/Smad信号通路:转化生长因子β1信号通路参与生物体细胞的生长和分化过程, 包括细胞生长、细胞分化、细胞凋亡、细胞动态平衡等其他细胞功能。转化生长因子β1信号通路过程是:相关信号因子与Ⅱ型受体结合, Ⅱ型受体招募并磷酸化Ⅰ型受体, Ⅰ型受体再磷酸化受体调控的SMAD蛋白, 这些蛋白再与SMAD4结合。再磷酸化受体调控的SMAD蛋白/SMAD4复合体作为转录因子在细胞核内聚集, 参与目标基因表达的调控。
参考文献:
[1] Matheny RW Jr, Nindl BC, Adamo ML.Minireview:Mechano-growth factor:a putative product of IGF-I gene expression involved in tissue repair and regeneration.Endocrinology.2010;151 (3) :865-875.
[2] Philippou A, Maridaki M, Halapas A, et al.The role of the insulin-like growth factor 1 (IGF-1) in skeletal muscle physiology.In Vivo.2007;21 (1) :45-54.
[3] Goldspink G.Mechanical signals, IGF-I gene splicing, and muscle adaptation.Physiology (Bethesda) .2005;20:232-238.
[4] Varela-Eirin M, Loureiro J, Fonseca E, et al.Cartilage regeneration and ageing:Targeting cellular plasticity in osteoarthritis.Ageing Res Rev.2018;42:56-71.
[5] Loeser RF, Collins JA, Diekman BO.Ageing and the pathogenesis of osteoarthritis.Nat Rev Rheumatol.2016;12 (7) :412-420.
[6] Kobayashi T, Fujita K, Kamatani T, et al.A-674563 increases chondrocyte marker expression in cultured chondrocytes by inhibiting Sox9 degradation.Biochem Biophys Res Commun.2018;495 (1) :1468-1475.
[7] Ma N, Wang H, Xu X, et al.Autologous-cell-derived, tissue-engineered cartilage for repairing articular cartilage lesions in the knee:study protocol for a randomized controlled trial.Trials.2017;18 (1) :519.
[8] Karaarslan N, Batmaz AG, Yilmaz I, et al.Effect of naproxen on proliferation and differentiation of primary cell cultures isolated from human cartilage tissue.Exp Ther Med.2018;16 (3) :1647-1654.
[9] Chen JJ, Zhang W.High expression of WWP1 predicts poor prognosis and associates with tumor progression in human colorectal cancer.Am J Cancer Res.2018;8 (2) :256-265.
[10] David E, Tirode F, Baud'huin M, et al.Oncostatin M is a growth factor for Ewing sarcoma.Am J Pathol.2012;181 (5) :1782-1795.
[11] Kung LH, Rajpar MH, Briggs MD, et al.Hypertrophic chondrocytes have a limited capacity to cope with increases in endoplasmic reticulum stress without triggering the unfolded protein response.J Histochem Cytochem.2012;60 (10) :734-748.
[12] Peng C, Zhao H, Song Y, et al.SHCBP1 promotes synovial sarcoma cell metastasis via targeting TGF-β1/Smad signaling pathway and is associated with poor prognosis.J Exp Clin Cancer Res.2017;36 (1) :141.
[13] Zhao H, Peng C, Ruan G, et al.Adenovirus-delivered PDCD5counteracts adriamycin resistance of osteosarcoma cells through enhancing apoptosis and inhibiting Pgp.Int J Clin Exp Med.2014;7 (12) :5429-5436.
[14] Armakolas A, Philippou A, Panteleakou Z, et al.Preferential expression of IGF-1Ec (MGF) transcript in cancerous tissues of human prostate:evidence for a novel and autonomous growth factor activity of MGF E peptide in human prostate cancer cells.Prostate.2010;70 (11) :1233-1242.
[15] Deng M, Zhang B, Wang K, et al.Mechano growth factor Epeptide promotes osteoblasts proliferation and bone-defect healing in rabbits.Int Orthop.2011;35 (7) :1099-1106.
[16] Qin LL, Li XK, Xu J, et al.Mechano growth factor (MGF) promotes proliferation and inhibits differentiation of porcine satellite cells (PSCs) by down-regulation of key myogenic transcriptional factors.Mol Cell Biochem.2012;370 (1-2) :221-230.
[17] 李元靖, 刘欢, 樊欣, 等.MGF对人软骨终板干细胞增殖和迁移的影响[J].中国细胞生物学学报, 2015, 37 (3) :335-342.
[18] Sha Y, Yang L, Lv Y.ERK1/2 and Akt phosphorylation were essential for MGF E peptide regulating cell morphology and mobility but not proangiogenic capacity of BMSCs under severe hypoxia.Cell Biochem Funct.2018;36 (3) :155-165.
[19] Zhang B, Luo Q, Sun J, et al.MGF enhances tenocyte invasion through MMP-2 activity via the FAK-ERK1/2 pathway.Wound Repair Regen.2015;23 (3) :394-402.
[20] Luo Z, Jiang L, Xu Y, et al.Mechano growth factor (MGF) and transforming growth factor (TGF) -β3 functionalized silk scaffolds enhance articular hyaline cartilage regeneration in rabbit model.Biomaterials.2015;52:463-475.
[21] Li C, Vu K, Hazelgrove K, et al.Increased IGF-IEc expression and mechano-growth factor production in intestinal muscle of fibrostenotic Crohn's disease and smooth muscle hypertrophy.Am J Physiol Gastrointest Liver Physiol.2015;309 (11) :G888-899.
[22] Jing X, Ye Y, Bao Y, et al.Mechano-growth factor protects against mechanical overload induced damage and promotes migration of growth plate chondrocytes through RhoA/YAPpathway.Exp Cell Res.2018;366 (2) :81-91.
[23] He J, Dong L, Xu K, et al.Mechano growth factor E peptide inhibits invasion of melanoma cells and up-regulates CHOPexpression via endoplasmic reticulum stress.Biotechnol Lett.2018;40 (1) :205-213.
[24] Li H, Lei M, Yu C, et al.Mechano growth factor-E regulates apoptosis and inflammatory responses in fibroblast-like synoviocytes of knee osteoarthritis.Int Orthop.2015;39 (12) :2503-2509.
[25] Tong Y, Feng W, Wu Y, et al.Mechano-growth factor accelerates the proliferation and osteogenic differentiation of rabbit mesenchymal stem cells through the PI3K/AKTpathway.BMC Biochem.2015;16:1.
[26] Deng M, Liu P, Xiao H, et al.Improving the osteogenic efficacy of BMP2 with mechano growth factor by regulating the signaling events in BMP pathway.Cell Tissue Res.2015;361 (3) :723-731.
[27] Luo Q, Wu K, Zhang B, et al.Mechano growth factor Epeptide promotes rat bone marrow-derived mesenchymal stem cell migration through CXCR4-ERK1/2.Growth Factors.2015;33 (3) :210-219.
[28] Zhang B, Luo Q, Mao X, et al.A synthetic mechano-growth factor E peptide promotes rat tenocyte migration by lessening cell stiffness and increasing F-actin formation via the FAK-ERK1/2 signaling pathway.Exp Cell Res.2014;322 (1) :208-216.
[29] Zhang B, Luo Q, Chen Z, et al.Increased nuclear stiffness via FAK-ERK1/2 signaling is necessary for synthetic mechano-growth factor E peptide-induced tenocyte migration.Sci Rep.2016;6:18809.
[30] Davies OG, Liu Y, Player DJ, et al.Defining the Balance between Regeneration and Pathological Ossification in Skeletal Muscle Following Traumatic Injury.Front Physiol.2017;8:194.





