摘 要: 目的 探讨外周血造血干细胞在体外转化为肝样干细胞的诱导条件。方法 选取自愿行造血干细胞移植符合入选标准患者, 用血细胞分离机采集经粒细胞集落刺激因子 (recombinant human granulocytecolony stimulating factor, G-CSF) +化疗药物动员后患者的外周血单个核细胞, 通过流式细胞仪及免疫磁珠法筛选出CD34+的单个核细胞。将CD34+的单个核细胞分为对照组、肝细胞生长因子 (hepatic growth factor, HGF) 组、成纤维细胞生长因子4 (fibroblast growth factor, FGF4) 组、FGF4+HGF组、HGF+FGF4+巨噬细胞集落刺激因子 (macrophage colony stimulating factor, MCSF) 组。动态观察细胞形态学变化, 15 d后免疫细胞化学检测Oct4、ALB、AFP、c-Kit、CK19及CD34在各组细胞中的表达。结果 HGF+FGF4+MCSF组:见大量类圆形细胞, 贴壁生长, 核仁明显, 核质比例大, 部分细胞串珠样生长; FGF4+HGF组:见少量类圆形细胞, 余细胞形变明显;对照组、HGF组、FGF4组:仅个别细胞呈类圆形, 大部分死亡。HGF+FGF4+MCSF组:Oct4、c-Kit、CK19、CD34阳性表达, AFP弱阳性, ALB阴性; FGF4+HGF组:细胞AFP、ALB阳性表达, CK19、CD34弱阳性表达, Oct4、c-Kit阴性;对照组、HGF组、FGF4组:检测指标均无表达。结论 经HGF、FGF4及MCSF联合诱导后的外周血CD34+单个核细胞更易转化为肝样干细胞。
关键词: 外周血干细胞; 肝样干细胞; 诱导分化;

Abstract: Objective To investigate the optimal conditions for the differentiation of peripheral blood hematopoietic stem cells into hepatic stem cell-like cells in vitro. Methods The patients with autologous peripheral blood stem cell transplantation in our hospital were selected as the research objects. The patients' peripheral blood mononuclear cells after the mobilization with rh G-CSF (recombinant human granulocyte-colony stimulating factor) + chemotherapeutic drugs were collected by blood cell separator, and the levels of CD34+were detected by flow cytometry, and the CD34+cells were purified. The CD34+cells were divided into 5 groups: control group, HGF (hepatic growth factor) group, FGF4 (fibroblast growth factor) group, FGF4 + HGF group and HGF + FGF4 + MCSF (recombinant human macrophage colony stimulating factor) group. The morphological changes of cells were observed dynamically.The expressions of Oct4, ALB, AFP, c-Kit, CK19 and CD34 were detected with immunofluorescence to identify the characters of the differentiated cells after the cells were cultured for 15 days. Results In the HGF + FGF4 + MCSF group: a large number of round cells, adherent growth, nucleolus obvious, large proportion of nucleus to cytoplasm, part of the cell bead-like growth. In the FGF4 + HGF group: a small number of round cells, others deformed significantly. In the control group, HGF group and FGF4 group: except for individual round cells, most cells died. In the HGF + FGF4 + MCSF group: positive expressions in Oct4, c-Kit, CK19 and CD34, weak positive expression in AFP and negative expression in ALB. In the FGF4 + HGF group: positive expressions in AFP and ALB, weak positive expressions in CK19 and CD34, and negative expressions in Oct4 and c-Kit. In the control group, HGF group and FGF4 group: all of the above indicators were not expressed. Conclusion The combination of HGF, FGF4 and MCSF shows obvious advantages in inducing peripheral blood stem cells to differentiate into hepatic stem cell-like cells.
Keyword: Peripheral blood stem cell; Hepatic stem cell-like cells; Induction differentiation;
肝癌在我国男性发病率、癌性死亡率中均居于第二位, 在肝癌多学科综合治疗中, 肝癌的靶向治疗载体一直是研究的热点与难点[1,2]。肝样干细胞有向肝癌细胞定向迁移的生物学特性, 被认为是较好的细胞载体, 可携带目的基因用于肝癌的靶向治疗, 但目前肝样干细胞来源、数量仍是迫切需要解决的问题[3]。骨髓来源的造血干细胞、骨髓间充质干细胞、脐血干细胞可在体外特殊诱导条件下转分化为肝样干细胞[4,5]。此外, 干细胞也越来越多地用于终末期肝病的治疗[6~8]。本研究拟对外周血CD34+细胞向肝样干细胞转化的诱导条件、诱导后标记物的表达进行初步探讨。
1、 材料与方法
1.1、 主要试剂与仪器
人造血干细胞培养基 (Gibco公司, 美国) ;RPMI1640 (Gibco) ;多聚甲醛 (国药集团, 80096618) ;澳洲胎牛血清 (Gibco) ;荧光 (Cy3) 标记羊抗兔IgG、浓缩型山羊血清购自武汉博士德公司;DAPI、Triton X-100购自碧云天生物技术研究所;抗Oct4、c-Kit、AFP、ALB、CK19、CD34抗体购自Abcam公司 (美国) ;rhG-CSF、巨噬细胞集落刺激因子 (macrophage colony stimulating factor, MCSF) 购自北京四环生物制药公司;人淋巴细胞分离液 (索莱宝, P8610) ;荧光显微镜 (奥林巴斯BX53荧光显微镜) 。肝细胞生长因子 (hepatic growth factor, HGF) 、成纤维细胞生长因子4[fibroblast growth factor, FGF4 (Prospec公司, 以色列) ];环磷酰胺 (江苏恒瑞医药公司) ;替尼泊苷 (意大利Bristol-Myers Squibb S.r.l) ;顺铂 (南京制药厂有限公司) ;“The Big Easy”Easy SepTM Magnet (STEMCELL Technologies, 加拿大) ;CD34+细胞免疫磁珠分选试剂盒 (STEMCELL Technologies, 加拿大) ;血细胞分离机 (Baxter, 美国) ;BD FACS-Calibur流式细胞仪 (BD公司, 美国) 。
1.2、 外周血来源
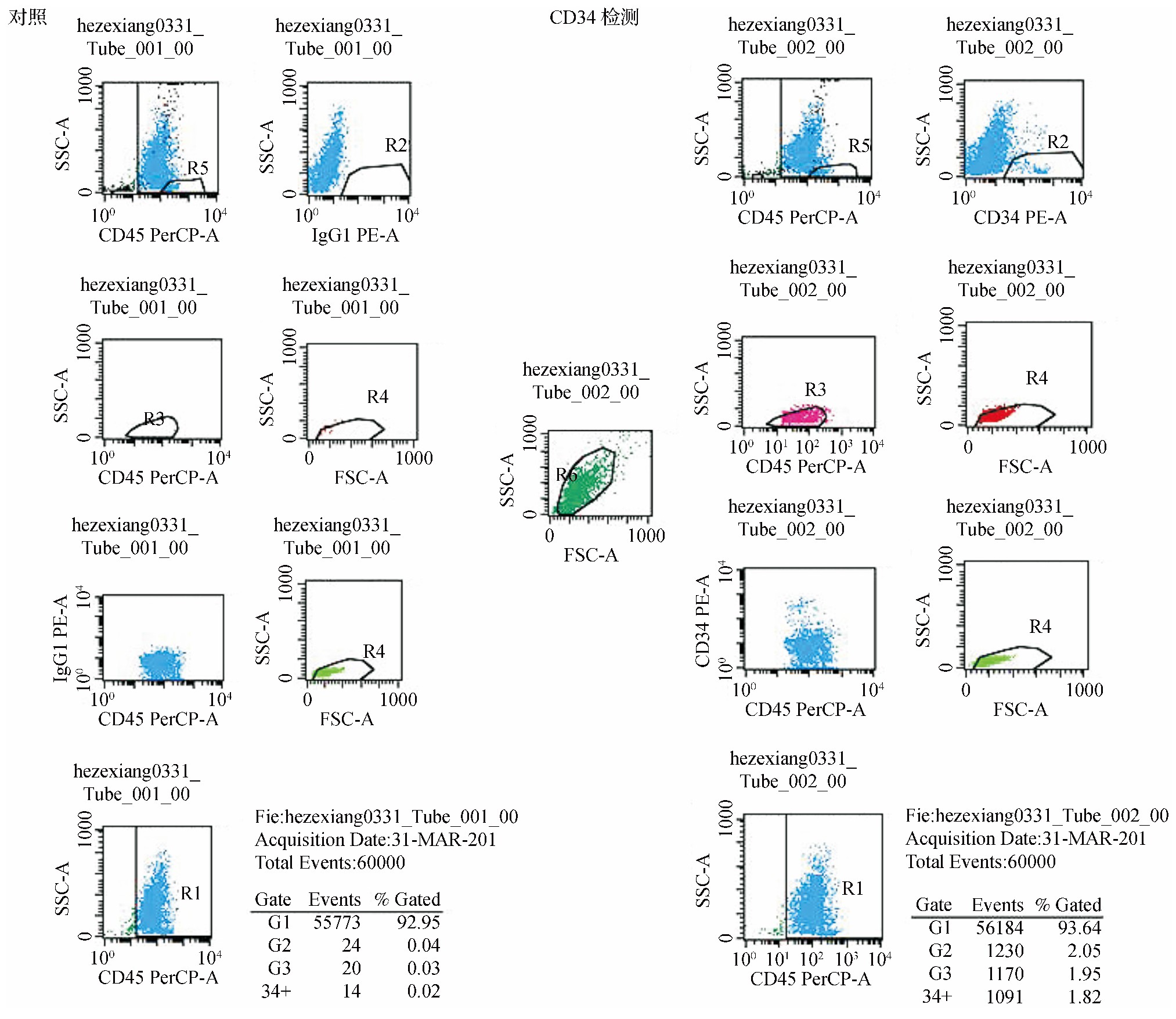
外周造血干细胞由非霍奇金淋巴瘤 (non-Hodgkin lymphoma, NHL) 患者中自愿行自体外周血造血干细胞移植者提供[9,10]。经广西壮族自治区人民医院伦理委员会批准, 血液风湿免疫科协助, 患者病理检查确诊为NHL, 年龄25~57岁, 一般状况可, 能耐受放化疗, 患者及家属自愿行自体外周血造血干细胞移植, 向患者及家属告知临床研究相关操作过程、风险等, 并签署知情同意书, 经CEP (环磷酰胺、替尼泊苷及顺铂) +rhG-CSF动员, 待外周血白细胞由最低点开始回升至对数生长时 (约≥5×109/L) 用血细胞分离机连续采集外周血单个核细胞。用流式细胞仪分析测定CD34+细胞百分比, 并经免疫磁珠筛选技术筛选出CD34+的单个核细胞 (见图1) 。
1.3、 造血干细胞分离
取外周血3 ml, 加入2 ml RPMI 1640混匀, 取5 ml人外周血淋巴细胞分离液加入15 ml离心管, 将混匀后的外周血平铺到外周血淋巴细胞分离液上, 室温下2 500 r/min离心25 min, 液体分为4层, 最上层为血浆和血小板, 第二层为白膜层, 主要为单个核细胞, 第三层为分离液, 底层为粒细胞及红细胞层, 取第2层白膜层, 主要成分为单个核细胞, RPMI1640洗涤两次备用。
1.4、 外周血CD34+细胞纯化
取RPMI 1640 5 ml重悬分离后的白膜层单个核细胞, 1 000 r/min离心弃去上清液;用含2%FBS及1 m M EDTA (292.248 g/mol) 的PBS制备浓度为5×108个/ml的单细胞悬液5 ml, 放置于14 ml专用的的聚苯乙烯试管中, 加入500μl的Easy Sep正选抗体混合物, 混合均匀, 室温孵育15 min, 加入250μl磁珠, 用移液器上下吹打EasySep纳米磁珠10次, 以确保磁珠悬液混合均匀, 室温下孵育10 min, 轻轻上下吹打细胞悬液, 将试管在磁极中放置10 min, 拿起EasySep磁极, 弃去上清液, 取出磁极中试管, 加入5 ml含2%FBS及1mEDTA的PBS, 再次吹打细胞, 混匀后将试管重新放回磁极中10 min, 重复最后两步后用5 ml含2%FBS及1 m M EDTA的PBS重悬细胞, 1 000 r/min离心后用造血干细胞专用培养基重悬, 移至37℃、5%CO2培养箱培养2 h, 弃掉上清液, 得到贴壁CD34+细胞备用。
1.5、 实验分组
外周血CD34+细胞接种到12孔板, 2×106个/孔, 后将其分为对照组、HGF (20μg/L) 组、FGF4 (20μg/L) 组、FGF4 (20μg/L) +HGF (20μg/L) 组和HGF (20μg/L) +FGF4 (20μg/L) +MCSF (10μg/L) 组, 于37℃, 5%CO2培养箱培养, 每2~3 d换液一次。观察细胞形态, 培养15 d进行免疫荧光检测。
1.6、 免疫荧光检测
细胞均匀涂布于载玻片上, 4%的多聚甲醛固定, 晾干, 1×PBS浸洗3次, 3 min/次, 0.5%Triton X-100通透20 min, 1×PBS浸洗3次, 3 min/次, 室温晾干, 正常山羊血清室温封闭30 min, 去除封闭液, Oct4 (稀释比1∶200) 、ALB (稀释比1∶200) 、AFP (稀释比1∶100) 、c-Kit (稀释比1∶200) 、CK19 (稀释比1∶200) 及CD34 (稀释比1∶100) 抗体, 4℃孵育过夜, 1×PBS浸洗3次, 3 min/次, 室温晾干, 避光荧光 (Cy3) 标记羊抗兔IgG 37℃孵育1 h, 1×PBS浸洗3次, 3 min/次, DAPI避光孵育5 min, 1×PBS浸洗3次, 3 min/次, 室温晾干, 含抗荧光淬灭剂的封片液封片, 荧光显微镜观察, 拍照。
1.7、 统计学方法
应用SPSS17.0统计软件进行分析, 计量资料以均数±标准差 (?±s) 表示, 多组间比较采用单因素方差分析并采用Dunnett's test进行组间两两比较, 两组间比较采用t检验, P<0.05为差异有统计学意义。
2、 结果
2.1、 动员后CD34+细胞比例
本研究中18例NHL患者均经病理组织活检及免疫组织化学染色确诊。其中, 男12例, 女6例;年龄25~57 (36.4±6.3) 岁;单个核细胞为 (2.64~24.17) ×108个/kg, 平均单个核细胞为 (6.97±1.38) ×108个/kg, CD34+细胞为 (3.98~41.47) ×106个/kg, 平均CD34+细胞为 (6.16±1.03) ×106个/kg;CD34+细胞占有核细胞比例为 (1.73±0.16) %。见图1。
图1 流式细胞仪检测CD34+细胞占比图
2.2、 细胞培养观察结果
外周血CD34+细胞重悬后混匀, 台盼蓝检验细胞存活率, 接种到12孔板, 2×106个/孔, 镜下见细胞呈圆型, 大小均匀, 透明度大;4 h后观察细胞形态, 细胞贴壁, 呈类圆形。对照组:细胞培养7 d后, 细胞生长缓慢, 形态不一, 培养15 d后, 大部分细胞死亡, 极少数细胞呈类圆形生长, 核大。FGF4组:培养7 d后, 细胞贴壁生长, 大部分细胞出现形变, 呈多边形, 不规则, 仍有少量类圆形细胞生长, 培养15 d后, 细胞增殖缓慢, 大部分细胞死亡。HGF组:培养7 d后, 细胞贴壁生长, 部分细胞死亡, 少数细胞仍呈贴壁类圆形, 培养15 d后, 大部分细胞死亡, 少部分细胞呈类圆形生长。FGF4+HGF组:培养7 d后大部分细胞出现形变, 呈多边形, 细胞核明显缩小, 呈不规则样, 可见少量类圆形细胞, 培养15 d后, 细胞增殖缓慢, 可见少量散在类圆形细胞, 大部分贴壁呈多边形, 部分细胞死亡。HGF+FGF4+MCSF组:培养7 d后, 部分细胞仍呈类圆形, 细胞核比例大, 可见少量不规则形变细胞, 培养15 d后, 细胞增殖尚可, 部分仍呈类圆形。15 d后各组肝样干细胞数量统计如下。见图2。
2.3、免疫荧光检测结果
对照组、HGF组、FGF4组:检测指标均无表达。HGF+FGF4+MCSF组:Oct4、c-Kit、CK19、CD34阳性表达, AFP弱阳性, ALB阴性 (见图3 ) ;FGF4+HGF组细胞:AFP、ALB阳性表达, CK19、CD34弱阳性表达, Oct4、c-Kit阴性 (见图3?) 。
图2 各组细胞形态学表现及肝样干细胞数目 (**P0.01) 图

3、 讨论
3.1干细胞是现今医学研究的热点, 也越来越多地被用于临床疾病的治疗[11,12]。Till JE, McCulloch EA等证实了外周血干细胞的存在后, 人们对外周血干细胞的研究逐渐深入, 在临床血液病的治疗中外周血干细胞移植疗法日益受到重视[13,14]。外周血干细胞具有取材方便、创伤小、患者易于接受等特点[15]。移植前对患者进行骨髓动员是获取外周血干细胞的关键, 经CEP (环磷酰胺、替尼泊苷及顺铂) +rh G-CSF动员, 大剂量化疗后患者外周血白细胞数量降至1×109/L, rh G-CSF及相应化疗药物联合处理后待外周血白细胞≥5×109/L后, 流式细胞仪检测CD34+细胞比例>1%时采集 (本实验中检测时间点均>1%) , 取得良好效果。试验中通过筛选贴壁细胞及应用免疫磁珠法对CD34+细胞进行纯化。
3.2国内外对干细胞转分化诱导为肝样细胞报道较少, 且条件不一[4,5]。早期胚胎在发育的过程中存在限制性, 但限制并非绝对, 环境改变或某些基因表达可调整或解除限制。研究表明脂肪间充质干细胞、子宫内膜干细胞、乳牙牙周膜干细胞在一定条件下可向肝样干细胞分化, 这在一定程度上证实了细胞横向分化的可能[16~19]。本实验通过外周血造血干细胞在体外诱导15 d后检测到部分细胞表达肝样干细胞及外周血造血干细胞表面抗原。
图3 免疫荧光检测结果图

3.3本实验研究白血病患者外周血干细胞经体外诱导分化为肝样干细胞的可能, 虽然诱导后的细胞没有进行功能学验证且存在免疫组化时间点检测少等问题, 但目前的实验结果显示, 已诱导的细胞经过免疫检测, 表达肝干细胞及外周血干细胞的部分表面抗原, 人外周血干细胞具有向肝样干细胞转化的潜能, 这对我们利用外周血干细胞诱导成肝样干细胞用于肝癌的靶向治疗提供可能, 我们相信随着对外周血干细胞的进一步研究, 肝干细胞携带治疗基因用于治疗肝癌将成为可能。
参考文献:
[1] Liu C, Chern G, Hsu F, et al. A multifunctional nanocarrier for efficient TRAIL-based gene therapy against hepatocellular carcinoma with desmoplasia in mice[J]. Hepatology, 2018, 67 (3) :899-913.
[2] 姚鹏.干细胞在肝脏疾病中应用的现状与希望[J].世界华人消化杂志, 2017, 25 (1) :17-22.
[3] 钟晓刚, 何生, 殷舞, 等.成体肝干细胞向肝癌细胞趋向性迁移的体外实验[J].中华肝脏病杂志, 2005, 13 (9) :644-647.
[4] Takagi C, Yagi H, Hieda M, et al. Mesenchymal stem cells contribute to hepatic maturation of human induced pluripotent stem cells[J]. Eur Surg Res, 2017, 58 (1-2) :27-39.
[5] Zhou X, Cui L, Zhou X, et al. Induction of hepatocyte-like cells from human umbilical cord-derived mesenchymal stem cells by defined microRNAs[J]. J Cell Mol Medi, 2017, 21 (5) :881-893.
[6] Salama H, Zekri AR, Medhat E, et al. Peripheral vein infusion of autologous mesenchymal stem cells in Egyptian HCV-positive patients with end-stage liver disease[J]. Stem Cell Res Ther, 2014, 5 (3) :70.
[7] Margini C, Vukotic R, Brodosi L, et al. Bone marrow derived stem cells for the treatment of end-stage liver disease[J]. World J Gastroenterol, 2014, 20 (27) :9098-9105.
[8] Xue HL, Zeng WZ, Wu XL, et al. Clinical therapeutic effects of human umbilical cord-derived mesenchymal stem cells transplantation in the treatment of end-stage liver disease[J]. Transplant Proc, 2015, 47 (2) :412-418.
[9] Bhatt VR, Vose JM. Hematopoietic stem cell transplantation for nonHodgkin lymphoma[J]. Hematol Oncol Clin North Am, 2014, 28 (6) :1073-1095.
[10] Gui W, Su L, He J, et al. Autologous peripheral blood stem cell transplantation in children and adolescents with non-Hodgkin lymphoma[J]. Oncol Lett, 2015, 10 (3) :1826-1830.
[11] Zhu Q, Lu Q, Gao R, et al. Prospect of human pluripotent stem cell-derived neural crest stem cells in clinical application[J]. Stem Cells Int, 2016, 2016 (4) :1-11.
[12] Tolosa L, Pareja E, Gómez-Lechón MJ. Clinical application of pluripotent stem cells:an alternative cell-based therapy for treating liver diseases?[J]. Transplantation, 2016, 100 (12) :2548-2557.
[13] Mathews V, George B, Viswabandya A, et al. Improved clinical outcomes of high riskβthalassemia major patients undergoing a HLA matched related allogeneic stem cell transplant with a treosulfan based conditioning regimen and peripheral blood stem cell grafts[J]. Plos One, 2013, 8 (4) :e61637.
[14] Massoud R, Assi R, Fares E, et al. Cytomegalovirus reactivation in lymphoma and myeloma patients undergoing autologous peripheral blood stem cell transplantation[J]. J Clin Virol, 2017, 95:36-41.
[15] Yafour N, Brahimi M, Osmani S, et al. Biosimilar G-CSF (filgrastim) is effective for peripheral blood stem cell mobilization and noncryopreserved autologous transplantation[J]. Transfus Clin Biol, 2013, 20 (5-6) :502-504.
[16] Ghaderi GM, Sahebghadam LA, Kordi TD, et al. The enhancement of differentiating adipose derived mesenchymal stem cells toward hepatocyte like cells using gelatin cryogel scaffold[J]. Biochem Biophys Res Commun, 2017, 491 (4) :1000-1006.
[17] Khademi F, Ai J, Soleimani M, et al. Improved human endometrial stem cells differentiation into functional hepatocyte-like cells on aglycosaminoglycan/collagen-grafted polyethersulfone nanofibrous scaffold[J]. J Biomed Mater Res B Appl Biomater, 2017, 105 (8) :2516-2529.
[18] Vasanthan P, Jayaraman P, Kunasekaran W, et al. Generation of functional hepatocyte-like cells from human deciduous periodontal ligament stem cells[J]. Naturwissenschaften, 2016, 103 (7-8) :62.
[19] Shahbazi E, Mirakhori F, Ezzatizadeh V, et al. Reprogramming of somatic cells to induced neural stem cells[J]. Methods, 2018, 133:21-28.





