骨代谢的平衡由骨形成和骨吸收维持,成骨细胞(OB) 和破骨细胞(OC) 起着重要作用。其中,OC是一种具有独特骨吸收功能的多核巨细胞,来源于造血细胞系,属于终末细胞,不能增殖和传代〔1〕。而破骨样细胞(OLC) 是指具有OC性质,通过原代培养或实验诱导生成的,用于实验研究的细胞。到目前为止,还没有成熟的OC株。自从Testa等〔2〕首次在体外培养骨髓造血细胞时发现能够形成OC后,骨髓诱导培养法分化OLC的技术形成并逐渐开展应用。获得OC的方法多种多样,包括诱导培养、直接培养等技术都逐渐趋于稳定成熟,有助于着手从基因水平深入研究骨吸收的机制,从而进一步开发代谢性骨病的治疗药物。本文拟证实慢病毒转染OLC的可行性,为进一步利用OLC进行基因学研究奠定重要基础。
1 材料与方法
1. 1实验动物4周龄雌性SD大鼠,购自吴氏实验动物中心。
1. 2主要试剂、材料和仪器 低糖DMEM培养基 ( 美国Hy-clone公司) ,中美胎牛血清(Bioind) ,红细胞裂解液,双抗、磷酸盐缓冲液 (PBS,美国Gibco公司) ,鼠M-CSF、RANKL( 美 国Peprotech公司) ,抗酯酸性蛋白酶染色试剂盒(TRAP,美国Sig-ma公司) ,NFAT抑制剂 ( 德国Calbiochem公司 ) ,Trizol( 美国Ambion公司) ,逆转录试剂盒(Ta KaRa) ,SYBR Green试剂(In-vitrogen) ,NFAT2RNAi慢病毒、对照病毒由厦门欣基公司包装合成,引物由上海生工公司合成;10 cm培养皿、六孔板( 美国Corning公司) ;CO2培养箱( 美国Thermo公司) ,DM2500荧光显微镜( 德国Leica公司) ,PCR扩增仪( 美国Bio-Rad公司) ,荧光定量PCR仪7500型( 美国ABI公司)。
1. 3大鼠骨髓间充质干细胞(BMSCs) 的分离与诱导培养 取SD大鼠麻醉后处死,无菌条件下取双侧股骨和胫骨,剔除多余软组织,用5 ml注射器吸取适量低糖DMEM冲洗骨髓腔,直至骨髓腔 变 白,取 冲 洗 液 充 分 吹 打 制 成 细 胞 悬 液 后 离 心,800 r / min,3 min.弃上清加红细胞裂解液,混匀静置2 min,800 r / min离心3 min,弃上清去除红细胞,得到白细胞沉淀。重悬于含25. 0 ng/ml M-CSF +50. 0 ng/ml RANKL的低糖DMEM完全培养液( 含10% FBS、1%青霉素与链霉素) ,接种于10 cm培养皿,37℃ 、5% CO2、饱和湿度培养箱中培养24 h.取未贴壁细胞,调整细胞密度为2. 5×105重悬于含25. 0 ng/ml M-CSF +50. 0 ng / ml RANKL( 大鼠) 的低糖DMEM完全培养液,接种于六孔培养板,继续培养,首次半定量换液,以后每隔3 d换液。
1. 4慢病毒转染OLC并分组 以hela细胞(2. 5 ×104/孔) 对比,待获得的OLC生长融合达约60%时,对照病毒( 无NFAT2沉默) 转染按感染复数(MOI)15、5、1各分为三组,18 h后首次换液,此后每2 ~ 3 d换液1次并于第5天观察荧光表达情况,荧光显微镜(×200) 下随机选取5个视野拍摄OLC和hela细胞,并用Image-Pro Plus专业图像分析软件计数。
1. 5 TRAP染色及计数 将OLC于转染后第5天弃培养基,PBS冲洗2遍,柠檬酸盐/丙酮固定液室温下固定30 s,用蒸馏水冲洗、晾干,按试剂盒说明书行TRAP染色,倒置相差显微镜(×200) 下随机选取5个视野计数3个核以上破骨细胞,并在200倍光镜下,用Image-Pro Plus专业图像分析软件计数。
1. 6 NFAT2抑制剂干预OLC将获得的OLC融合率达到60%左右时,进行不同干预并分为OLC对照组、NFAT2抑制剂(VIVIT) 组、NFAT2iRNA慢病毒组、对照病毒组。NFAT2iRNA慢病毒组和对照病毒组病毒剂量均以MOI = 15为参数,VIVIT试剂以2 μmol/L每孔连续干预3 d,此后每2 ~ 3 d换液1次并于第5天进行RT-PCR检测。
1. 7 RT-PCR检测 细胞总RNA用Trizol提取。取总RNA2 μg,按反转录试剂盒 (Ta KaRa) 步骤完成反转录。以GAPDH为内参照,取2 μl反转录产物分别以下述引物进行PCR扩增。引物序列及反应条件:①NFAT2: 顺向GGAGGGAAGAAGATG-GTGTTGT,反向CTGGTTATTCTCTGGTTGCGG;② GAPDH: 顺向AGTGCCAGCCTCGTCTCATAG,反向CGTTGAACTTGCCGTGGG-TAG; 反应条件:95℃ 30 s后,95℃ 5 s,60℃ 34 s,反复循环40次,95℃ 15 s,60℃ 1 min,95℃ 15 s后结束反应。采用2-ΔCt的方法计算基因相对表达量,公式: 目的基因表达量= 2-ΔCt,ΔCt =Ct目的基因-Ct内参基因。
1. 8统计学方法 应用SPSS13. 0软件选用单因素方差分析(One-way ANOVA)、LSD方法统计。
2 结 果
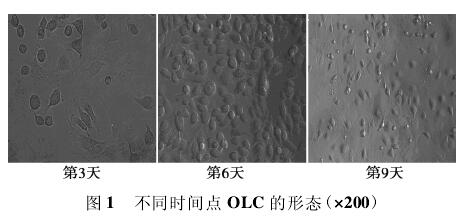
2. 1细胞生长特性 倒置显微镜下观察,大鼠BMSCs培养24 h后开始贴壁,呈梭形,诱导后细胞逐渐变大,集落融合成多核破骨细胞,第9天时细胞状态最佳,数量最多,随后细胞开始皱缩,出现大量空泡。MOI = 15、5、1均未见明显的细胞毒性。见图1.
2. 2转染及计数 带有绿色荧光蛋白(GFP) 标记的对照病毒转染OLC后第5天在倒置荧光显微镜下观察,可见转染上的OLC发出较强的绿色荧光,胞体大、形态不一、核数≥3、细胞外围有一明显皱褶缘。随着MOI值的升高,hela的转染数增加,各组之间比较均有显着差异(P<0. 01)。OLC组在MOI = 15时,转染数最多,与MOI = 5、1比较有统计学差异(P<0. 01)。MOI = 15时,OLC褶皱缘明显、荧光强;MOI = 5、1时,转染的OLC荧光较弱,皱褶缘少,其他细胞转染较多。见图2,表1.
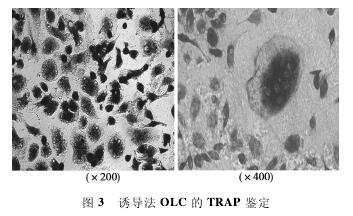
2. 3 TRAP染色及数量 诱导的OLC经TRAP染色后胞质深染呈紫红色,而胞核阴性,核数目≥3,多位于周边。经Image-Pro Plus计数分析后,MOI = 15组 (53. 60 ± 3. 65)、MOI = 5组(47. 20±3. 83)、MOI= 1组(48. 80±7. 12) 细胞数量均无显着差异(P>0. 05)。见图3.
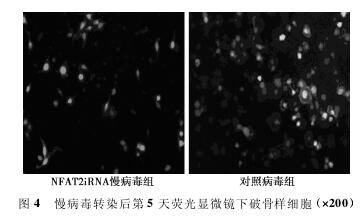
2. 4 NFAT2iRNA慢病毒转染OLC后NFAT2的表达 不同病毒转染OLC后 荧 光 显 微 镜 下 观 察,与 对 照 病 毒 组 比 较,NFAT2iRNA慢病毒组OLC数目少,荧光强度弱,未见皱褶缘。经过不 同 干 预 后,NFAT2抑 制 剂 组 (0. 009 7 ± 0. 001 7) 和NFAT2iRNA慢病毒组(0. 009 6 ± 0. 002 0) 的NFAT2基因表达明显 低 于OLC对 照 组 (0. 015 8 ± 0. 002 6) 和 对 照 病 毒 组(0. 015 9±0. 002 5) (P<0. 05)。而OLC对照组和对照病毒组、NFAT2抑制剂组和NFAT2iRNA慢病毒组之间的NFAT2基因表达无显着差异(P>0. 05)。见图4.
3 讨 论
骨代谢疾病如骨质疏松、Paget病、牙周炎等病理变化都存在骨吸收异常,其中OC起重要作用〔3〕。OC在体外很脆弱,培养难度高,纯度不高。本实验将大鼠BMSC在体外培养过程中加25. 0 ng/ml M-CSF +50. 0 ng/ml RANKL进行诱导,获得一定量的成熟OLC,观察培养至第9天时数量最多,与其他培养方法比较,与体内OC生物学功能最接近〔4〕,最适合用于体外深入研究。
慢病毒载体是以人类免疫缺陷I型病毒(HIV-1) 为基础发展起来的基因治疗载体,可以将外源基因有效地整合到宿主染色体上,从而达到持久稳定的表达。在感染能力方面不同于腺病毒和逆转录病毒,可有效地感染一些较难转染的细胞,如原代细胞、干细胞、不分化细胞等,适用于OC的体外研究〔5〕。GFP是一种新型报告基因,与目的基因构成融合基因后,通过载体( 如质粒、慢病毒、腺病毒) 转染,细胞可表达GFP蛋白,产生绿色荧光。本实验发现慢病毒转染效果与MOI值有密切关系,随MOI值的增加而升高,TRAP染色进一步验证MOI = 15、5、1对细胞均无较明显毒性作用。
Ca2+/ NFATc1信号通路是OC内重要的信号系统,参与调节OC的分化和成熟〔6〕。活化T细胞核因子家族中的NFATc1已被证实是其中重要的转录调节因子,参与许多OC特异性基因的表达调控,对OC分化和骨吸收功能至关重要〔7〕。有研究表明,NFATc1基因敲除的小鼠表现为骨硬化症〔8〕; 其基因缺陷的胚胎干细胞不能分化成OC,但表达外源性NFATc1的前体细胞在没有RANKL的情况下也能向OC分化〔9〕。因此,可选择最适宜的MOI值用NFAT2iRNA慢病毒对OC进行基因验证。NFAT2iRNA慢病毒进入OC转染成功后使NFAT2基因沉默,表达下降,而对照病毒没有使NFAT2沉默的作用,同时加入VIVIT作为对照,VIVIT组和NFAT2iRNA慢病毒组的NFAT2基因表达明显低于OLC对照和对照病毒组,说明转染成功。此外,荧光显微镜也进一步证明NFAT2对OC的分化和成熟的重要性。
体外成功转染OC的主要措施: 保证转染前细胞活性处于最佳状态; 病毒转染前更换新培养基效果最好; 加病毒后一般需在8 ~ 12 h更换培养基。经过反复大量实验,发现对于OC18个小时为最佳换液时间; 采用1 ~ 2个月大鼠,所诱导的OC最多; 动物从处死到分离细胞速度要快,OC不易受损; 严格无菌操作,诱导因子足量; 采用差速贴壁法纯化OC,因所分离成纤维细胞等贴壁速度快,在培养24 h后收集未贴壁细胞接种至另一培养板中可提高纯度; 纯化后OC为更好贴壁,2 ~ 3 d内需要静置培养,不宜挪动。
综上所述,此次OC转染成功为今后骨代谢疾病的基因治疗开拓了广阔的道路,利用携带目的基因慢病毒载体转染OLC,研究骨吸收的具体分子机制及有关OC内分化的信号通路是今后进一步实验的方向。
4 参考文献
1 Duong LT,Rodan GA. Regulation of osteoclast formation and function〔J〕。 Rev Endocr Metab Disorders,2001;2(1) :95-104.
2 Testa NG,Allen TD,Lajtha LG,et al. Generation of osteaclasts in vitro〔J〕。 J Cell Sci,1981;47(1) :127-37.
3 Rodan GA,Martin TJ. Therapeutic approaches to bone diseases〔J〕。 Sci-ence,2000;289(5484) :1508-14.
4付应霄,顾建红,王世涛,等。 2种方法诱导形成的破骨细胞特性比较〔J〕。中国兽医学报,2013;33(1) :94-7.
5 Kubo S,Kataoka M,Tateno C,et al. In vivo stable transduction of human-ized liver tissue in chimeric mice via high-capacity adenovirus-lentivirushybrid vector〔J〕。 Hum Gene Ther,2010;21(1) :40-50.
6 Hwang SY,Putney J. Calcium signaling in osteoclasts〔J〕。 Biochim Bio-phys Acta,2011;1813(5) :979-83.
7 Negishi KT,Takayanagi H. Ca2+-NF ATc1 signaling is an essential axis ofosteoclast differentiation〔J〕。 Immunol Rev,2009;231(1) :241-56.
8 Winslow MM,Pan MG,Starbuck M,et al. Calcineurin / NFAT signaling inosteoblasts regulates bone mass〔J〕。 Dev Cell,2006;10(6) :771-82.
9 Takayanagi H,Kim S,Koga T,et al. Induction and activation of the tran-scription factor NFATc1(NFAT2)integrate RANKL signaling in terminaldifferentiation of osteoclasts〔J〕。 Dev Cell,2002;3(6) :889-901.