摘 要: 制备了一种聚乙二醇 (PEG) 和柠檬酸根不对称修饰的“两面神”型金纳米粒子 (Janus AuNPs) 比色传感器, 并基于此建立了铁离子 (Fe3+) 比色检测的新方法。首先, 利用柠檬酸钠还原法制备了粒径相对较大的金纳米粒子, 随后, 以玻片为基底, 将大粒径金纳米粒子修饰在玻片上, 利用玻片掩蔽部分柠檬酸根位点, 并进一步在金纳米粒子非接触区域上修饰大量PEG链, 得到柠檬酸根和PEG不对称修饰的Janus AuNPs。引入Fe3+后, 有限区域内的柠檬酸根诱导Janus AuNPs发生定向聚集, 形成金纳米粒子寡聚体并在水溶液中保持稳定。Janus AuNPs溶液吸光度比值与Fe3+浓度在1μmol/L~10 mmol/L范围内呈线性变化 (y=0.129x+0.317) , 检出限为715 nmol/L。与同类方法相比, 该方法操作简便、灵敏度高, 且可极大拓宽检测的线性范围。
关键词: “两面神”型金纳米粒子; 不对称修饰; 定向聚集; 铁离子; 比色传感;
Abstract: A novel colorimetric method for iron ion (Fe3+) detection was proposed by using asymmetrically modified Janus gold nanoparticles (Janus AuNPs) in this paper.Initially, citrate-stabilized AuNPs with relatively large size were prepared through reduction reaction.Then, the large sized citrate-stabilized AuNPs were immobilized on the glass slide, through which some binding sites on the surface of AuNPs were concealed.The stabilizing agent of polyethylene glycol (PEG) was further introduced onto the exposed surface of AuNPs to obtain the PEG and citrate asymmetrically modified Janus AuNPs.After the introduction of Fe3+, the aggregation behavior of Janus AuNPs was adjusted in an oriented and controllable manner to form oligomers which could remain stable in aqueous solution for a long time.Such an asymmetrical modification could significantly improve the dynamic detection range (1 μmol/L-10 mmol/L) of AuNPs based colorimetric assay.Meanwhile, a linear calibration curve, i.e.A750/A536=0.129c (μmol/L) +0.317 was also obtained, with a detection limit of 715 nmol/L.Compared with other nanoparticle-based colorimetric system for Fe3+detection, this method is simple and sensitive, and surprisingly broadens the linear range for detection.
Keyword: Janus gold nanoparticles; asymmetrical modification; oriented aggregation; iron ion; colorimetric detection;
铁元素是地球上含量最丰富的元素之一, 也是人体必需的过渡金属元素[1]。三价铁离子 (Fe3+) 作为机体内铁元素的存在形式, 是氧和电子的运输载体, 承担着转运血红蛋白的重任, 同时也作为辅助因子应用于多数氧化还原酶反应中[2]。Fe3+具有生物毒性, 因此在机体内的含量需严格控制, 其细胞毒性与阿尔茨海默氏症、亨廷顿舞蹈症及帕金森氏症等重大疾病密切相关[3]。机体内Fe3+含量较低会导致输送到细胞的氧气量不足, 诱发神经疲劳、贫血[4]、肝肾损伤、免疫力下降、机体易感染等诸多问题[5];而细胞中过量的Fe3+会催化活性氧的产生, 从而破坏脂质、核酸和蛋白质[6], 因此对Fe3+含量的动态监控至关重要。目前已有多种铁离子的检测方法, 如原子吸收光谱法 (AAS) 、电感耦合等离子体原子发射光谱法 (ICP-AES) 、电感耦合等离子体质谱法 (ICP-MS) 、伏安法及荧光法等[7,8,9,10]。这些方法准确灵敏, 重复性高, 但大多需要昂贵的仪器、复杂的样品前处理过程以及专业的操作人员, 耗时长且不能实时在线检测, 不利于Fe3+的动态监测[1], 因此亟需研发一种价廉、简单快速、操作方便且可实时动态监测Fe3+的方法。

金纳米粒子 (AuNPs) 由于其特殊的理化性质、量子尺寸效应及表面等离子光学特性[11]而备受关注。AuNPs具有制备方法简单、反应灵敏快速、能可视化分析等优点[12], 被广泛应用于比色检测体系中。近年来, 基于AuNPs的Fe3+比色检测方法的报道逐渐增多。其中, 最常见的是柠檬酸钠直接修饰的AuNPs检测Fe3+的方法, 该法通过Fe3+与AuNPs表面的羧酸根 (—COO—) 发生螯合作用导致分散的粒子聚集和溶液颜色变化。还有用多种功能基通过Au—S, Au—N或静电作用等表面全修饰的AuNPs检测Fe3+的方法[13]。这些方法采用表面全修饰, 实现了特异性基团与目标物尽可能多的识别而诱导团聚迅速发生。但上述传统的AuNPs团聚方式非定向且不可控, 极易导致大规模团聚体在溶液中沉降和颜色迅速褪去, 大大降低检测的稳定性、对外界环境的抗干扰能力和定量检测的准确性, 且线性范围较窄[14,15]。另外, 传统体系一般采用较小粒径的AuNPs (10~20 nm) 用于Fe3+比色检测, 其灵敏度较低, 不利于实际样品中痕量Fe3+的检测。
图1 聚乙二醇 (PEG) 与柠檬酸根不对称修饰的“两面神”型金纳米粒子 (Janus AuNPs) 比色检测Fe3+的示意图
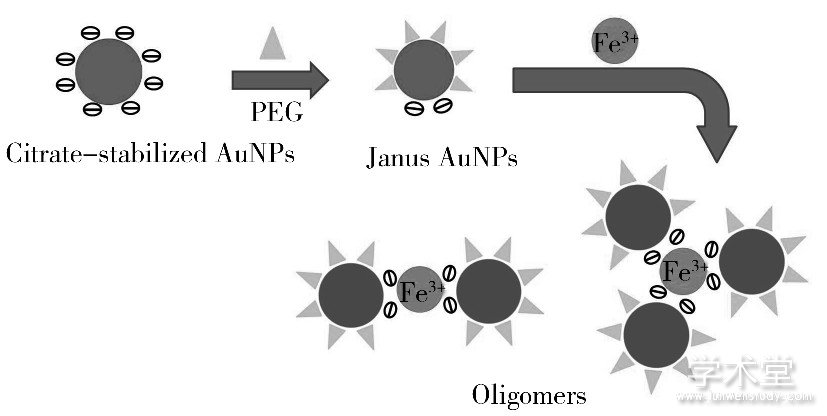
Fig.1 Principle of PEG and citrate asymmetrically modified gold nanoparticles (Janus AuNPs) -based colorimetric sensor for detection of Fe3+
为了解决上述问题, 对AuNPs表面进行功能化改性, 使其具备特殊的性能是重要措施之一。惰性基团聚乙二醇 (PEG) 能有效稳定AuNPs, 将PEG不对称地修饰在AuNPs表面, 可提高粒子在溶液中的稳定性和抗干扰能力。已有文献报道仅在检测目标物的量多于AuNPs时才能实现比色检测, 而增大粒子尺寸, 可有效降低AuNPs摩尔数量, 实现低浓度目标物的检测[14]。为此, 本文设计制备了一种较大尺寸的PEG与柠檬酸根不对称修饰的“两面神”型金纳米粒子 (Janus AuNPs) 用于Fe3+的比色检测。如图1所示, 将柠檬酸根修饰的AuNPs (下文以AuNPs表示) 固定在玻片上, 利用“ligand exchange”合成策略将惰性的PEG通过巯基形成的Au—S键修饰在该AuNPs未与玻片接触的面上, 借用玻片掩蔽AuNPs表面柠檬酸根位点, 当从玻片表面剥离后, 即得到PEG与柠檬酸根修饰的Janus AuNPs。以该Janus AuNPs比色检测Fe3+时, 一方面, Janus AuNPs表面修饰的惰性PEG基团可有效稳定大尺寸的AuNPs, 提高灵敏度的同时也使其保持稳定状态;另一方面, 限定区域的柠檬酸根识别Fe3+, 使粒子以定向可控的方式发生团聚, 多数粒子以二聚体或三聚体的形式稳定存在于溶液中, 有效拓宽了检测的动态范围。
1、 实验部分
1.1、 仪器与试剂
冷场发射型扫描电镜 (JSM-6701F, 日本电子株式会社) ;激发光动态散射仪 (Zetasizer Nano 3600, 英国马尔文仪器有限公司) ;紫外-可见分光光度计 (Lambda 35, 美国珀金埃尔默股份有限公司) ;透射电子显微镜 (TF20, 美国FEI公司) ;实验室级超纯水器 (OKP-S210超低有机型, 上海涞科实业发展有限公司) 。
柠檬酸三钠 (北京化工工业集团有限责任公司) ;三水合氯金酸 (HAuCl4·3H2O) (Sigma-Aldrich公司) ;巯基聚乙二醇 (mPEG-SH, 分子量350, 上海炎怡生物科技有限公司) ;3-氨基丙基-三甲氧基硅烷 (C9H23NO3Si, APTES, 阿拉丁生化科技股份有限公司) ;FeCl3 (天津市百世化工有限公司) ;实验用水均来自超纯水机 (18.2 MΩ· cm-1) 。
1.2、 金纳米粒子合成
参考文献中柠檬酸钠还原氯金酸的方法[16,17,18], 通过调节还原剂用量, 制备不同粒径的AuNPs。利用冷场发射型扫描电镜测量了30个粒子的大小, 获得AuNPs的平均尺寸约为13、25、35 nm。利用紫外分光光度计测定了各自的特征吸收峰, 分别为519、524、529 nm。为了优化AuNPs的粒径, 将一系列浓度的Fe3+ (10 μL) 添加到柠檬酸根稳定的3种不同粒径的AuNPs中 (90 μL) , 混合混匀后, 裸眼观察颜色变化并利用紫外分光光度计迅速记录吸收光谱变化, 以免形成团聚体发生沉降。
1.3、 Janus AuNPs制备
参考文献方法[17,18]制备PEG与柠檬酸根不对称修饰的Janus AuNPs。其消光系数为7.66×109 L/mol/cm[19], 利用朗伯比尔定律计算可得Janus AuNPs溶液浓度为0.5 nmol/L。
1.4、 Janus AuNPs表征
利用激光动态散射仪记录溶液电位值;场发射扫描电子显微镜获得粒子形貌图像;紫外分光光度计记录反应后紫外吸收光谱图的变化;透射电子显微镜表征粒子结构和得到能谱图。
1.5、 AuNPs粒径优化
将一系列浓度的Fe3+ (10 μL) 分别加入粒径为13、25、35 nm的柠檬酸根修饰的AuNPs溶液中 (90 μL) , 利用旋涡混匀器充分混匀, 裸眼观察颜色变化并利用紫外分光光度计迅速记录实验结果。
1.6、 Janus AuNPs比色检测Fe3+
选择35 nm Janus AuNPs作为最优比色传感器, 并用于后续实验中。将一系列梯度浓度的Fe3+ (10 μL) 加入新鲜制备的Janus AuNPs (90 μL, 0.5 nmol/L) 溶液中, 利用旋涡混匀器混匀, Fe3+终浓度分别为1 μmol/L、10 μmol/L、100 μmol/L、1 mmol/L、10 mmol/L;此外, 将1 mmol/L Fe3+ (10 μL) 溶液分别加入35 nm AuNPs及Janus AuNPs的溶液中, 考察PEG非对称修饰前后传感器的稳定性, 裸眼观察溶液颜色变化并记录紫外吸收光谱结果。
2、 结果与讨论
2.1、 AuNPs粒径优化
AuNPs粒径是影响比色检测的关键性因素。本文通过制备3种不同粒径的AuNPs, 考察其检测Fe3+的灵敏度。在13、25、35 nm的柠檬酸根稳定的AuNPs溶液中分别加入不同浓度的Fe3+得到的溶液颜色变化和紫外吸收光谱图如图2, 图3所示。结果显示, 13、25、35 nm柠檬酸根稳定的AuNPs对Fe3+的裸眼检出限分别为500、250、1 μmol/L。随着粒径的增大, Fe3+的裸眼检出限从500 μmol/L降低至1 μmol/L, 紫外光谱图的变化同样证实了这一结果。说明增大AuNPs粒径可显着提高比色检测Fe3+的灵敏度。虽然35 nm的上述AuNPs对Fe3+的检测反应灵敏, 检出限低, 但由于粒子易形成大规模团聚体而发生沉降, 导致溶液颜色不断变浅, 30 min内溶液颜色即变为无色透明, 紫外分光光度计难以在恰当的时间内捕捉光谱信号的变化, 不能准确定量目标物 (图3) 。本文以玻片为载体, 制备了惰性基团PEG与柠檬酸根不对称修饰的大粒径Janus AuNPs, 实现了粒子的定向聚集, 同时利用空间位阻使团聚体稳定存在于溶液中。
2.2、 Janus AuNPs的表征
对所制备的Janus AuNPs进行表征。如图4A所示, 固定在玻片上的35 nm Janus AuNPs表面呈紫色, 与AuNPs溶液颜色基本一致, 说明带负电荷的AuNPs通过静电作用成功修饰在玻片上。AuNPs和Janus AuNPs的电位值结果如图4B所示, AuNPs电位值约为-44 mV, Janus AuNPs电位值约为-20 mV, 说明修饰后不带电荷的PEG基团占据了粒子表面大部分柠檬酸根位点, 使粒子表面电负性减弱。利用紫外分光光度计得到35 nm AuNPs和Janus AuNPs的吸收光谱图 (图4C) , 35 nm AuNP在529 nm处具有特征等离子体共振峰, 表面非对称修饰PEG后, 特征吸收峰红移到536 nm。这是由于PEG在AuNPs表面产生了致密的单分子层, 直接影响了局域表面等离子体共振的散射半径, 从而显着增加了粒子表面局部折射率所致[20,21]。
图2 13 nm (A) 和25 nm (B) 柠檬酸根稳定的AuNPs检测不同浓度Fe3+的照片及吸收光谱图, 以及不同粒径AuNPs体系中吸光度比值随Fe3+浓度变化的趋势 (C)
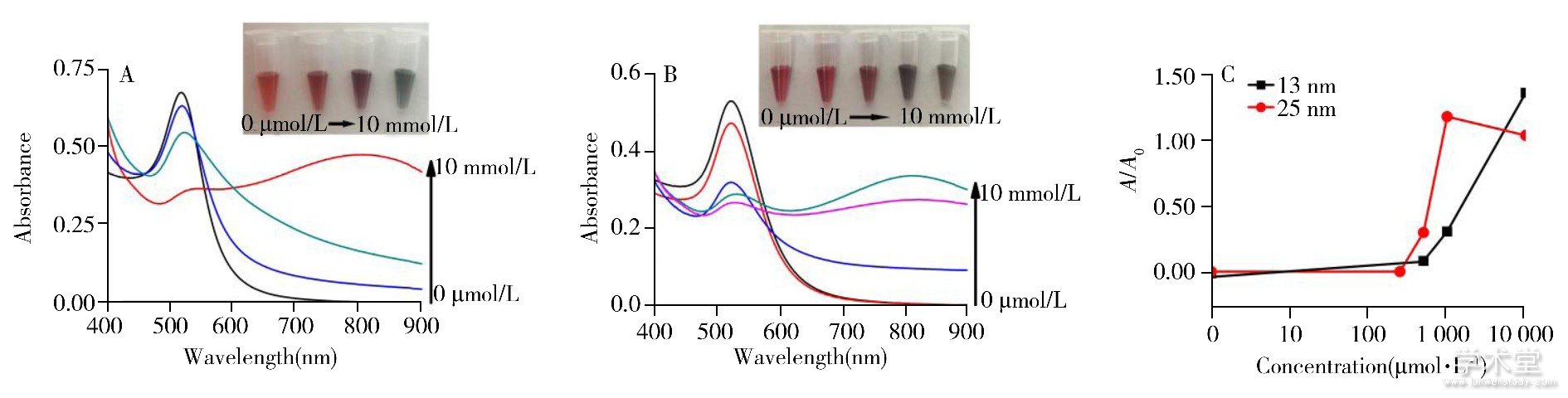
Fig.2 Photographs and optical absorption spectra of 13 nm (A) and 25 nm (B) citrate-stabilized AuNPs in the presence of different concentrations of Fe3+ and the calibration curves of absorption ration versus concentrations of Fe3+ (C)
concentrations of Fe3+:A:0μmol/L, 500μmol/L, 1 mmol/L, 10 mmol/L;B:0μmol/L, 250μmol/L, 500μmol/L, 1 mmol/L, 10 mmol/L;A0represents the absorbance of the absorption peak of blank AuNPs while A represents the intensity of the newly generated absorption peak after adding Fe3+ (13 nm Au NPs, A/A0=A790/A519;25 nm AuNPs, A/A0=A820/A524)
图3 柠檬酸根稳定的AuNPs (35 nm AuNPs) 检测不同浓度Fe3+的照片及吸收光谱图 (A) , 35 nm AuNPs检测1 mmol/L Fe3+的扫描电镜图 (B) 以及检测不同浓度Fe3+时的吸光度比值与浓度的动态响应范围 (C)
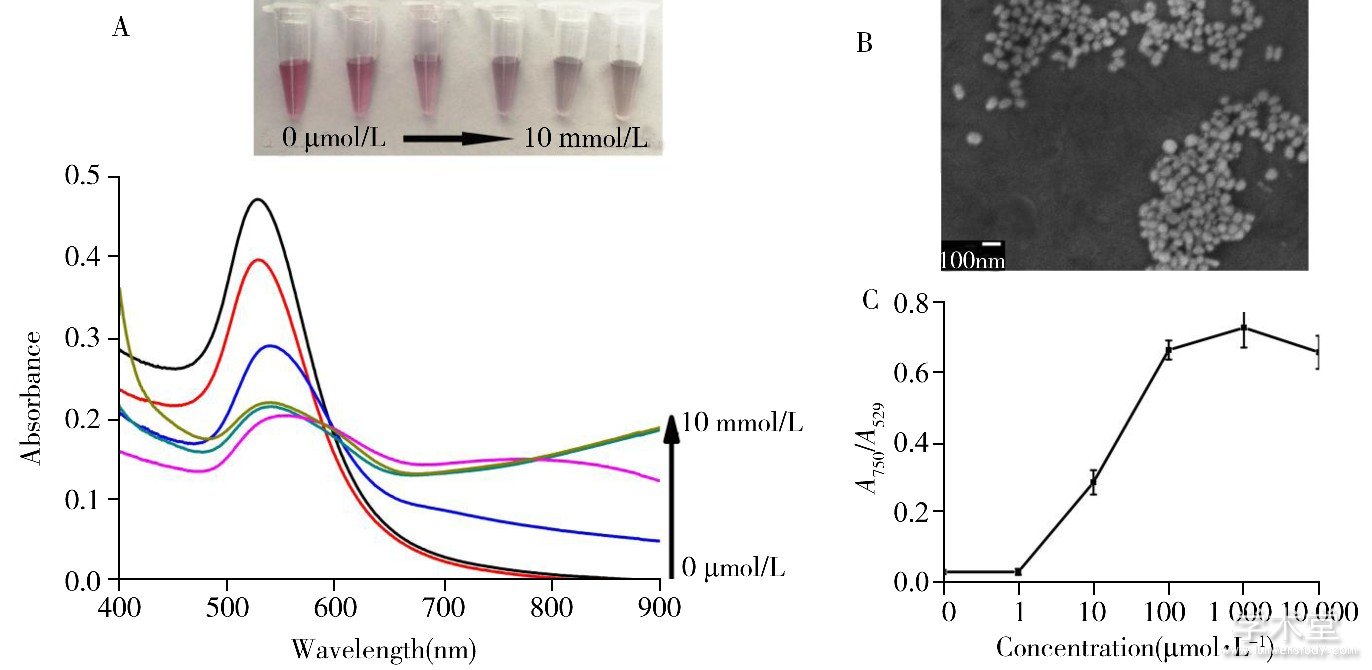
Fig.3 Photographs and absorption spectra of citrate-stabilized AuNPs (35 nm AuNPs) after the addition of different concentrations of Fe3+ (A) , the representative scanning electron microscopic (SEM) image of 35 nm AuNPs for detection of 1 mmol/L Fe3+ (B) and the calibration curve of absorption ratio versus concentrations of Fe3+ (C)
concentrations of Fe3+:0μmol/L, 1μmol/L, 10μmol/L, 100μmol/L, 1 mmol/L, 10 mmol/L
图4 固定在载玻片上的Janus AuNPs (A) 、35 nm AuNPs和Janus AuNPs的电位值 (B) 以及 35 nm AuNPs和Janus AuNPs的吸收光谱图 (C)
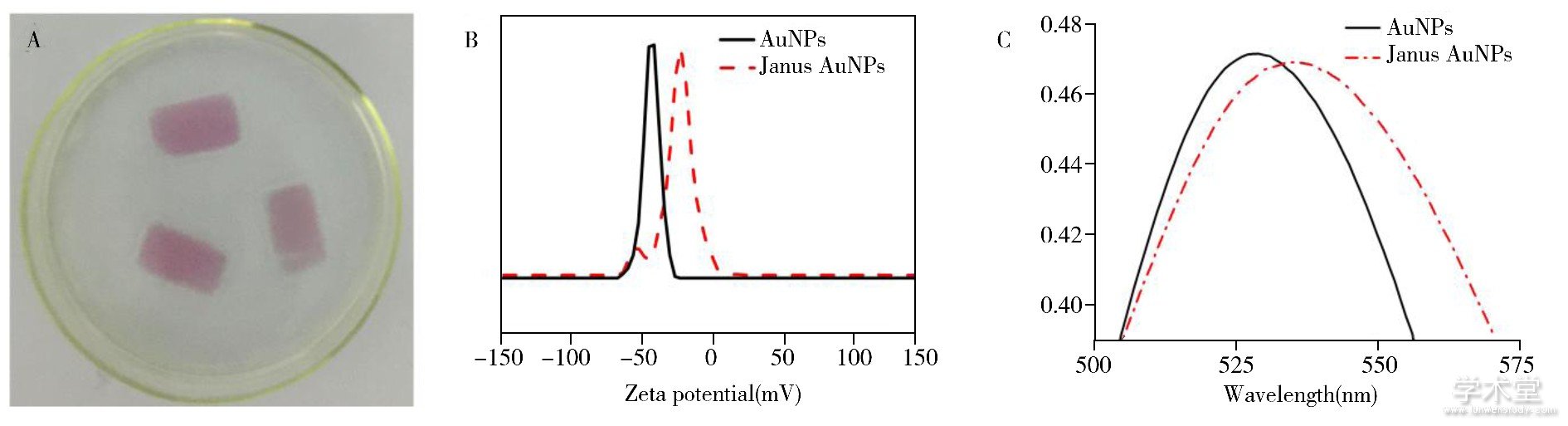
Fig.4 Photograph of Janus AuNPs immobilized on glass slide (A) , Zeta potential measurement of 35 nm AuNPs and Janus AuNPs (B) and normalized optical absorption spectra of 35 nm AuNPs and Janus AuNPs (C)
对比了AuNPs, PEG全修饰的AuNPs (PEG-AuNPs) 及Janus AuNPs的TEM透射电镜图 (图5) , 由图可知, AuNPs表面没有PEG分子层 (图5A) , PEG修饰的AuNPs表面明显包裹着1~2 nm厚度的PEG分子层 (图5B) ;而Janus AuNPs形成的三聚体在有限区域发生定向聚集, 表面大部分区域包裹PEG分子层 (图5C) 。对比结果说明PEG在Janus AuNPs表面成功实现了非对称修饰。进一步观察能谱图 (图6) , 发现AuNPs表面含有氧元素而不含硫元素, 说明只存在柠檬酸根, 而Janus AuNPs表面有硫元素和氧元素, 说明PEG已通过Au—S键修饰到粒子表面。上述表征结果证实了Janus AuNPs为惰性基团PEG非对称修饰的粒子结构, 其表面柠檬酸根可在限定区域与Fe3+产生螯合作用, 诱导粒子定向聚集, 实现目标物稳定、准确的定量检测。
图5 35 nm AuNPs (A) 、PEG-AuNPs (B) 及Janus AuNPs (C) 的TEM透射电镜图

Fig.5 Transmission electron microscopyic (TEM) images of 35 nm AuNPs (A) , PEG-AuNPs (B) and Janus AuNPs (C)
图6 35 nm AuNPs (A) 及Janus AuNPs (B) 的EDS能谱图
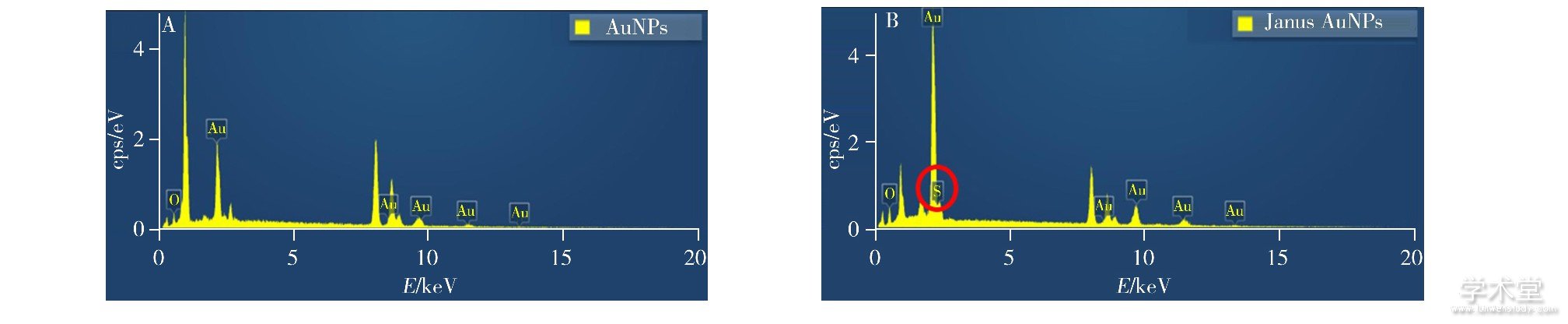
Fig.6 Energy dispersive spectra (EDS) of 35 nm AuNPs (A) and Janus AuNPs (B)
2.3、 Janus AuNPs比色检测Fe3+的灵敏度
探讨Janus AuNPs比色检测Fe3+的灵敏度并与35 nm AuNPs在相同条件下进行对比。在Janus AuNPs溶液中加入系列梯度浓度 (1 μmol/L、10 μmol/L、100 μmol/L、1 mmol/L、10 mmol/L) 的Fe3+, 溶液颜色由紫色明显变化到灰色, 同时其在536 nm处的特征吸收峰吸光度值逐渐降低, 因粒子团聚形成的750 nm处的吸光度值逐渐增加, 结果如图7A所示。扫描电镜图 (图7B) 显示, 当加入1 mmol/L目标物后Janus AuNPs大多以定向可控的方式进行团聚, 形成二聚体或三聚体并稳定存在于溶液中, 出现750 nm处的吸收峰。随着Fe3+浓度的增加, 形成的寡聚体数目增加, 750 nm处吸光度值逐渐上升。根据紫外光谱图可得到750 nm与536 nm处的吸光度比值A750/A536 (y) 与Fe3+浓度 (x) 在1 μmol/L~10 mmol/L范围的校正曲线, 二者在较宽的浓度范围内呈线性, 线性方程为y=0.129x+0.317, 相关系数r为0.98 (图7C) 。根据检出限计算公式LOD=3σ/S得到LOD为715 nmol/L, 比同等条件下13 nm AuNPs检出限降低500倍左右。在相同条件下将同等浓度的Fe3+加入到35 nm AuNPs溶液中, 结果如图3所示。当加入1 μmol/L低浓度Fe3+时, 溶液颜色迅速改变, 粒子发生团聚, 说明增大粒子尺寸可显着提高检测灵敏度。由于表面未修饰PEG基团, AuNPs以非定向不可控的方式发生团聚[17], 形成如图3B所示的易于发生沉降的大规模团聚体。当Fe3+浓度高于10 mmol/L时, AuNPs溶液颜色变化基本一致, 均由紫色变为灰色, 且750 nm处吸光度值基本保持恒定 (图3A, 3C) 。该结果说明团聚行为已达到饱和, 无新的团聚体形成。根据紫外光谱图中得到吸光度比值A750/A529与Fe3+浓度在1 μmol/L~10 mmol/L的变化曲线, 发现二者呈非线性的变化趋势, 无法得到线性方程用于准确定量目标物浓度 (图3C) 。这是由于粒子以非定向方式团聚后形成的大规模团聚体极易发生沉降, 导致溶液颜色迅速消失, 紫外分光光度计难以在恰当的时间捕捉检测信号。但Janus AuNPs团聚后粒子大多以寡聚体形式存在, 团聚体数目随着Fe3+浓度的上升而不断增加, 使溶液颜色稳定变化并得到相应的紫外吸收光谱, 可用于目标物的准确定量。
2.4、 Janus AuNPs比色检测Fe3+的稳定性
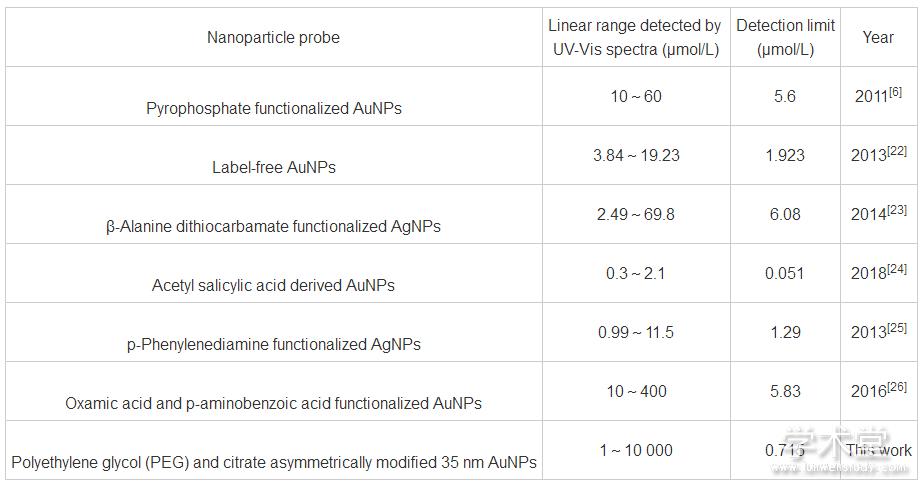
对比研究了Janus AuNPs与AuNPs传感器的稳定性。在同样条件下将1 mmol/L Fe3+分别加入两类传感器中, 监测溶液颜色和吸光度值A750随时间的变化, 结果如图8所示。AuNPs溶液中粒子迅速团聚形成大规模团聚体, 且溶液颜色迅速变为灰色, 750 nm处的吸光度值在10 s内迅速上升, 但1 min后即发生沉降, 溶液颜色不断褪去, 吸光度值亦迅速下降, 60 min后溶液已呈无色透明状态, 吸光度值接近于零 (图8A, 8C) 。相比之下, Janus AuNPs溶液中团聚体多以寡聚体形式存在, 溶液颜色逐渐变为灰色, 在750 nm处的吸光度值稳定变化, 5 min内即达到恒定值, 溶液颜色和吸收峰值在60 min内无明显下降, 形成的团聚体不易沉降 (图8B, 8C) 。这是由于PEG对AuNPs具有很强的稳定作用, 不仅能维持AuNPs寡聚体的稳定还能抵抗外界环境的干扰。上述结果足以证实惰性的PEG基团在AuNPs表面的非对称修饰极大地提高了传感器的稳定性。此外, 与文献中利用纳米粒子比色传感器检测Fe3+的工作相比 (表1) , 本方法检出限低, 线性范围宽。
图7 Janus AuNPs检测不同浓度Fe3+的照片和吸收光谱图 (A) , Janus AuNPs检测1 mmol/L Fe3+的扫描电镜图 (B) 与检测不同浓度Fe3+时的吸光度比值与浓度的动态响应范围 (C)
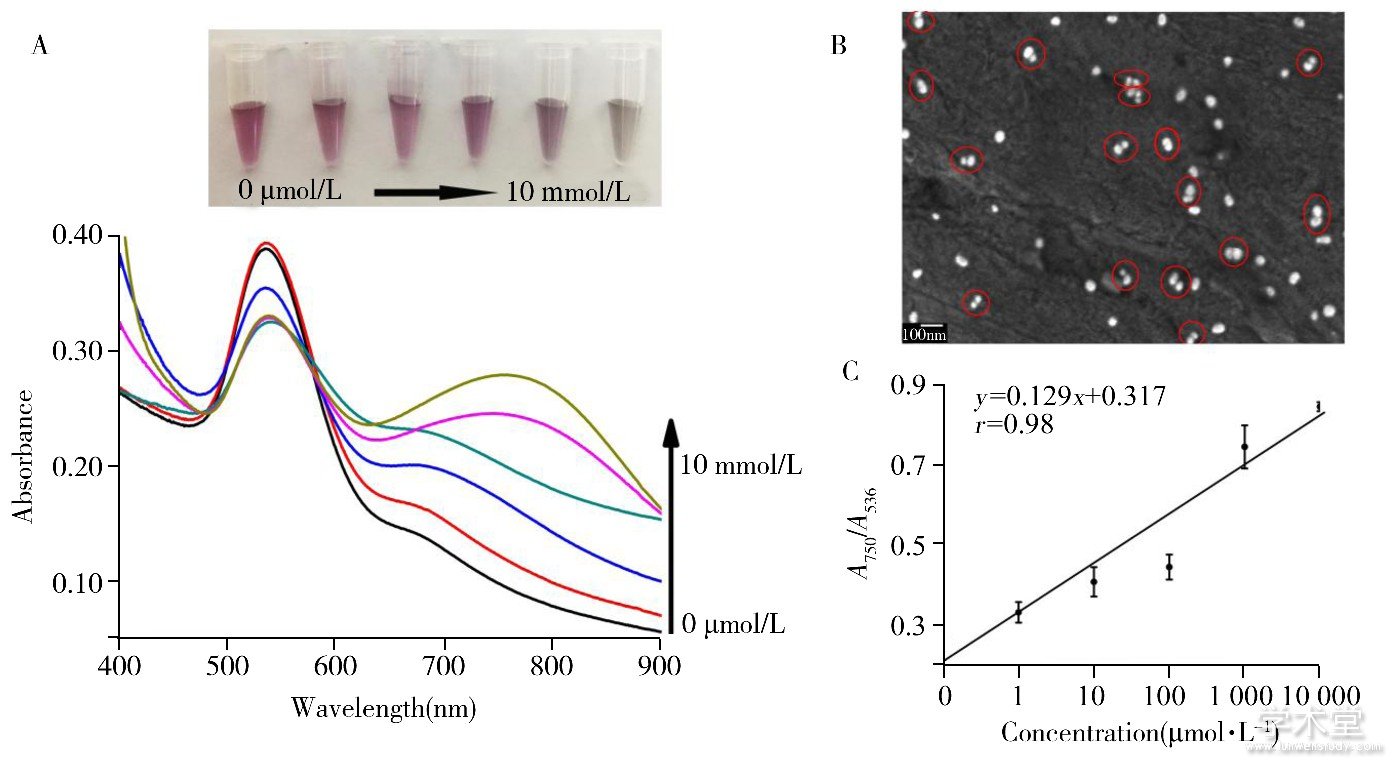
Fig.7 Photographs and absorption spectra of Janus AuNPs after the addition of different concentrations of Fe3+ (A) , the representative SEM image of Janus AuNPs for detection of 1 mmol/L Fe3+ (B) and the calibration curve of absorption ratio versus concentrations of Fe3+ (C)
concentrations of Fe3+:0μmol/L, 1μmol/L, 10μmol/L, 100μmol/L, 1 mmol/L, 10 mmol/L
图8 35 nm AuNPs (A) 和Janus AuNPs (B) 检测1 mmol/L Fe3+时吸收光谱随时间变化图及A750随时间变化动态趋势 (C)
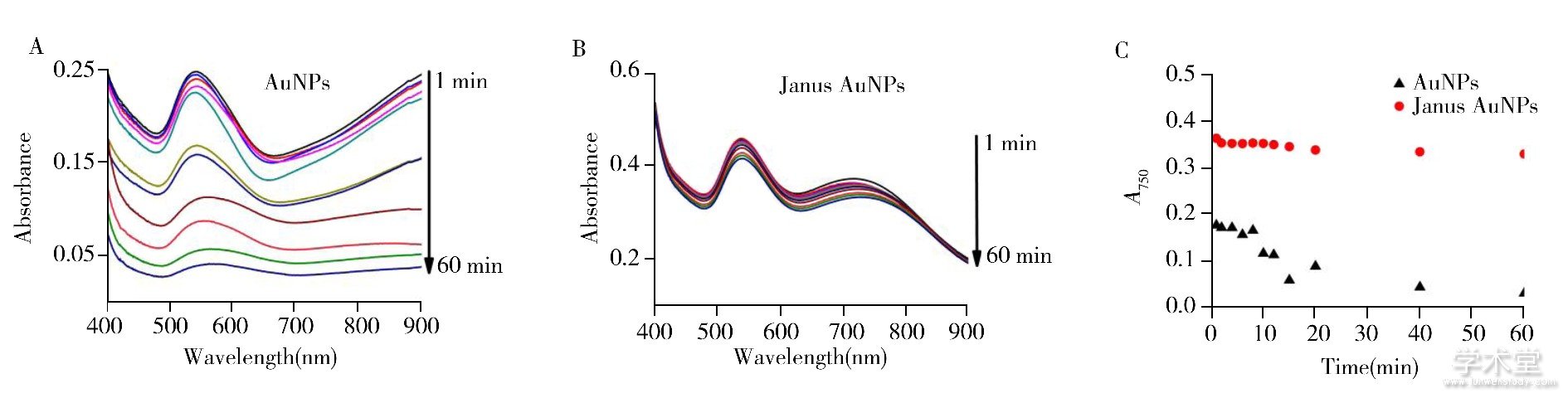
Fig.8 Absorption spectra of 35 nm AuNPs (A) and Janus AuNPs (B) along with time upon detection of 1 mmol/L Fe3+, and changes of A750 (C) corresponding to the absorption spectra of (A) and (B) , respectively
表1 利用纳米粒子比色传感器检测Fe3+的方法比较
3、 结 论
本文设计制备了一种新型的惰性PEG与柠檬酸根不对称修饰的大粒径Janus AuNPs比色传感器。该传感器可显着提高Fe3+检测的灵敏度, 比传统小粒径AuNPs的检出限降低500倍左右;其原理在于PEG基团占据了AuNPs表面的大部分位点, 剩余少量的柠檬酸根位点与Fe3+产生螯合, 在限域里诱导粒子发生定向可控聚集, 并形成寡聚体存在于溶液中, 从而显着提高了比色检测的稳定性, 并拓宽了线性范围。
参考文献
[1] Mehta V N, Kailasa S K, Wu H F.New J.Chem., 2014, 38 (4) :1503-1511.
[2] Tian J, Qian L, Asiri A M, Sun X, He Y.Sens.Actuators B, 2015, 216:453-460.
[3] Burdo J R, Connor J R.Biometals, 2003, 16 (1) :63-75.
[4] Yang L L, Zhu W J, Fang M, Zhang Q, Li C.Spectrochim.Acta A, 2013, 109:186-192.
[5] Liu J M, Wang X X, Jiao L, Cui M L, Lin L P, Zhang L H, Jiang S L.Talanta, 2013, 116:199-204.
[6] Chen Z, Lu D T, Zhang G M, Yang J, Dong C, Shuang S M.Sens.Actuators B, 2014, 202:631-637.
[7] Ghaedi M, Shokrollahi A, Kianfar A H, Mirsadeghi A S, Pourfarokhi A, Soylak M.J.Hazard.Mater., 2008, 154 (1) :128-134.
[8] Gao X, Lu Y, He S, Li X, Chen W.Anal.Chim.Acta, 2015, 879:118-125.
[9] Scheers N, Andlid T, Alminger M, Sandberg A S.Electroanalysis, 2010, 22 (10) :1090-1096.
[10] Yan Y Y, Che Z P, Yu X, Zhi X Y, Wang J J, Xu H.Bioorg.Med.Chem., 2013, 21 (2) :508-513.
[11] Ghosh S K, Tarasankar P.Chem.Rev., 2007, 107 (11) :4797-4862.
[12] Wu S P, Chen Y P, Sung Y M.Analyst, 2011, 136 (9) :1887-1891.
[13] Nomiya K, Yamamoto S, Noguchi R, Yokoyama H, Kasuga N C, Ohyama K, Kato C.J.Inorg.Biochem., 2003, 95 (2) :208-220.
[14] Guo L, Xu Y, Ferhan A R, Chen G, Kim D H.J.Am.Chem.Soc., 2013, 135 (33) :12338-12345.
[15] Thanh N T, Rosenzweig Z.Anal.Chem., 2002, 74 (7) :1624-1628.
[16] Kumar N, Seth R, Kumar H.Anal.Biochem., 2014, 456 (1) :43-49.
[17] Chen X Y, Ma R T, Ha W, Shi Y P.Sens.Actuators B, 2018, 274:668-675.
[18] Chen X Y, Ha W, Shi Y P.Talanta, 2019, 194:475-484.
[19] Jain P K, Kyeong S L, El-Sayed I H, El-Sayed M A.J.Phys.Chem.B, 2006, 110 (14) :7238-7248.
[20] Guo L, Kim D H.Biosens.Bioelectron., 2012, 31 (1) :567-570.
[21] Guo L, Ferhan A R, Lee K, Kim D H.Anal.Chem., 2011, 83 (7) :2605-2612.
[22] Tripathy S K, Ju Y W, Han C S.Sens.Actuators B, 2013, 181:114-118.
[23] Solanki J N.RSC Adv., 2013, 4 (3) :1341-1346.
[24] Memon S S, Nafady A, Solangi A R, Al-Enizi A M, Shah M R, Sherazi S T H, Memon S, Arain M, Abro M I, Khattak M I.Sens.Actuators B, 2018, 259:1006-1012.
[25] Bothra S, Solanki J N, Sahoo S K.Sens.Actuators B, 2013, 188:937-943.
[26] Buduru P, Raja R B C.Sens.Actuators B, 2016, 237:935-943.





