
发酵肉制品是指在自然或人工控制的条件下利用微生物发酵作用,产生具有特殊风味、色泽和质地,且具有较长保质期的肉制品。发酵剂在发酵肉制品生产中起着至关重要的作用。传统的发酵香肠是依靠原中天然存在的微生物之间相互竞争,使乳酸菌成为优料肉势菌群来生产的,因此,产品的安全性和品质均一性都难以保证。将纯种微生物作为发酵剂接种于发酵香肠中大大提高了产品质量和品质均一性。目前,肉制品的发酵剂研究在我国属于一个比较热门的领域。在肉制品成熟的过程中添加合适的发酵剂,对实现发酵肉工业化生产,缩短产品成熟期,对使产品特征标准化和安全化将起重要的作用。熏马肠原产自新疆伊犁,属于发酵肉制品,是哈萨克族风味食品之一。
其传统生产工艺属于自然发酵,所以发酵过程中微生物种类丰富,近年来因其营养丰富风味独特受到广大消费者的喜爱,但随着消费市场对熏马肠需求量的增加,其安全性问题也得到了重视,其中生物胺的含量是一项重要指标。生物胺是一类含氮的脂肪族、芳香族或杂环类有机化合物的总称。普遍存在于蛋白质含量丰富的发酵食品中,本实验室在前期的调查研究中发现自然发酵的熏马肠中生物胺总量超过 FDA 规定的 1000 mg/kg 限量标准,色胺、酪胺和亚精胺含量在不同程度上超过生物胺安全用量标准。因此,必须对熏马肠中生物胺的含量进行控制。胺氧化酶被认为是发酵肉制品发酵剂筛选的重要优良特性,能够催化胺的氧化脱氨,产物是醛、过氧化氢和氨,所筛选出的发酵剂还可以用在其它的发酵肉制品中,这对发酵肉制品的工业化生产和降低肉制品中的生物胺含量具有重大意义。
1 材料与方法
1.1 原料
44 种熏马肠样品(分别购于石河子、乌鲁木齐、昌吉、伊犁四个地区)。
1.2 试验设备与试剂
1.2.1 试剂MRS 培养基,MSA 培养基,VRBGA 培养基,营养琼脂培养基下层培养基:均在 MRS、MSA、VRBGA 培养基的基础上加入磷酸吡哆醛 0.05 g,琼脂 18 g。色氨酸、苯丙氨酸、组氨酸、赖氨酸、酪氨酸、精氨酸各 5 g,1000 mL 蒸馏水。pH 5.2,121 ℃高压灭菌 20 min。上层培养基:溴甲酚紫 0.06 g,琼脂 20 g,1000 mL蒸馏水。pH 5.2,121 ℃高压灭菌 20 min。细菌总DNA提取试剂盒(天根);溶菌酶(sigma);PCR 相关试剂盒,MarkⅢ,去离子水,丙烯酰胺,甲叉双丙烯酰胺(Sigma),尿素(Sigma),TRIS(Sigma),EDTA-2Na(Sigma),TE(Sigma),过硫酸铵(Sigma),盐酸二甲基对苯二铵盐酸盐,α-萘酚,无水乙醇。
1.2.2 主要仪器和设备灭菌锅,LDZX-40Ⅱ型立式自动电热压力蒸汽灭菌器;拍打式均质机;恒温培养箱,DNP-9272 型;超净工作台,SW-cg-2F.100 级;海尔冰箱;DGGE 电泳仪,美国 Bio-Rad 公司;凝胶成像仪,GelDoc 2000system Bio-Rad,美国;高效液相色谱仪,AgilentTechnologies 1200 series,日本岛津;色谱柱,EcilpseXDB-C18 4.6 mm×250 mm,5 μm;以及其它微生物实验常用培养皿、试管、移液枪、量筒、三角瓶、接种针、接种环、牛津杯。
1.3 试验方法
1.3.1 产生物胺氧化酶菌的分离纯化将不同地区的 44 个熏马肠样品取瘦肉在无菌条件下剪取 10 g,并在无菌条件下剪碎后放入装有 90mL 灭菌生理盐水的无菌均质袋中,均质机拍打 3 min后,各取 1 mL 分别用 MRS、VRBGA 和 MSA 的液体培养基对乳酸菌、肠细菌和葡萄球菌/微球菌在37 ℃条件下培养 24 h。
分别从富集培养液中取出 1 mL 培养液,逐级稀释后,再从 10-4、10-5、10-6中各取 200 μL 涂布于对应的产胺菌下层分离培养基上。37 ℃培养 48 h 后,无菌条件下,在下层培养基上倒上一层上层培养基(50 ℃)显色,并在 5 min 内记录实验结果,显紫色的为阳性(即产胺菌),不变色即黄色为阴性(即不产胺菌)。从显色培养基上将阴性菌落挑出,在其对应的培养基上分离纯化 3 次,然后于 4 ℃对应的斜面保藏备用。
1.3.2 氧化酶实验对阴性菌进行氧化酶试验,检验其是否具有氧化酶活性,其实验方法为:取白色洁净滤纸沾取菌落,加 1%盐酸二甲基对苯二胺溶液一滴,阳性呈现粉红色,并且逐渐加深,再加 1% α-萘酚乙醇溶液一滴,阳性于半分钟内呈现显蓝色,阴性于 2 min 内不变。阳性菌为所需菌株。
1.3.3 抑菌试验将已灭菌的营养琼脂培养基倒在培养皿内,每皿15 mL(下层),待其凝固。此外,将灭菌的营养琼脂培养基冷却到 50 ℃左右混入指示菌(分别为致病性大肠杆菌、单增李斯特菌、金黄色葡萄球菌),混合均匀后加 5 mL 到已凝固的培养基上待凝固(上层)。以无菌操作在培养基表面直接垂直放上牛津杯轻轻加压,使其与培养基接触无空隙,在杯中加入 200 μL 待检样品(菌悬液),勿使其外溢。置 4 ℃条件下扩散 4 h,37 ℃培养 16~18 h,观察结果,抑菌圈用游标卡尺直接量得。
1.3.4 耐盐耐亚硝盐试验试验方法参考文献。
1.3.5 细菌总DNA提取将纯化后的菌株接种到营养肉汤培养基中,培养24 h后,取1 mL菌液,1000 r/min离心10 min,倒去上清,取菌体沉淀(如沉淀较少,可重复上述操作),参照DNA提取试剂盒的步骤,提取样品总细菌的DNA。于-20 ℃条件下贮藏,以备PCR扩增使用。
1.3.6 PCR扩增 对所分离菌株的 16S rDNA 的 V6-V8 区段进行PCR 扩增,选用引物为:上游引物为:GC-U968(5′-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGAACGCGAAGAACCTTAC-3′)。下游引物为:L1401(5′-CGGTGTGTACAAGACCC-3′)。
PCR 反应为 25 μL 体系:1 μL 模板 DNA,上游引物和下游引物各 0.5 μL,HS MIX(东盛)12.5 μL,超纯水 10.5 μL。
PCR 反应程序:95 ℃预变性 10 min,35 个循环(95 ℃变性 30 s;56 ℃退火 30 s;72 ℃延伸 30 s),最终 72 ℃延伸 5 min。PCR 产物经 1.2%琼脂糖凝胶电泳检测后,-20 ℃冰箱保存以备 DGGE 使用。
1.3.7 变性梯度凝胶电泳(DGGE)剔除重复菌株DGGE采用Biorad Dcode apparatus电泳仪,聚丙烯酰胺凝胶浓度为8%(丙烯酰胺:甲叉双丙烯酞胺37.5:l)。变性梯度从40~60%,在0.5xTAE缓冲液中,先200 V电压预跑10 min,然后在85 V恒压下电泳16 h。电泳结束后,将DGGE胶片在超纯水(含0.5 μL/mL EB)中摇床染色15 min。再用超纯水脱色10 min后,用凝胶成像系统拍照。条带相同的菌株可认为是同一菌株,剔除重复。
1.3.8 高效液相(HPLC)验证菌种氧化生物胺能力
1.3.8.1 菌悬液的配制取筛选出的菌株经液体培养活化三次后分别接入到500 μg/mL含八种生物胺(色胺、酪胺、腐胺、苯乙胺、尸胺、组胺、精胺、亚精胺)的营养肉汤培养基中,37 ℃培养48 h后,分别取1 mL菌液加入0.4 mol/L高氯酸1 mL,于-20 ℃冰箱中保存、待测。
1.3.8.2 样品的柱前衍生取上述样品1 mL,加入200 μL2 mol/L NaOH使溶液呈碱性,再加入300 μL饱和NaHCO3溶液进行缓冲,然后再加入2 mL10 mg/mL的丹磺酰氯(Dns-Cl)丙酮溶液,使之在黑暗条件40 ℃反应,45 min后加入100 μL的NH3·H2O终止反应,去除残留的Dns-Cl溶液。用乙腈定容到5 mL,用0.22 μm滤膜过滤后装入样品瓶待测。
1.3.8.3 生物胺标准曲线的绘制准确称取色胺、酪胺、腐胺、苯乙胺、尸胺、组胺、精胺、亚精胺各50 mg,用0.4 mol/L的高氯酸定容到50 mL,并分别稀释为:5、10、25、50、100、200 μg/mL终浓度的混合标准溶液。取1 mL标准品的混合溶液,柱前衍生后(方法同上),利用高效液相测定其生物胺,以生物胺含量为横坐标,峰面积为纵坐标,绘制标准曲线。
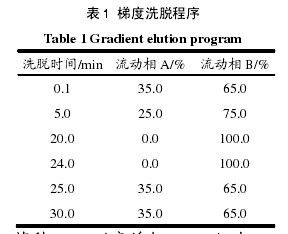
1.3.8.4 色谱条件Agilent C18 柱(5 μm,4.6 mm×250 mm);流动相 A 为水,流动相 B 为乙腈;流速为 0.9 mL/min;进样量:20 μL;柱温:30 ℃;检测波长:254 nm。【表1】
1.3.9 菌种DNA测序并与NCBI比对取菌种 DNA 的 PCR 产物送至三博远志公司测序,将测序结果与 NCBI 数据库中序列进行比对。
1.3.10 数据统计分析试验数据通过 SPSS 软件统计分析,采用 Origin8.0 作图,采用新复极差法分析,以 P<0.05 为差异显着,以 P<0.01 为差异极显着。
2 结果与讨论
2.1 分离纯化结果【图1.略】
通过 2.1 的实验方法,产胺菌与产生物胺氧化酶菌同时出现。选取产生物胺氧化酶的阴性菌株。即单层培养 48 h 后,倾入上层培养基显色,挑取显黄色的菌株分离纯化并保存。
根据显色情况,共分离出不产生物胺的菌:乳酸菌 95 株,葡萄球菌/微球菌 121 株,肠细菌 22 株。符合要求的菌株进行下一步试验。
2.2 氧化酶试验结果
通过1.3.2的方法进行氧化酶实验,得到先显粉色后显蓝色的阳性菌,共筛选出乳酸菌65株,葡萄球菌/微球菌97株,没有符合要求的肠细菌。符合要求的菌株进行下一步试验。
2.3 耐盐耐亚硝酸盐试验结果
比浊法可以测定液体培养基中微生物的生长数量,因此耐盐与耐亚硝酸盐的试验均采用紫外分光光度计在660 nm条件下,通过OD值的测定来比较。乳酸菌采用MRS液体培养基,葡萄球菌/微球菌采用MSA液体培养基。
耐盐试验中添加食盐的浓度为0、2%、4%、6%,将受试菌分别接入,37 ℃培养48 h后,测定其OD值,选取6%浓度条件下能较好生长的菌株。此外,HenryChin和Koehler研究表明NaCl含量在3.5%~5.5%范围时,可抑制组胺的形成。在肉类制品的加工过程中,硝酸盐、亚硝酸盐不仅有发色、增味的作用,还有抑菌的效果,尤其是对肉毒梭状芽孢杆菌有良好的抑制作用,目前尚无较好的替代品,但其使用剂量和使用范围都有严格的要求。本次试验中添加亚硝酸钠的浓度为0 g/kg、0.05 g/kg、0.1 g/kg、0.15 g/kg,将受分别接入,37 ℃培养48 h后,测定其OD值,选取0.15 g/kg条件下能较好生长的菌株。通过上述试验,共筛选出乳酸菌49株,葡萄球菌/微球菌72株。符合要求的菌株进行下一步试验。
2.4 抑菌结果
根据1.3.3的试验方法,测定选取抑菌圈大小为10mm以上的菌株,共得出乳酸菌21株、葡萄球菌/微球菌31株,符合要求的菌株进行下一步试验。试验效果如图2所示,结果见表2。【表2.图2.略】
在本次试验中发现抑菌试验的过程中先在4 ℃条件下扩散4 h后,再进行培养,抑菌效果显着提高,可能是因为4 ℃冰箱放置,使菌液可充分扩散到培养基中,还可一定程度上抑制了指示菌的生长繁殖,而此对抑菌作用有正向协同效果。所以经扩散后再置于培养箱中培养,就不会出现受试菌还没扩散完全,指示菌就已经开始生长的情况。
2.5 DGGE 指纹图谱剔除重复菌株提取细菌 DNA,用带 GC 夹子的引物进行 PCR扩增,产物经 1.2%琼脂糖凝胶电泳检测后,通过DGGE 剔除重复菌株,共得到不同菌株 12 株,图谱如图 3,不同菌株,其 DNA 不同,经同一引物扩增后产物片段长度相似,但其核苷酸序列不同,因此不同的双链 DNA 片段由于沿着化学梯度的不同解链行为将在凝胶的不同位置上停止迁移,所以可以才用DGGE 剔除重复菌株。此外,Hiroyuki等人研究表明,由于 DGGE 的特殊限制,同一条带中也有不同的DNA 片段,也就是不同片段的共迁移现象。但这对本试验的影响不大。【图3.略】
2.6 HPLC 验证结果将12株不同菌株分别接入到添加八种生物胺(浓度分别为500 μg/mL)的液体培养基中,37 ℃培养 48h,经柱前衍生后测定其生物胺减少量,结果显示有 6株菌对生物胺含量有不同程度的降低,6 株菌对色胺的减少能力均较强,其中 M3 的减少能力最强为 180.2μg/mL ;M1、M2、M3、M4、M5 对苯乙胺都有较好的氧化作用,M6 对苯乙胺的减少不显着,仅为 5.21μg/mL;6 株菌对腐胺都有较好的氧化减少能力,其中M1 最高为 238.65 μg/mL,M5 最低为 44.68 μg/mL;对尸胺的减少量在 87.7~174.19 μg/mL 之间;M2、M3、M4、M5 对组胺的氧化减少能力较强,M1、M6 对组胺的减少量相对较弱;对酪胺的减少最显着的为 M3,高达 171.73 μg/mL,但 M1、M5 对酪胺作用不显着,仅为 1.02 μg/mL,7.33 μg/mL;6 株菌对精胺和亚精胺的氧化减少能力均不显着。Roig-Sagués等研究报道,在香肠或是其他肉制品成熟期间,生物胺总量的增加主要是因为乳酸菌和肠杆菌科属中残余的脱羧酶活性。所以产生物胺氧化酶菌做为发酵剂,减少量脱羧酶的存在,并将能较好氧化生物胺。【图4-5.略】
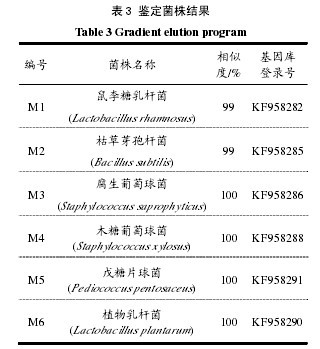
2.7 测序结果复筛得到6株菌的DNA经PCR扩增后,送去测序,测序结果与NCBI中基因库中已知序列进行比对,以同源性最高的序列构建系统发育树。由系统发育树可以看出M1菌株与Lactobacillus rhamnosus亲缘性最近,基因同源性为99%,该菌可定为乳杆菌属;M2与Bacillussubtilis亲缘关系最近,序列同源性为99%,形成一个簇群,可将该菌定为芽孢杆菌属;M3与Staphylococcusxylosus亲缘关系最近,序列同源性为100%,可将该菌定为葡萄球菌属;M4与Staphylococcus xylosus亲缘关系最近,序列同源性为100%,可将该菌定为葡萄球菌属:M5与Pediococcus pentosaceus亲缘关系为100%,说明M5为片球菌属;M6与Lactobacillus plantarum的亲缘关系达100%,所以M6是乳杆菌属。
6 株 菌 分 别 为 鼠 李 糖 乳 杆 菌 ( Lactobacillusrhamnosus),枯草芽孢杆菌(Bacillus subtilis),腐生葡萄球菌(Staphylococcus saprophyticus),木糖葡萄球菌(Staphylococcus xylosus),戊糖片球菌(Pediococcuspentosaceus),植物乳杆菌(Lactobacillus plantarum)。相似度均高于96%,如表3所示。【表3】
3 结论
对 44 种不同熏马肠样品中产生物胺氧化酶菌进行分离与筛选,筛选出有氧化酶特性,耐盐能力在 6%以上,耐亚硝酸盐能力在 0.15 g/kg 以上,对大肠杆菌,李斯特菌,金黄色葡萄球菌三种致病菌有良好的抑制效果的菌株,通过DGGE剔除重复菌株,并通过HPLC验证其减少生物胺能力,最终通过16S rDNA的V6-V8区段进行 PCR 扩增后测序,结果表明:本次试验共筛选出 6 株产生物胺氧化酶菌,分别为鼠李糖乳杆菌(Lactobacillus rhamnosus),枯草芽孢杆菌(Bacillussubtilis ), 腐 生 葡 萄 球 菌 ( Staphylococcussaprophyticus ), 木 糖 葡 萄 球 菌 ( Staphylococcusxylosus),戊糖片球菌(Pediococcus pentosaceus),植物乳杆菌(Lactobacillus plantarum)。本文通过对自然发酵熏马肠中生物胺氧化酶菌的筛选,可在后期的研究中将其作为发酵剂用于熏马肠的制作,为熏马肠的工业化生产和安全性提供了良好的理论依据。
参考文献
[1] 周光宏.畜产品加工学[M].北京:中国农业出版社,2002ZHOU Guang-hong. Animal by-products processing learning[M]. Beijing: China agriculture press, 2002
[2] 张微,李秀缺,张钟美.留意食品中生物胺的危害[J].监督与选择,2007,10:30-31ZHANG Hui, LI Xiu-que, ZHANG Zhong-mei. Pay attentionto the dangers of biogenic amines in food [J]. To Monitor andSelect, 2007, 10: 30-31
[3] 张海萍,李开雄,卢士玲,等.新疆熏马肠中生物胺含量的调查[J].食品与发酵工业,2012,38(11):152-156





