
散结止痛膏由重楼、白花蛇舌草、夏枯草、生川乌、生天南星、冰片等组成,具有消肿止痛,软坚散结之功效。用于乳腺囊性增生,乳痛症,男性乳腺增生症。按照国家药品临床试验管理规范( GCP) 对药物临床的相关要求[1 -2],由上海中医药大学附属龙华医院等 5 家单位,以中医理论为指导,采用多中心、随机、双盲、安慰剂对照的临床研究方法,以缓解疼痛为主要目的,评价中药敷贴,治疗具有周期性经前乳痛症的乳腺增生病( 冲任失调证) 的临床疗效及安全性。
1 研究对象与方法
1. 1 研究对象
1. 1. 1 诊断标准 参照《中药新药临床研究指导原则》[3]中有关乳腺囊性增生病诊断标准和 2002 年中华中医外科学会乳腺病专业委员会第八次会议通过的《乳腺增生病诊断标准》[4]中有关内容制订。
1. 1. 2 纳入标准 研究病例来源于 2010 年 10 月-2012 年 3 月,上海中医药大学附属龙华医院等 5 家三级甲等医院门诊患者,符合乳腺增生病诊断标准,具有周期性经前乳痛症; 中医辨证为冲任失调型; 18 ~ 50岁绝经前女性; 月经周期基本正常,自愿签署知情同意书者。
1. 1. 3 排除标准 符合乳腺增生病的诊断标准但不具备周期性乳房疼痛症状; 非冲任失调型乳腺增生病患者或辨证属冲任失调型但绝经者,月经周期严重不规则者; 合并乳腺部的恶性肿瘤、乳腺炎及其他有手术指征的乳腺疾病患者; 合并有严重的原发性疾病,或影响其生存的严重疾病( 如肿瘤或艾滋病) ,或精神或法律上的残疾患者; 既往曾行乳房整形手术; 卵巢切除者( 全部或部分) ; 其他疾病引起的胸前部及胸侧部疼痛; 妊娠或哺乳期妇女,或近 3 个月有怀孕计划者; 过敏体质,或已知对该药处方组成成分过敏者; 近一个月内参加其他临床试验的患者。
1. 1. 4 中止试验标准 试验过程中出现严重不良反应者; 在试验过程中发现所定临床试验方案有重大失误,难以评价试验效应或在实施过程中发生重要偏差,难以评价试验效应。
1. 2 研究设计
本研究根据循证医学原则,采取大样本、多中心、随机、双盲、安慰剂对照的试临床验设计方法,当受试者符合入组标准进入研究时,将纳入病例采用信封随机方法,分为治疗组、对照组两组。借助 SAS 统计软件 PROC PLAN 过程语句,给定种子数,确定段长,产生 350 例受试者所接受处理( 治疗组和对照组) 的随机安排,即列出流水号为 001 -350 所对应的治疗分配( 即随机编码表) .各中心指定专人负责分发试验药物,根据受试者就诊的先后顺序和试验药物编码按从小到大顺序逐例发药。同时为每个随机号准备一封应急信件,盲底一式两份,密封保存。统计资料前进行一级开盲,打开统计分析揭盲信封; 统计结束进行二级开盲,开出试验组和对照组。
1. 3 干预方案
1. 3. 1 试验组用药方案 中药敷贴
( 1) 研究药物名称: 散结止痛膏。药用组成: 重楼、白花蛇舌草、夏枯草、生川乌、生天南星、冰片。本品为淡棕色的片状橡胶膏,气香。大小: 10 cm ×6 cm .功效: 消肿止痛,软坚散结。
( 2) 研究药物规格。由广州白云山制药股份有限公司白云山何济公制药厂生产,采用统一包装及标签格式。外包装标签内容包括: 药物编号、规格、批号、有效期、贮存条件、生产企业、及“临床研究免费用药”字样。在课题承担单位上海中医药大学附属龙华医院负责监督下统一包装、编号和编盲,然后分送到各协作单位。
( 3) 研究药物方法。部位: 一侧乳房一贴,贴于乳房最痛处。贴敷方法: 揭去隔黏纸,贴于患处。注意粘贴紧密。
( 4) 研究药物疗程。用药时点: 月经干净后开始贴敷,隔日 1 次,每次6 ~8 h.疗程: 1 个月经周期为 1个疗程,共用 2 个疗程,月经期不用药。
1. 3. 2 对照组用药方案 本试验采用安慰剂对照
对照组采用外观气味手感等相同的中药模拟外用贴剂进行对照。散结止痛膏模拟剂由广州白云山制药股份有限公司白云山何济公制药厂提供,使外观气味相仿,制成与散结止痛膏同样大小厚薄的橡胶膏。用法同试验药。制品生产严格遵循 GMP 标准。在课题承担单位上海中医药大学附属龙华医院负责监督下统一包装、编号和编盲,然后分送到各协作单位。
1. 4 疗效与安全性观察
1. 4. 1 背景资料观察 试验前记录 1 次,包括人口学资料: 年龄、身高、体质量、月经、婚育等; 一般临床资料: 合并疾病及用药等; 一般体检项目: 血压、心率、脉搏、呼吸及神经系统检查等。
1. 4. 2 观察时点与指标 治疗疗程为 2 个月经周期,共用 2 个疗程,治疗前后观察安全性指标( 经前 7 ~14d) ; 筛选: 入组时、第 1 个月经周期( 经前 7 ~ 14 d) ; 治疗期: 第 1、2 个月经周期( 经前 7 ~ 14 d) ; 随访期: 用药结束后的第 1、2、3 个月经周期( 经前 7 ~ 14 d) ; 访视时间窗: ( 末次月经日期 + 上个或平均月经周期的天数 - 14) 到( 末次月经日期 + 上个或平均月经周期的天数 -7) .观察临床症状( 主症、次症、舌脉) 和体征( 肿块大小、质地、触痛) 的改善情况,进行乳腺彩超检查并存图备案( 乳腺肿块大小以触诊测值为准) .治疗前后进行血、尿常规和心电图、肝功能[谷丙转氨酶( ALT ) 、谷草转氨酶 ( AST) ]、肾功能[尿素氮( BUN) 、肌酐( Cr) ]等安全性检查,观察可能出现的不良反应。
1. 5 疗效评价标准
1. 5. 1 主要疗效指标 ( 1) 简式的 McGill 疼痛问卷表( short - form of McGill pain questionnaire,SF -MPQ) : ( 入组时、治疗第 1 疗程、治疗第 2 疗程、所有病例随访于停药 3 个月后,± 3 d,如时逢国家法定长假,可顺延 5 天) .由 11 个感觉类和 4 个情感类的描述词构成的疼痛评级指数( PRI) ,以及现时疼痛强度( present pain Intensity,PPI) 和视觉模拟评分法( VAS)组成。所有描述词均用 0、1、2、3 分别表示无痛、轻度痛、中度痛和重度痛。由此分类求出 PRI 或总的 PRI.
( 2) 视觉模拟评分法( VAS) : 采用美国国家卫生研究院临床研究中心的视觉模拟评分法( VAS) .0 表示无疼痛,数字越大,表示疼痛强度越大,10 表示最严重的疼痛。轻度疼痛: 0 < VAS≤4; 中度疼痛: 4 <VAS≤6; 重度疼痛: 6 < VAS≤10.
由患者根据乳房的最痛程度,在下面标尺对应位置画·点标注进行每天的疼痛记录。见图 1.

1. 5. 2 次要疗效指标
( 1) 高频彩色多谱勒安慰剂组超乳腺检查。治疗前后各检测 1 次,如时逢国家法定长假,可顺延 5 天。治愈: 乳房内低回声明显减小到消失,扩张的导管消失,腺体回声为中等强度。显效:局部增厚及结构紊乱的乳腺组织明显改善,< 1. 5 cm的结节消失。有效: 增厚的乳腺组织有所改善,结构紊乱也有所改善,液性暗区的数目减少,但大于 2 cm 以上的结节只缩小 1/2.无效: 腺体内异常回声无明显改善。
( 2) 雌激素水平检测: 治疗前后各检测 1 次,如时逢国家法定长假,可顺延 5 天。比较两组治疗前后血清雌激素水平均值是否有差异。
( 3) 中医临床疗效评价指标: 参考 2002 年中华中医外科学会乳腺病专业委员会第八次会议通过标准。
1. 5. 3 试验组计算治疗前后积分改善率标 改善率 = [( 治疗前总积分 - 治疗后总积分) /治疗前总积分]×100%1. 5. 4 安慰剂组疗效判定标准 治愈: 改善率 ≥90% ; 显效: 改善率 70% ~ 89% ; 有效: 改善率 30% ~69% ; 无效: 改善率 < 30% .
1. 6 观察指标
① 基线比较: 基线定义为用药前。描述基线时,记录基本信息及与疗效密切相关的内容并进行统计分析。② 安全性观察: 治疗前后检测血常规、尿常规、肝肾功能( AST,ALT,Cr,BUN) 、心电图。上述指标检测时间定义为治疗前后各检测 1 次,如时逢国家法定长假,可顺延 5 d) .③ 不良事件与合并用药: 对不良事件的发生时间、程度、相关处理措施、持续时间等信息及必要的处理措施等详细记录。所有不良事件都应追踪观察至正常或基本正常。对于合并用药,均应该如实的记入 CRF 表格中,包括用药时间、指征、剂量和疗程等信息。
1. 7 统计学方法
1. 7. 1 统计分析方法 本项研究采用多中心、随机、双盲、安慰剂对照的临床试验,属于优效性设计。两组对比分析,定性资料采用卡方检验,Fisher 精确概率法,Wilcoxon 秩和检验,CMH χ2检验。定量资料符合正态分布用 t 检验( 组间进行方差齐性检验,以 0. 05作为检验水准,方差不齐时选用 Satterthwaite 方法进行校正的 t 检验) ,不符合正态分布用 Wilcoxon 秩和检验。假设检验统一使用双侧检验,给出检验统计量及其对应的 P 值,以 P≤0. 05 作为有统计学意义,以 P≤0. 01 作为有高度统计学意义。
1. 7. 2 分析人群
( 1) 全分析集( FAS) : 是指所有经随机化分组,至少外用一次研究药品、且具有用药后评价数据的病例。FAS 集中疗效相关部分的缺失数据将采用之前最后一次观测数据结转( LOCF) 的方法进行补充。FAS 用于主要和次要疗效指标的分析,是本次研究疗效评价的主要数据集。
( 2) 符合方案集( PPS) : 指符合纳入标准并完成治疗方案的病例集合,即符合试验的治疗方案,主要变量可以测定,基线变量没有缺失,没有对试验方案的重大违反。PPS 是本次研究疗效评价的次要数据集。
( 3) 安全数据集( SS) : 所有随机化后至少接受一次治疗的受试者、具有用药后安全性评价数据的病例数据,构成本研究的 SS.
2 试验结果的分析
2. 1 一般资料分析
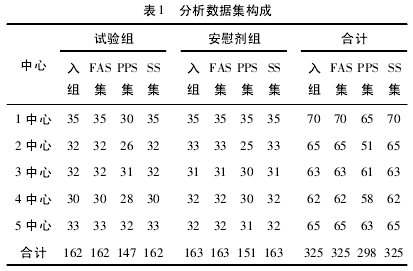
2. 1. 1 病例分布情况分析 本研究共入组 325 例( 试验组 162 例、安慰剂组 163 例) ,其中: 安全性分析集( SS) 325 例( 试验组 162 例、安慰剂组 163 例) 占入组病例的 100. 00%.全分析集( FAS) 325 例( 试验组162 例、安慰剂组 163 例) 占入组病例的 100. 00% .符合方案集( PPS) 298 例( 试验组 147 例、安慰剂组 151例) 占入组病例的 91. 69%.两组基线情况及人口统计学均均衡可比,见表 1.
2. 2 综合疗效分析
2. 2. 1 临床症状及体征疗效 散结止痛膏外敷能明显缓解乳房的疼痛症状,在改善乳房疼痛方面疗效优于对照组,两组比较在统计学上差异有显著性( P <0. 05) .在改善患者乳房结节方面,治疗组与对照组相比没有统计学差异( P >0. 05) .
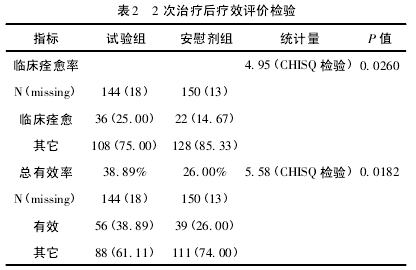
( 1) 2 次治疗后疗效评价。试验组总有效率为38. 89% ; 安慰剂组总有效率为 26. 00% .CHISQ 检验的 P 值为 0. 0182( <0. 05) ,组间比较差异有统计学意义,见表 2.
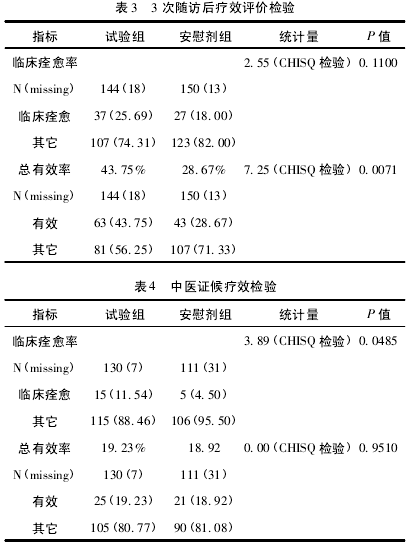
( 2) 3 次随访后疗效评价。试验组总有效率为43. 75% ; 安慰剂组总有效率为 28. 67% .CHISQ 检验的 P 值为 0. 0071( <0. 05) ,组间比较差异有统计学意义,见表 3.
2. 2. 2 中医证候疗效比较 试验组中医证候改善的总有效率为 19. 23%,安慰剂组中医证候改善的总有效率 18. 92%,两组比较差异无显著性意义 ( P >0. 05) ,两组疗效相近,改善不明显,见表 4.
2. 2. 3 雌激素水平指标分析 组间比较差异无统计学意义( P >0. 05) ,组内前后配比无统计学意义( P >0. 05) ,提示试验组与安慰剂组对于 E2的改善均不明显,见表 5.

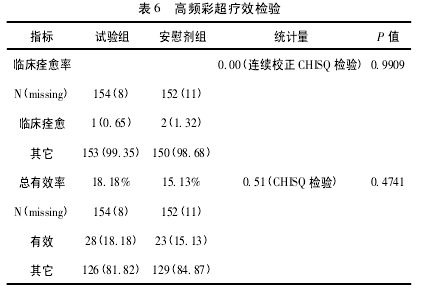
2. 2. 4 高频彩超疗效比较 试验 组总有效率为18. 18% ; 安慰剂组总有效率为 15. 13% .CHISQ 检验的 P 值 0. 4741( > 0. 05) ,组间比较差异无统计学意义,见表 6.
2. 2. 5 安全性评价 两组治疗后均有部分病人血、尿、肝肾功能、心电图检测结果出现异常,因果关系判断均无临床意义,与试验药物无关,提示两组药物均无明显的不良反应。
3 讨论
目前乳腺增生病的治疗西医是以激素为主,但不良反应较大,患者不宜接受。而中药煎剂或成药治疗,疗程较长,病人一般很难坚持,因此对于本病的治疗力求全方位、多靶点的给药,可通过转换给药途径,比如本课题所采用的中药敷贴膏剂 - 散结止痛膏,临床取得较好疗效。通过对 325 例乳腺增生病( 冲任失调证) 患者的多中心、随机、双盲、安慰剂对照的大样本临床试验,结果提示散结止痛膏对治疗乳腺增生病( 冲任失调证) 患者乳房疼痛的疗效优于安慰剂组,差异有统计学意义; 散结止痛膏能缓解乳房疼痛,与安慰剂组组间比较,差别均有统计学意义( P < 0. 001) ; 在随访的后续效应方面治疗组优于安慰剂组,但在提高中医证候疗效和疾病综合疗效方面较为欠缺。通过试验治疗作用和安全性的初步评价,散结止痛膏具有较好的止痛作用,乳房疼痛积分减少明显高于安慰剂组,不良事件发生率二组均较衡,无严重不良事件发生,受试者对外用散结止痛膏耐受良好。散结止痛膏对冲任失调型乳腺增生病具有较好的止痛作用,无明显的不良反应,是一种安全有效治疗乳腺增生病的药物。
参考文献
[1] 国家食品药品监督管理局。 药品注册管理办法[S]. 2002.
[2] 国家食品药品监督管理局。 药品临床试验管理规范[S]. 2003.
[3] 中华人民共和国卫生部。 中药新药临床研究指导原则( 第 3 辑)[S]. 北京: 中国医药科技出版社,1995: 50.
[4] 中华中医药学会外科乳腺病专业委员会。 乳腺增生病诊断、辨证及疗效评价标准[S]. 2002.





