
卵巢癌是妇科常见恶性肿瘤之一,其治疗以手术和化疗为主。随着治疗手段的提高,患者的生存率和生活质量也得到了一定程度的提高,但由于治疗效果仍不十分理想,其病死率仍居妇科恶性肿瘤之首。因此寻求有效的治疗方法仍然是卵巢癌的研究焦点。目前中药作为卵巢癌辅助治疗手段之一越来越受到重视。灵芝孢子在我国及其他亚洲国家已被公认为治疗多种疾病的中药,并且已有大量应用灵芝孢子治疗各种肿瘤的研究报道[1 -3]。本研究观察了在不同药物浓度下灵芝孢子对体外培养人卵巢癌细胞增殖与凋亡的影响,探讨其对人卵巢癌 OV2008 细胞生长抑制作用的机制,为其在卵巢癌的临床应用提供理论依据。
1 材料与方法
1. 1 材料
1. 1. 1 仪器: NU2600E 型 CO2培养箱( ESBE Scientif-ic MC017A1C ) ; 超净工作台 ( Microzone coinporationF40BX / SPZ41) ; EL340 酶 标 仪 ( Bio. TEK INSTRU-MENTS INS ) ; 倒 置 相 差 电 子 显 微 镜 ( ZEISSAXIOVERT25) ; 荧光显微镜( NIKON TE2000-U) ; 水浴箱( Fisher Scientific ISOTEMP 210) ; 离心机( SheltonScientific CENTRA CL2) ; 流式细胞仪( BD FACS cali-ber: BD BIOsciences E97600092) 。
1. 1. 2 试剂与药品: 灵芝孢子粉由加拿大 energene 天然药品有限公司提供,批号为 083668。WST-1/ECS 溶液为 Roche 公司产品; RPMI 1640 培养基为 FisherScientific 公司产品、新生小牛血清、Hoechst 33258 为Invitrogen 公司产品; 青链霉素( 含 10 000 U 青霉素及10 000 微克链霉素) 为 Invitrogen 公司产品,批号为15140-148。台盼兰( Trypan blue) EMD 公司产品,批号EM8721-0; Trypsin、碘化丙啶 ( PI ) 、核糖核酸酶 A( RnaseA) 多聚甲醛溶液( Paraformaldehyde) 、为 Sigma公司产品; Bax、bcl-2、cleaved-casepase3 抗体为 cell sig-naling Technology 公司产品; p27Kip1 抗体为 BD Bio-science 产品。抗鼠及抗兔二抗购于 Fisher Scientific 公司。ECL 化学发光试剂盒及感光胶片为 GE 公司产品。
1. 2 方法
1. 2. 1 细胞来源及培养: 人卵巢癌细胞系 OV2008 为完成该实验的加拿大 york 大学生命科学系 chun peng实验室保存。用含 10% 胎牛血清( Sigma 公司产品) 、1% 青霉素链霉素( Invitrogen 公司产品) 的 RPMI 1640培养基( Thermo 公司产品) ,在 37℃,5%CO2培养箱中培养。
1. 2. 2 灵芝孢子粉工作液配制: 灵芝孢子粉由加拿大energene 天然药品有限公司提供。 将灵芝孢子粉500 mg溶于 10 ml DD-H2O 中配制成 50 mg / ml 的灵芝孢子液,高温灭菌、促溶,静置或离心后取上清,用0. 20 μm 微孔滤膜过滤器过滤除菌,即刻用于实验或作为储存液密封置于 4℃冰箱,保存 2 周,再次使用前70℃ 孵育 10 min。
1. 2. 3 WST-1 法检测灵芝孢子粉对人卵巢癌细胞增殖的抑制作用: 取对数生长期的 OV2008 细胞,0. 2%Trypsin 消化后,以每孔 4 000 个细胞接种于 96 孔培养板,培养过夜后试验组分别加入浓度为 0. 1、0. 5、1、2、2. 5 mg / ml 的灵芝孢子液,每个浓度设 5 个复孔,对照组 5 个孔同时更换培养液,分别于 24、48 h 进行比色检测细胞活力。按照试剂盒说明书于每一时间点每孔中加入 10 μl WST-1/ECS 溶液,培养箱培养30 min,充分振荡 1 min,酶标仪测定波长为 450 nmOD 值,计算药物对细胞生长的抑制率,细胞抑制率 =1 - 试验组平均 OD 值/对照组平均 OD 值 × 100%。IC50 用 Logit法计算。
1. 2. 4 细胞计数法检测灵芝孢子对人卵巢癌细胞生长抑制作用: OV20008 细胞消化后以每孔 10 × 104个细胞接种于 12 孔培养板,培养过夜后试验组分别加入浓度为 0. 1、0. 5、1、2 mg/ml 的灵芝孢子液,每个浓度设 3 个复孔,对照组 3 个孔加入不含药物的培养液。48 h 显微镜下拍照各组细胞形态,之后收获细胞,消化细胞后以 1∶ 1比例与台盼兰混合,光学显微镜下死亡细胞被染成蓝色,而存活细胞因有完整细胞膜存在不被染色,镜下用细胞计数器计数未染色的活细胞数目。
1. 2. 5 流式细胞技术测定卵巢癌细胞细胞周期分布:
取对数生长期的卵巢癌细胞系 OV2008,消化后接种100 × 104个细胞于6 cm 细胞培养板,培养过夜后实验组吸去原培养液,分别置入终浓度为 0. 5、1、2 mg/ml的灵芝孢子粉溶液,对照组加入不含药物的培养液,培养 24、48 和 72 h,收集细胞。0. 2% Trypsin 消化后离心,弃去上清液,1 × PBS 5 ml 洗涤后以 70% 冷乙醇固定,冰上放置 30 min 后直接上机测定或保存于 -20℃冰箱待测。上机前离心弃去冰乙醇,PBS 洗 2 次后以预染溶液( 0. 2% Triton-100、1 mmol/L EDTA) 洗涤一次,加 50 μg/ml 核糖核酸酶 A ( RnaseA) 及 50 μg/ml碘化丙啶( PI) ,避光染色60 min,经200 目尼龙网过滤后,用流式细胞仪测定,计算出细胞周期分布情况。
1. 2. 6 Hoechst-33258 染色方法评估细胞凋亡: 采用Hoechst-33258 染色方法评估细胞凋亡,接种 50 × 104个细胞于 6 cm 细胞培养板,培养过夜后,以不同浓度灵芝孢子处理细胞,48 h 后对照组和实验组细胞分别吸掉培养液,以4%的多聚甲醛溶液( 用1 × PBS 配制)固定细胞 20 min,1 × PBS 洗涤后以 1 μg/ml 的 Ho-echst-33258 染色 15 min,1 × PBS 洗涤 2 次,荧光显微镜( NIKON ECLIPSE TE 2000-U) 下通过紫外光观察细胞核的改变。
1. 2. 7 Western blot 方法测定 bcl-2 和 Bax,cleaved-caspase3,P27 蛋白表达: 人卵巢癌细胞 OV2008 以每孔 25 ×104个细胞数接种于 6 孔板,次日加入相应剂量的灵芝孢子粉溶液,对照组同时更换培养液,48 h提取总蛋白。细胞用冷 PBS 洗涤 2 次,用 50 μl Rapa裂解液( radioimmune precipitation assay buffer) 裂解细胞,冰上 30 min 后刮取细胞,以 12 000 r/min 4℃离心15 min,收集上清移入新的 1. 5 ml 离心管中,测定蛋白浓度。取 20 μg( cleaved casepase-3 取 50 μg ) 蛋白样品经 12% SDS-聚丙烯酰胺凝胶( 检测 cleaved case-pase-3 用 15% SDS-聚丙烯酰胺凝胶) 90V 电压进行电泳分离,之后电转移至硝酸纤维素滤膜( Millipore 公司产品 ) 上,用 含 有 50 g/L 去 脂 奶 粉 的 TBST( 10 mmol/L Tris-Cl ( pH 值 8. 0) ,150 mmol/L NaCl,0. 05% Tween 20 ) 封闭 1 h,分 别加入抗 bcl-2 ( 1 ∶1 000) ,bax( 1∶ 4 000) ,cleaved-caspase-3( 1∶ 500) ,P27( 1∶ 1 000) 的抗体( cell signaling Technology 公司产品)4℃ 反应过夜,T-BST 漂洗 3 次,每次 10 min。HRP 标记的抗兔 IgG 二抗孵育 1 h; T-BST 漂洗 3 次,应用ECL-plus Western Blot 化学发光试剂盒显色检测信号。以 β-actin 为内参照。
1. 3 统计学分析 应用 Sigmastat 3. 5 统计软件,计量资料以 x ± 表示,采用 t 检验,两组以上均数比较应用单因素方差分析,P <0. 05 为差异有统计学意义。
2 结果
2. 1 灵芝孢子抑制卵巢癌细胞增殖 WST-1 比色法显示,灵芝孢子对卵巢癌 OV2008 细胞具有明显的生长抑制作用,柱状图显示活性细胞较对照组明显减少,灵芝孢子作用 48 h 的 IC50 为( 1. 30 ± 0. 56) mg/ml。采用不同浓度的灵芝孢子处理接种于 12 孔培养板的OV2008 细胞 48 h,倒置显微镜下观察到细胞数目随浓度增加而减少,高浓度灵芝孢子组可见细胞脱离培养皿壁成悬浮状态,致贴壁存活细胞数目极少( 图2A) 。图 2B 为细胞计数结果,提示随灵芝孢子浓度增加存活细胞数目逐渐减少。见图 1、2。
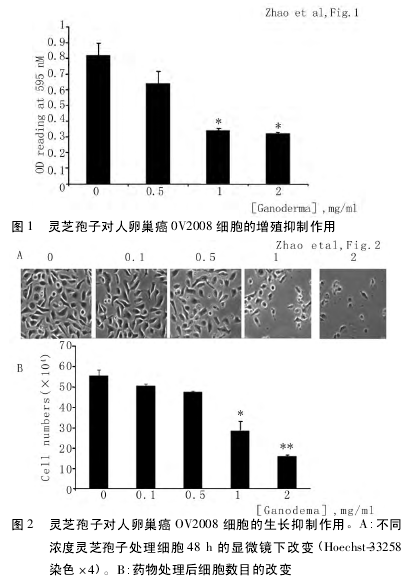
2. 2 灵芝孢子对卵巢癌细胞周期分布的影响 本研究应用流式细胞技术检测灵芝孢子作用于卵巢癌细胞后细胞周期的分布,灵芝孢子处理 OV2008 细胞后多数细胞聚集于 G1 期,并且 G1 期细胞数目随作用时间延长而增加。而 S 期和 G2/M 期细胞数目较少,且 G2/M 细胞随作用时间延长而减少,S 期细胞数目随作用时间无明显改变。见图 3。
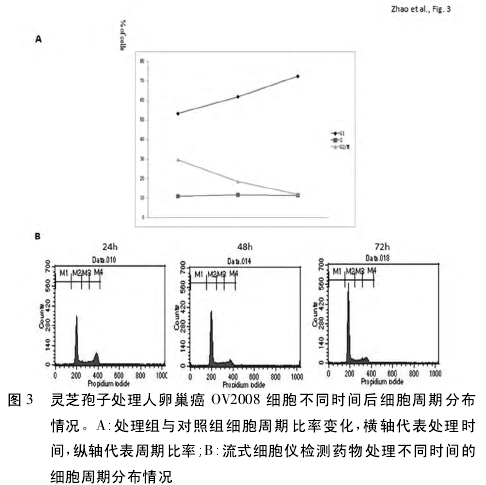
2. 3 灵芝孢子诱导卵巢癌细胞凋亡 为明确灵芝孢子是否通过凋亡途径致卵巢癌细胞死亡,采用Hoechst-33258 染色方法检测卵巢癌细胞凋亡情况。结果显示灵芝孢子可致卵巢癌细胞凋亡,并呈剂量依赖性。荧光显微镜观察到典型凋亡细胞染色后表现为细胞核缩小,染色质浓缩,药物浓度越大凋亡细胞越多。见图 4。
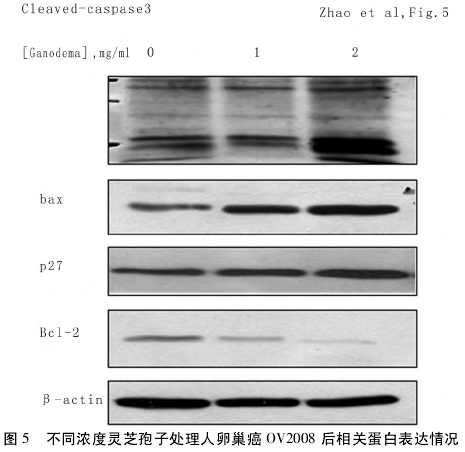
4 灵芝孢子对卵巢癌细胞相关蛋白的表达 灵芝孢子对 bcl-2 和 Bax 蛋白表达的影响: 为明确灵芝孢子引起卵巢癌细胞凋亡的信号通道,利用灵芝孢子处理后细胞的蛋白质测定了 bcl-2 和 Bax 的表达情况。结果表明随灵芝孢子浓度增加 bcl-2 蛋白表达水平降低,而 bax 蛋白水平升高灵芝孢子对 P 27 蛋白表达的影响: 为了阐明灵芝孢子对卵巢癌细胞细胞周期影响的机制,采用 western blot 方法测定了 P27 的变化。结果显示 P27 蛋白水平随灵芝孢子浓度增加而增加。灵芝孢子对 Casbase-3 蛋白表达的影响: 为了评估 Casbase-3 在灵芝孢子引起卵巢癌细胞凋亡中的作用,检测了Casbase-3 蛋白在卵巢癌细胞的表达情况。Westernblot 结果显示 35KD 的 Casbase-3 被激活成活化的 19、20 kD 的 cleaved-casepase3,并随灵芝孢子浓度增加表达呈升高趋势。见图 5。
3 讨论
灵芝孢子是灵芝生长成熟期从菌盖弹射出来的象淡雾状的极其微小的孢子,其主要成分有灵芝多糖、三萜类化合物、生物碱类、多肽及微量元素锌、锗、硒等,有其发挥强大生理功能的重要分子学基础。体内外研究表明灵芝孢子可以抑制多种肿瘤的生长[4 -6]。并有实验表明灵芝破壁孢子较完整孢子有更高的生物活性[7]。因此本研究采用破壁的灵芝孢子作为处理因素,用不同浓度的破壁灵芝孢子处理卵巢癌细胞株OV2008 不同时间,观察到灵芝孢子可以抑制卵巢癌细胞生长,使细胞生长阻滞于 G1 期; 并能通过上调Bax,caspase-3 及下调 bcl-2 蛋白途径诱导细胞凋亡。
卵巢癌细胞 OV2008 加入不同浓度的灵芝孢子作用 48 h 可以观察到细胞生长受到抑制,表现为细胞变圆,部分细胞脱离培养皿呈漂浮状态,这种抑制作用呈剂量依赖性,灵芝孢子浓度的增加,对 细胞的增殖抑制作用增强,半数抑制浓度为 1. 0977 mg/ml。通过DNA 特异性结合的荧光染料 Hoechst33258 染色观察到灵芝孢子作用于卵巢癌细胞后出现典型的凋亡细胞染色质聚集改变。提示灵芝孢子可以通过周期阻滞和诱导凋亡途径发挥增殖抑制作用。
灵芝孢子对肿瘤细胞周期的影响有不同的报道,Zhu 等[2]的研究表明灵芝孢子的酒精提取物可以使宫颈癌 HeLa 细胞停滞于 G1/S 期,Hu 等[8]在乳腺癌MCF-7 细胞的研究得到同样的结果。灵芝孢子的水提取物作用于 hepatoma 细胞可以引起细胞 G2/M 期捕获[9]。不同的结果可能由于不同的提取方法造成提取物成分有所差异所致[10]。本研究结果提示灵芝孢子作用于 OV2008 细胞 48 h 后,可使细胞周期的分布发生明显变化,使停滞于 G1 期的细胞比例明显增多并随灵芝孢子作用时间而逐渐增加。表明灵芝孢子对OV2008 细胞的增殖抑制作用可能与多数肿瘤细胞停滞于 G1 期,减少了 DNA 合成和有丝分裂有关。
P27 属于 CKIs 类蛋白,能广泛抑制 cyclinD / CDK复合物的活性,使细胞发生 G1 ~ S 期阻滞,从而对细胞周期发挥负调控作用[11,12]。本研究结果显示灵芝孢子处理 OV2008 细胞后 P27 蛋白表达水平随灵芝孢子浓度增加而逐渐升高,与细胞周期的变化相一致。推测灵芝孢子通过 P27 调控细胞周期。
抑制肿瘤的重要途径之一是诱导凋亡,bcl-2 家族中的 bcl-2 和 Bax 是调控凋亡的重要基因,细胞中 bcl-2 可以抑制细胞凋亡,而 bax 可以促进凋亡[13],它可以与自身或 bcl-2 形成二聚体,从而抑制 bcl-2 活性,促进细胞凋亡发生[14]。P27 可以通过调控细胞周期而诱导细胞凋亡[15]。本研究中卵巢癌细胞经灵芝孢子处理后 Bax、P27 蛋白表达水平升高而 bcl-2、bcl-xl 表达水平下降,可能是引起细胞凋亡的机制之一。
Casepase 家族是凋亡过程中的效应蛋白,活化的casepase-3 能通过蛋白酶的水解进行细胞内信号的转导。其中 casepase-3 是 casepase 家族中最重要的凋亡执行者,广泛分布于各种类型的细胞中。Casepase-3在细胞中是以无活性的酶原( 32 kD) 形式存在,活化的 Casepase-3 ( 17 kD 和 19 kD) 能促进凋亡信号的转导。研究表明,细胞凋亡信号转导的关键是凋亡下游蛋白 casepase-3 的激活,裂解相应的胞浆胞核底物最终导致细胞凋亡[16]。灵芝孢子处理 OV2008 细胞48 h可产生活化的 Casepase-3,并且其表达水平随灵芝孢子浓度增大而升高,因而灵芝孢子可能通过 casepase-3的信号途径诱导凋亡的发生,从而发挥抑瘤效应。与Ibrado 等[17]研究的抑瘤效应机制相一致。
综上所述,体外实验表明灵芝孢子可以抑制卵巢癌 OV2008 细胞的增殖并诱导其凋亡,其诱导凋亡的机制可能与 Bax、P27 的高表达、bcl-2、bcl-xl 的低表达、激活卵巢癌细胞中 Caspase-3 的表达以及阻滞细胞周期有关。可以为灵芝孢子作为卵巢癌的辅助治疗提供理论依据。
参考文献
1 赵旭东,杨新林,陈霖,等. 灵芝孢子中抗肿瘤成分的提取与分离. 中国中药杂志,2000,25: 288-290.
2 Zhu HS,Yang Xl,Wang LB,et al. Effects of extracts from sporoderm-bro-ken spores of Ganoderma lucidum on HeLa cells. Cell Biol Toxicol,2000,16: 201-206.
3 Calvino E,Manjon Jl,Sancho P,et al. Ganoderma lucidum induced apop-tosis in NB4 human leukemia cells: involvement of Akt and Erk. J Ethno-pharmacol,2010,128: 71-78.
4 张群豪,林志彬. 灵芝多糖 GL-B 的抑瘤作用和机制研究. 中国中西医结合杂志,1999,19: 544.





