
急性肺损伤( acute lung injury,ALI) 是由多种原因引起的以肺泡毛细血管膜通透性增高为特征的肺损伤,是临床重症监护患者主要的死亡原因,病死率达到30% ~ 50%[1 -3]。ALI 病因复杂,多种疾病可并发ALI,致病环节众多,其中过度失控的炎性反应和促炎、抗炎反应失衡是该疾病的主要发病机制,炎性细胞因子和趋化因子间的复杂网络调控在启动、放大和促进病理进程中起到重大作用[4],迄今仍无有效治疗ALI 的方法和药物。木犀草属属于黄酮类化合物,因最初从木犀草科木犀草属草本植物木犀草的叶、茎、枝中分离出而得名,是一种天然色素组分,具有很高的生物活性,如抗炎、抗氧化、抗肿瘤、免疫调剂、抑菌等作用[5]。木犀草素的抗炎作用与抑制炎性介质的释放与核因子 κB( nuclear factor κB,NF-κB) 介导的基因表达有关。本文旨在探讨木犀草素对 ALI 是否有干预和保护作用及其在体内的可能作用机制。
1 材料与方法
1. 1 动物 健康雄性 ICR 小鼠,体重 18 ~ 22 g,上海西普尔-必凯实验动物有限公司提供,许可证号码:SCXK( 沪) 2008-0016。饲养于室温、充分给水和食物。
1. 2 试剂及药物 脂多糖 ( LPS) ( 大肠杆菌 O111: B4,Sigma 公司,076K4020) ; 木犀草素 ( Sigma 公司) ;地塞米松磷酸钠注射液( 金陵药业股份有限公司,080201) ; 戊巴比妥钠( 国药集团化学试剂有限公司,WS 20060401) ; 小鼠白介素-1β( IL-1β) ELISA 试剂盒( A6071384) 、IL-6 ELISA 试剂盒( A6071377) 、肿瘤坏死因子-α( TNF-α) ELISA 试剂盒( A6071379) 均购自R&D 公司; Braford 蛋白含量检测试剂盒、NF-κB p65Antibody、IκB-α Antibody、IκB-α ( Phospho-ser32 ) Anti-body、内参一抗( β-Actin) 、内参一抗( Lamin B) 、辣根过氧化酶标记的二抗均购于南京凯基生物科技发展有限公司; 其他试剂均为国产分析纯。
1. 3 主要仪器 动物肺功能分析系统 ( AniRes2005型,北京贝兰博科技有限公司) ; 酶标仪( 680 型,美国BIO-RAD 公司) ; 低温离心机( SH03014 型,美国科俊仪器公司) ; 超低温冰箱( 1500 型,日本 SANYO 公司) ,Western 电泳仪( 164-5051 型,美国 Bio-Rad 公司) ,分光光度计( UV-2540 型,日本 SHIMADZ 公司) 。
1. 4 方法
1. 4. 1 实验分组和模型的制备: 96 只小鼠随机平均分为两批,每批随机平均分为 6 组,分别为正常组、模型组、木犀草素低剂量组、木犀草素中剂量组、木犀草素高剂量组及地塞米松组,每组 8 只。木犀草素低、中、高剂量组于造模前 4 d 分别灌胃给予 25 mg/kg、50 mg / kg、100 mg / kg 的木犀草素,正常组和模型组均灌胃给予相同体积的 0. 9% 氯化钠溶液。小鼠腹腔注射 1%的戊巴比妥钠( 80 mg/kg) 后暴露气管,除正常组外,其 余 组 气 管 内 缓 慢 注 入 5% 的 LPS 溶 液( 5 mg/kg) ,造成小鼠急性肺损伤,正常组以相同方式注入相同体积的 0. 9%氯化钠溶液。
1. 4. 2 肺功能相关指标的检测 造模 6 h 后,取一批小鼠腹腔注射 1% 的戊巴比妥钠( 90 mg/kg) 深度麻醉,气管插管,将小鼠置于体描箱中。设置呼吸机的频率为 90 次/min,潮气量为 5 ml/kg,呼吸比为 15∶ 10。通过对动物气道压力( Press) 、肺容积变化( Volume) 的测量,计算出呼吸流速( Flow) 、平均吸气气道阻力( Ri) 、呼气气道阻力( Re) 、肺动态顺应性( Cdyn) ,经AniRes 2005 软件进行分析,40 min 后取出小鼠。
1. 4. 3 支气管肺泡灌洗液( BALF) 中细胞因子的测定: 取另一批小鼠,造模 3 h 后,结扎右肺,暴露气管并插管,向左肺注入 4℃ 0. 9% 氯化钠溶液 1 ml 进行支气管肺泡灌洗,重复 3 次。收集肺泡灌洗液并混匀,于4℃ 、1 500 r / min 离心 15 min。收集上清液,分装后保存于 - 70℃ 超低温冰箱中,ELISA 试剂盒检测检测IL-1β、IL-6 和 TNF-α 的浓度。
1. 4. 4 肺组织病理检测: 灌洗结束后,立刻取右肺上叶以 10%甲醛溶液固定,HE 染色,制作常规石蜡病理切片。观察肺泡壁有无增厚、充血、炎性细胞浸润,间质有无炎症、水肿,肺泡有无坏死、出血等情况。
1. 4. 5 Western blot 测定肺组织中 p65、IκB-α、pIκB-α的表达: 将 100 mg 右肺组织置于 0. 5 ml 冰预冷裂解缓冲 液 中,用 十 字 匀 浆 器 匀 浆,充 分 裂 解。4℃,13 000 g,离心 10 min,保留上清液。Braford 法测定上清液中总蛋白浓度后,进行 SDS-PAGE 电泳。转膜、封闭并加入相应的一抗( NF-κB p65 抗体,1∶ 400; IκB-α抗体,1∶ 200; pIκB-α 抗体,1∶ 200) 4℃孵育过夜。PBST漂洗后,将膜与 HRP 结合的二抗( 辣根过氧化酶标记抗体,1∶ 5 000) 室温下摇荡孵育 1 h。用 PBST 充分洗膜,然后将显影液加于 PVDF 膜上,室温放置 1 min。暗室中迅速曝光、显影、洗像。
1. 5 统计学分析 应用 SPSS 11. 5 统计软件,计量资料以 x± s 表示,采用单因素方差分析,P <0. 05 为差异有统计学意义。
2 结果
2. 1 木犀草素对肺功能的影响 造模 6 h 后,6 组小鼠的 Ri、Re 随时间的延长呈增长趋势,其中模型组的增长百分比涨幅最大,正常组涨幅最小; 6 组小鼠的Cdyn 随时间的延长呈下降趋势,其中模型组的下降百分比降幅最大,正常组降幅最小。木犀草素呈剂量依赖性的抑制 Ri、Re 的增长和 Cdyn 的下降。地塞米松也可明显抑制 Ri、Re 的增长和 Cdyn 的下降。见图 1。
2. 2 木犀草素对 BALF 中 IL-1β、IL-6 和 TNF-α 的影响 与正常组相比,模型组的 IL-1β、IL-6 和 TNF-α 均明显增加( P <0. 01) 。和模型组相比,地塞米松和木犀草素较明显的降低了 IL-1β、IL-6 和 TNF-α 等细胞因子的含量( 均 P <0. 01) ,其中,木犀草素 200 mg/kg组作用效果更显着。见表 1。
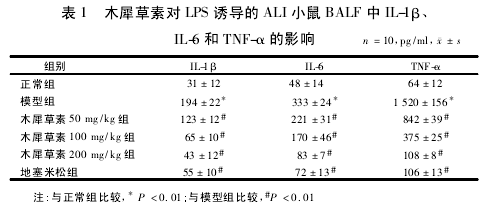
2. 3 木犀草素对 LPS 诱导的小鼠 ALI 的保护作用在解剖过程中发现,模型组肺部水肿严重,肺表面粗糙有出血点,且气管内有泡沫状分泌物流出,正常组无这些症状。组织病理切片可见,被感染的肺出现重度炎症,大量的中性粒细胞、巨噬细胞、淋巴细胞等炎症细胞浸润肺部。肺组织结构发生改变,肺泡腔大面积消失,肺泡壁增厚。木犀草素 200 mg/kg 组和地塞米松组病变较模型组有所改善,肺泡腔逐渐清晰,肺组织间炎性细胞浸润明显减轻。见图 2。
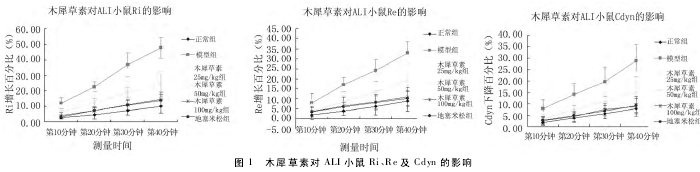
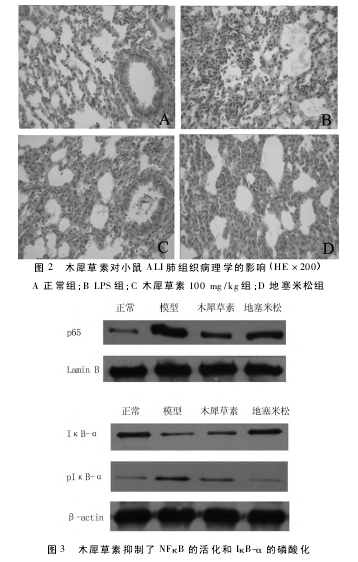
2. 4 木犀草素对肺组织中 p65、IκB-α、pIκB-α 的表达的影响 NFκB 信号通路调控了众多炎性细胞因子基因的表达,NFκB p65 和 IκB-α、pIκB-α 的 Western blot结果显示如图 3。造模 3 h 后,和正常组相比,模型组中 P65 的表达量显着提高; 和模型组相比,木犀草素和地塞米松不同程度的降低了 P65 的表达。进一步研究发现,ALI 模型组中启动炎性反应的 pIκB-α 表达量显着增加,IκB-α 表达量显着降低,而木犀草素和地塞米松却抑制了 pIκB-α 的表达,促进了 IκB-α 的表达。见图 3。
3 讨论
内毒素是革兰氏阴性细菌细胞壁外膜上的脂多糖( LPS) 成分,可作为抗原激活机体的免疫应答,激活白细胞,诱使 TNFα、IL-1β、IL-6 等炎性因子的释放[6]。LPS 直接作用于肺组织,破坏肺泡引起出血、肺水肿,使坏死组织、炎性细胞堆积,促使肺泡巨噬细胞和炎性反应链的激活,导致肺内炎性反应[7]。近年来,为研究吸入性急性肺损伤,动物模型大多数是用 LPS 气道穿剌滴入造模。来源于革兰阴性菌外壁的 LPS 滴注小鼠后,BALF 中细胞因子含量显着升高,毛细血管通透性增加和肺功能的变化等表明 ALI 造模成功[8,9]。后两项指标的变化可间接表明肺表面活性物质的代谢发生改变。
王旭光等[10]采用 ELISA 检测木犀草素对 PGE2生成的影响,结果发现木犀草素抑制 LPS 诱导的RAW264. 7 细胞 ( 小鼠单核 / 巨噬细胞系) PGE2 的生成,同时下调 LPS 诱导的 RAW264. 7 细胞环氧合酶 2( COX-2) 及 mPGES-1mRNA 和蛋白的表达,这可能是木犀草素抗炎的机制之一。范文辉等[11,12]通过建立哮喘气道重塑模型,分别使用地塞米松及木犀草素进行干预,观察支气管肺泡灌洗液中白细胞介素-5 和 γ干扰素水平的变化,得出结论木犀草素有显着的抗气道重塑作用。同时发现木犀草素抑制气道重塑的作用机制为抑制气道白细胞介质 13 受体 α2( IL-13Rα2) 的表达。张 毅 等[13]研 究 木 犀 草 素 对 LPS 诱 导 的RAW264. 7 细胞核因子 κB( NF-κB) 和 COX-2 表达及NF-κB DNA 结合活性的影响,结果发现木犀草素能显着性抑制 LPS 诱导的 RAW264. 7 细胞 PGE2 的生成,降低 NF-κB 的 DNA 结合活性,下调 LPS 诱导的RAW264. 7 细胞 COX-2mRNA、NF-κB 和 COX-2 蛋白的表达。这些研究结果提示,木犀草素可能对 ALI 具有保护作用。
本研究结果显示,木犀草素能明显抑制脂多糖诱导的急性肺损伤小鼠的 Ri、Re 增长和 Cdyn 降低,抑制BALF 中 IL-1β、IL-6、TNF-α 的释放,减轻了肺部病变,抑制了 NFκB p65 和 pIκB-α 的活化。这表明木犀草素对 LPS 诱导的小鼠急性肺损伤具有保护作用。
TNF-α 和 IL-1β 是 ALI 早期两个重要的前炎性因子[14]。在炎性反应初期,TNF-α 除能动员血循环中的PMN 向炎症部位聚集外,还能动员骨髓白细胞进入血液循环,同时激活内皮细胞。内皮细胞受 TNF-α 刺激时,释放 E 选素、L 选择素、细胞间黏附分子 1 和血管黏附因子 1 等黏附因子,进一步诱导 IL-1、IL-6、IL-8、CSF 等细胞因子的分泌,共同参与炎性反应。当 PMN被激活后,TNF-α 又能增强 PMN 的吞噬能力,促进PMN 脱颗粒和释放溶酶体,增强 PMN 呼吸爆发,产生大量脂质代谢产物,破坏毛细管内皮细胞的屏障功能,增加肺毛细血管的通透性,刺激内皮细胞释放大量组织因子,同时抑制纤溶活性,损害毛细血管的抗凝功能。这些促炎因子作为重要的信号因子,进一步启动、放大和延续全身或局部炎性反应,呈现级联反应,最终导致炎症失控。本研究表明木犀草素能明显的降低了TNF-α、IL-1β 和 IL-6 等 细 胞 因 子 的 含 量,其 中200 mg / kg作用效果更显着。
目前研究证实,与炎症和免疫反应关系密切的许多细胞因子、黏附分子基因启动部位均含有核因子NF-κB 位点。NF-κB 对细胞因子网络具有广泛的调控作用,能够调控多种细胞因子的基因转录。NF-κB 的主要形式为 p50 和 p65 组成的二聚体,p50 是与 DNA结合的部位,p65 参与基因转录的超始调节,p65 是NF-κB 的主要活性形式,并可促进 p50 与 DNA 结合,当 p65 与细胞质内抑制蛋白 IκB 结合,可掩盖 p50 上核定位信号,仅有 p65 蛋白 C 末含有转录激活区域,能够直接启动基因的转录[15,16]。NF-κB 一般存在于细胞质中,同 IκB 仅紧密结合,却不发挥作用。在 IL-1、TNF、LPS 等炎性介质作用下,细胞质内 IκB 激酶被激活,导致 IκB 被磷酸化,进而由蛋白酶降解,使 IκB发生降解、磷酸化,多聚体上的 IκB 分子的 2 个丝氨酸磷酸化、泛素化而降解,NF-κB 则从多聚体上释放,进入细胞核与 DNA 特定靶 κB 部位结合,调控特定基因转录[17]。本研究提示木犀草素保护急性肺损伤中降低了 P65 的表达同时抑制了 pIκB-α 的表达,同时促进了 IκB-α 的表达。本研究说明木犀草素对 NFκB 信号通路的调控在急性肺损伤的保护中起到了重要作用,是否和其他细胞信号通路有关目前尚不清楚,有待进一步研究。
参考文献
1 Matthay M A,Uchida T,Fang X. Clinical acute lung injury and acute re-spiratory distress syndrome. Curr Treat Options Cardiovasc Med,2002,4:139-149.
2 Vincent JL,Sakr Y,Ranieri VM. Epidemiology and outcome of acute re-spiratory failure in intensive care unit patients. Crit Care Med,2003,31:S296-S299.
3 Cepkova M,Matthay MA. Pharmacotherapy of acute lung in jury and theacute respiratory distress syndrome. J Intensive Care Med,2006,21: 188.





