摘要:以天麻块茎为供试材料,采用琼脂糖凝胶电泳检测和紫外分光光度含量测定技术,比较改良CTAB法和SDS-CTAB法提取天麻块茎基因组DNA的效果。结果表明,改良CTAB法提取天麻块茎基因组DNA的产量高于SDS-CTAB法,纯度略次于SDS-CTAB法,二者提取的基因组DNA,DNA结构完整、大片段的DNA分子含量高。该研究为天麻基因组DNA提取方法的选择提供了参考依据,为天麻种质资源的分子遗传研究奠定了一定的科学与技术基础。
关键词:天麻; 基因组DNA; SDS-CTAB法; 改良CTAB法;
Abstract:
Taking Gastrodia elata B1.tuber as material,agarose gel electrophoresis and ultraviolet spectrophotometry were used to compare the effects of improved CTAB and SDS-CTAB on genomic DNA from rhizoma tuber of G.elata.The results showed that the yield of genomic DNA extracted from G.elata tubers by improved CTAB method was higher than that by SDS-CTAB method,and the purity was slightly lower than that by SDS-CTAB method.The results provided a reference for selecting genomic DNA extraction methods of G.elata and laid a scientific and technical foundation for the molecular genetic research of G.elata germplasm resources.
Keyword:
Gastrodia elata B1.; Genomic DNA; SDS-CTAB method; Improved CTAB method

天麻为常用名贵中药,是兰科植物天麻(Gastrodia elata B1.)的茎块,植株生长于海拔400~3 200 m的林下、林中空地、林边缘及灌丛边缘,为国家二级保护植物。其根茎入药用以治疗头晕目眩、肢体麻木、小儿惊风癫痫抽搐等症,同时还具有刺激神经系统、健脑、延缓衰老、增强机体免疫力和预防骨质疏松等作用[1,2].因天麻特殊的生物学特性--没有一般植物所具有的叶片,加上含丰富的蛋白质、较高的多糖和酚类、酶类及其他次生代谢物,使得其基因组DNA的提取比较困难。传统的提取方法常常导致基因组DNA产量过低、杂质较多、DNA不纯、质量较难控制等许多问题,提取物仅可满足普通的分子生物学试验分析的需要,因此众多学者对中药材基因组DNA提取方法进行过探讨[3,4,5].关萍等[6] 对天麻基因组 DNA 提取方法进行了比较研究,认为SDS-CTAB 法是较理想的提取方法;张弦等[7]证明SDS-CTAB法提取DNA完整、纯度高、重复性好;程纪伦等[8]应用CTAB 法和改良的CTAB法提取天麻基因组 DNA,结果表明改良 CTAB 法提取的天麻基因组 DNA 产量高、纯度高。但是,提取天麻基因组DNA究竟采用改良 CTAB 法效果好还是SDS-CTAB法好,还有待考证。基于天麻基因组DNA提取方法的研究现状,笔者将应用改良 CTAB 法和SDS-CTAB法对天麻基因组DNA提取效果进行比较研究。
1 材料与方法
1.1 材料
供试天麻为采集于湖北、陕西等地区的新鲜天麻,由湖南省博世康中医药有限公司提供。
1.2 主要试剂
1.2.1 改良CTAB法主要试剂。
CTAB,氯仿∶异戊醇(24∶1),RNase A,异丙醇,无水乙醇,TE.
1.2.2 SDS-CTAB法主要试剂。
β-巯基乙醇,蛋白酶K,SDS, CTAB,氯仿∶异戊醇(24∶1),RNase A,NaAc,无水乙醇, TE.
1.3 方法
1.3.1 改良CTAB法。
取天麻细小块状物约0.5 g放入研钵中,加入1 mL预热的 CTAB提取液,研磨;将细粉末转移到1.5 mL的Eppendorf管中,再加CTAB提取液至1.5 mL,置于65 ℃水浴中保温1 h;从水浴中取出离心管,冷却至室温,再12 000 r/min离心10 min,然后吸取上清液放至另一干净已灭菌的1.5 mL Eppendorf管中,同时加入同样体积的氯仿∶异戊醇(24∶1),轻缓颠倒混匀,12 000 r/min离心5 min,然后吸取上清液放至另一干净已灭菌的1.5 mL Eppendorf管中,同时加入同样体积的异丙醇,混匀,放置在-20 ℃冰箱中60 min;12 000 r/min离心15 min获得DNA沉淀,70%乙醇洗2次,沉淀自然干燥;加入30 μL TE缓冲液或者去离子水(含有10 μg/mL RNase A)溶解DNA,并贮存在4 ℃冰箱中。
1.3.2 SDS-CTAB法。
将1.5 mL的Eppendorf管中装70 μL β-巯基乙醇,置于-20 ℃冰箱中预冷,取天麻细小块状物约0.5 g,置于预冷的离心管中,同时快速加入40 μL 10 mg/mL蛋白酶K,混合;加入56 ℃预热SDS 700 μL,混匀, 56 ℃水浴120 min,然后取出,冷却至室温,加入1/2体积100 g/L CTAB,56 ℃水浴30 min,取出,冷却至室温,再12 000 r/min离心10 min,然后吸取上清液放至另一干净已灭菌的1.5 mL Eppendorf管中,同时加入同样体积的氯仿∶异戊醇(24∶1),混合30 min,12 000 r/min离心12 min,取上清液重复操作一次。取上清液至另一无菌Eppendorf管中,加入-20 ℃预冷的1/10体积3 mol/L NaAc和2倍体积无水乙醇,置-20 ℃冰箱中沉淀60 min,12 000 r/min离心10 min.用70%冷乙醇洗涤沉淀2次,每次12 000 r/min离心10 min,沉淀自然干燥;加入30 μL TE缓冲液或者去离子水(含有10 μg/mL RNase A)溶解DNA,并贮存在4 ℃冰箱中。
1.4 基因组DNA的电泳检测
1.4.1 配制1%琼脂糖凝胶。
用电子天平称取琼脂糖粉1 000 mg,置于锥形瓶中,加入1×TBE溶液100 mL,充分摇匀,将该锥形瓶直接加热至TBE溶液沸腾,煮沸20 s,视觉判断琼脂糖粉完全溶解,取出加入一滴EB(约20 μL),缓慢摇匀后,自然降温至55 ℃左右(以不烫手背为宜)。然后,放置好制胶器,插好挡板,按要求在固定处放好梳子,再将溶液缓缓倒入胶槽,室温下放置1 h左右,待凝胶冷却凝固后,轻轻移去梳子,去掉挡板,将凝胶板置于含有TBE缓冲液的水平电泳槽中。
1.4.2 上样。
取2 μL上述2种方法提取的DNA混入少量的溴酚蓝(大约是样品量的1/10),混匀后全部点入梳子孔内,注意留出第一孔位置加入等量的DNA分子量标记。
1.4.3 恒压电泳。
接通电源后,调节电压至100 V,启动电泳,恒压电泳1.5~2.0 h,根据溴酚蓝距离点样孔的位置来判断电泳进程。
1.4.4 拍照。
将凝胶从凝胶板上取下,采用凝胶成像仪拍照。
1.5 DNA的紫外检测
蛋白质的最大吸收波长为280 nm,核苷酸为 260 nm,测波长分别为 260、280 nm 时的 OD 值进行比较,分析DNA的浓度和纯度。先用2 mL双蒸水校正紫外分光光度计的零点,用微量移液器取DNA样品2 μL,加双蒸水稀释10倍并充分混匀后,全部转入专用比色皿中,分别读出其在不同波长下的OD值,然后计算DNA样品的浓度。DNA样品浓度(μg/μL)=OD260×核酸稀释浓度×50/1 000.
2 结果与分析
2.1 改良 CTAB 法提取的天麻基因组DNA产量及纯度分析
2.1.1 基因组DNA的琼脂糖凝胶电泳检测。
运用改良 CTAB 法提取的天麻基因组DNA琼脂糖凝胶电泳检测结果如图1,DNA条带亮度高,无明显杂带。
2.1.2 DNA产量及纯度分析。
该方法提取 DNA的OD260/OD280比值为 1.756,<1.8,表明 DNA 中存在少量的杂质;根据 OD260计算所提取的 DNA 浓度为 1.513 μg/μL.
2.2 SDS-CTAB 法提取的天麻基因组DNA产量及纯度分析
2.2.1 基因组DNA的琼脂糖凝胶电泳检测。
运用SDS-CTAB 法提取天麻基因组DNA后,取样2 μL进行琼脂糖凝胶电泳检测,结果如图2,DNA条带亮度好,无杂带。
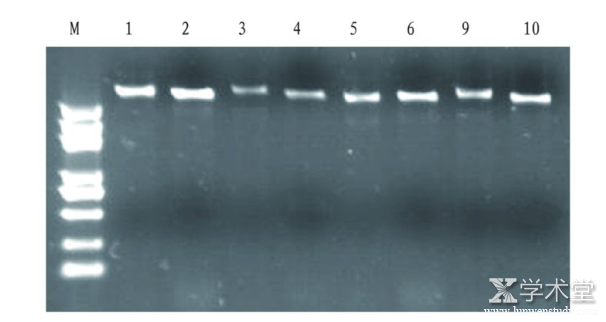
图1 改良 CTAB 法提取的天麻基因组DNA电泳结果
Fig.1 The results of genomic DNA electrophoresis of Gastrodia elata extracted by improved CTAB
注:M为分子量标记,1~10为提取的基因组DNA
Note:M is the molecular weight marker;1-10 are the extracted genomic DNA
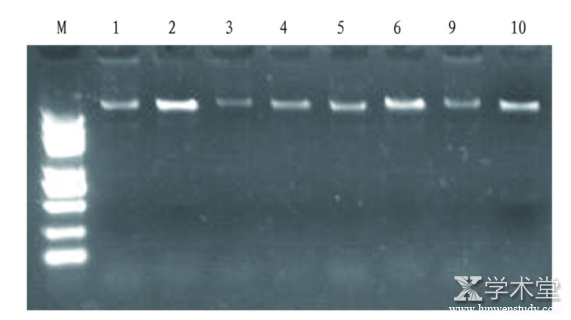
图2 SDS-CTAB 法提取的天麻基因组DNA电泳结果
Fig.2 The results of genomic DNA electrophoresis of Gastrodia elata extracted by SDS-CTAB
注:M为分子量标记,1~10为提取的基因组DNA
Note:M is the molecular weight marker;1-10 are the extracted genomic DNA
2.2.2 DNA产量及纯度分析。
该法提取 DNA的OD260/OD280比值为1.822,接近1.80,表明 DNA纯度比较高,污染比较少;根据 OD260计算所提取的天麻基因组 DNA 浓度为 1.296 μg/μL.
3 讨论
2种方法提取的天麻基因组DNA琼脂糖凝胶电泳结果显示,改良 CTAB 法的条带亮度明显优于SDS-CTAB法。SDS-CTAB法使用了β-巯基乙醇、蛋白酶K、SDS,这些试剂的共同作用均可分解蛋白质,便于DNA解离,但是β-巯基乙醇为高毒试剂,且气味难闻。SDS-CTAB法耗时较改良 CTAB 法长,操作步骤较多,操作过程难免造成DNA损失。因此,SDS-CTAB法得到的DNA纯度比改良 CTAB 法高,产量比改良 CTAB 法低。
天麻块茎多糖类和酚类物质的含量相当高,在试验中有效筛选和改进不同的基因组DNA的提取方法对获得高质量的基因组DNA十分重要,也是对天麻物种进行分子生物学研究的重要前提[9].通过改良CTAB法和SDS-CTAB法提取天麻基因组DNA的比较研究表明,改良CTAB法提取天麻块茎基因组DNA的产量优于SDS-CTAB法,虽然改良CTAB法提取的DNA纯度略差,但是二者提取的 DNA 片段完整无断裂,主要原因是2种方法都使用了CTAB,CTAB具有从大量产生黏多糖的有机体中制备纯化DNA的特性。CTAB属于一种带阳离子的表面活性剂,具有较好的化学特性,即在溶液中离子强度低的情况下,可以沉淀核酸和酸性多聚糖,在溶液中离子强度高的情况下,CTAB与蛋白质和非酸性多聚糖形成复合物而不能沉淀DNA和RNA[10].提取基因DNA必须考虑后续的分子生物学研究,倾向于选择无杂质且DNA 片段完整的提取方法。
在天麻块茎基因组DNA提取过程中务必始终注意以下几点:①研钵、吸头、配制的试剂要按照要求进行灭菌,运用SDS-CTAB法时,研钵和部分试剂要在低温冰箱中预冷,尽可能地减少外来污染和DNA 降解;②研磨材料的力度应该适当,太小造成细胞破裂不充分,影响DNA得率,过大可能损坏DNA分子,所以在整个研磨过程中,应该保持用力均匀且方向一致;③操作过程避免剧烈振荡,以减少DNA断裂,动作尽量温和,保持DNA完整;④操作要规范,在制备琼脂糖凝胶时要避免产生气泡,上样电泳时移液器吸头不能插入胶中或划破胶孔,电泳时先高电压再低电压;⑤紫外分光光度计测定 DNA 样品时,使用TE 缓冲液作为溶解 DNA 的溶液比较好,是由于TE 缓冲液保持了低离子浓度,可以保证读数准确。
参考文献
[1] 袁崇文。中国天麻[M].贵阳:贵州科技出版社,2002.
[2] 周铉,杨兴华,梁汉兴,等。天麻形态学[M].北京:科学出版社,1987.
[3] 徐昌艳,雷丹丹,曹旭林,等。天冬药材基因组DNA提取方法研究[J].安徽农业科学,2019,47(8):171-173.
[4] 方强强,王燕。岩陀DNA提取方法研究[J].井冈山大学学报(自然科学版),2019,40(2):19-24.
[5] 陈力群,谭晴晴,陈雪燕,等。桑黄基因组DNA提取方法优化及分子鉴定[J].山东农业科学,2019,51(1):18-21,31.
[6] 关萍,康冀川,邹容,等。兰科植物天麻基因组 DNA 提取方法的比较研究[J].山地农业生物学报,2004,23(5):422-425.
[7] 张弦,张小蕾。天麻基因组DNA提取方法的选择和优化[J].吉林医学,2010,31(9):1219.
[8] 程纪伦,范爱辉,陈琦。高质量天麻基因组 DNA 的提取[J].广东农业科学,2009(8):153-155.
[9] 陈宗礼,陈昱宇,王睿婷,等。组培枣苗基因组DNA提取方法及其含量的比较[J].基因组学与应用生物学,2011,30(1):110-116.
[10] 魏群。分子生物学试验指导 [M].北京:高等教育出版社,1999.





