摘 要: 目的 研究吲哚美辛 (indomethacin, IMC) 亚微乳胶在兔体内的药动学, 评价其生物利用度和经皮渗透性行为的体内外相关性。方法 采用改良Franz扩散池法, 以SD大鼠腹部皮肤进行体外经皮渗透性实验。以家兔为实验动物, 两侧腹部去毛涂抹亚微乳胶或市售普通乳膏10 g (相当于IMC 100 mg) , 不同时间点心脏取血, 用高效液相色谱法测定IMC的血药浓度。采用反卷积分法对体外经皮渗透数据和体内药动学数据进行体内外相关性研究。结果 IMC亚微乳胶体外24 h累积经皮渗透量是市售IMC普通乳膏的2倍;经皮给药后, 与市售IMC普通乳膏相比, IMC亚微乳胶的Tmax、Cmax、T1/2均无显着性差异;AUC0-24和AUC0-∞均为市售IMC普通乳膏的2倍。IMC亚微乳胶体内外相关性系数r=0.930。结论与市售IMC普通乳膏相比, IMC亚微乳胶能够增加IMC渗透入血量, 提高IMC的相对生物利用度, 且其体内外经皮渗透行为具有良好的体内外相关性。
关键词: 吲哚美辛; 亚微乳胶; 药动学; 生物利用度; 体内外相关性;
Abstract: OBJECTIVE To study the pharmacokinetics of indomethacin (IMC) submicron emulsion gel in rabbits and evaluate its bioavailability and correlation between in vivo and in vitro transdermal penetration. METHODS A modified Franz diffusion cell method was used to test the transdermal penetration of IMC submicron emulsion gel on SD rat abdominal skin. A single dose of 10 g (equivalent to IMC 100 mg) submicron emulsion gel or commercial IMC cream was laid on abdominal skin of rabbit on both sides for an area of 40 cm2. Blood samples were collected from heart at predetermined time points and plasma concentration was determined by HPLC-UV. Deconvolution method was used to study the correlation between in vitro transdermal penetration data and in vivo pharmacokinetic data. RESULTS The cumulative transdermal permeation amount of IMC submicron emulsion gel in vitro for 24 h was twice that of the commercial IMC cream. Compared with the commercial IMC cream, the Tmax, Cmax, T1/2 had no significant differences, the AUC0-24 and AUC0-∞ of IMC submicron emulsion gel was about twice that of the commercial indomethacin cream. The in vitro and in vivo correlation coefficient of IMC submicron emulsion gel was 0.930. CONCLUSION Compared with the commercial IMC cream, IMC submicron emulsion gel can increase the amount of IMC penetrated into blood, improve the bioavailability of IMC, and the correlation between in vivo and in vitro transdermal penetration is good.
Keyword: indomethacin; submicron emulsion gel; pharmacokinetics; bioavailability; correlation between in vivo and in vitro;
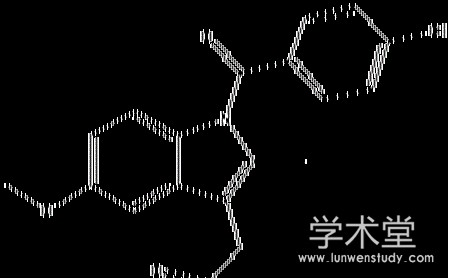
吲哚美辛 (indomethacin, IMC) , 又称消炎痛, 是广泛应用于临床的溶解度极小的强效非甾体抗炎药物 (nonsteroidal antiinflammatory drugs, NSAIDS) , 结构式见图1。IMC通过抑制体内前列腺素合成而产生解热镇痛及消炎作用, 常用于治疗各类风湿性、类风湿性关节炎、肾小球炎、巴特综合征、直立低血压、痛经、偏头痛、胆绞痛、各种肿瘤发热、非特异性低热、眼科疾患、泌尿系统及儿科疾病等[1]。除抗炎作用外, IMC对夏季蚊虫叮咬、冬季皮肤干燥及荨麻疹等引起的皮肤瘙痒症非常有效[2]。IMC口服给药易发生胃肠道刺激和中枢神经系统不良反应, 发生率高达35%~50%, 约20%需停药, 使其应用受到限制[3,4]。非胃肠道给药—经皮给药系统 (transdermal drug delivery systems, TDDS) 被认为是IMC等NSAIDS药物最理想的给药途径[5,6]。目前IMC在TDDS的市售剂型主要是乳膏、凝胶或贴片等。由于IMC溶解度小, 普通乳膏和凝胶中需加入醇类促进其溶解, 但长期放置过程中由于醇类挥发, 药物易析出, 而导致药效降低。因此, 制备载药量高且长期放置过程中不易析出药物晶体、具有较好皮肤穿透能力的IMC TDDS, 是目前IMC经皮制剂的研究重点和难点。亚微乳由于具有粒径较小易于渗透, 与皮肤组织亲和力高, 乳化剂用量较低, 对皮肤刺激性小, 载药量高, 能提高药物稳定性等特点, 在TDDS中逐步得到应用[6,7,8,9]。
本实验采用亚微乳联合凝胶技术, 选择合适的油相溶解IMC, 将其制备成粒径<500 nm的亚微乳, 使其能够迅速通过角质层, 增加经皮吸收速率, 并将亚微乳载入水性凝胶基质中, 有利于药物的涂抹和释放, 提高患者的顺应性。通过兔体内药动学研究评价IMC亚微乳胶的体内药动学行为并建立其与体外经皮渗透性的相关性, 以期为NSAIDS TDDS的开发和质量评价提供依据。
图1 吲哚美辛结构式Fig.1 Structure of indomethacin
1 仪器与试剂
1.1 仪器
SHIMADZU LC-2010AHT型高效液相色谱仪 (日本岛津) ;Zetasizer NANO ZS90型纳米粒径仪 (英国马尔文公司) ;IKA T25高速剪切机 (德国IKA) ;EF-C3高压均质机 (加拿大AVESTIN公司) ;TGL-16M冷冻高速离心机 (长沙英泰仪器仪表有限公司) ;TDD-5M多管低速离心机 (长沙平凡仪器仪表有限公司) ;PHS-25数字式pH计 (上海日岛科学仪器有限公司) ;Tecnai G2 20型透射电子显微镜 (FEI公司) 。
1.2 试剂
IMC原料药 (石家庄制药集团, 批号:160510;纯度:97%) ;IMC对照品 (中国药品生物制品检定所, 批号:100258-200904;纯度:99%) ;尼泊金丁酯 (郑州鑫凯化工产品有限公司, 批号:20150211, 纯度:99%) ;卵磷脂E80 (Lipoid GmbH Germany) ;中链甘油三酯 (medium chain triglycerides, MCT, 铁岭北亚药用油有限公司) ;脱氧胆酸钠 (国药集团化学试剂有限公司) ;甘油 (湖南汇虹试剂有限公司) ;卡波姆934 (北京海淀会友精细化工厂) ;IMC普通乳膏 (沈阳华益制药有限公司, 批号:20160101;规格:1%) 。
1.3 动物
健康成年家兔, ♂, 中南大学实验动物中心提供, 体质量2.5~3.0 kg, 许可证号:SCXK (湘) 2015-0004, 合格证号:43608300000418。
2 方法与结果
2.1 IMC亚微乳胶的制备
卵磷脂0.25 g, MCT 1.50 g, 85℃水浴加热溶解完全, 加入0.10 g IMC搅拌溶解分散均匀得油相;另取脱氧胆酸钠0.15 g, 丙二醇0.50 g, 加水溶解, 置85℃水浴中加热使溶解完全, 得水相;将水相加入油相中, 高速剪切10 min (10 000~15 000 r·min-1) , 得初乳;初乳用高压均质机均质10~15次 (10 000~15 000 psi) , 得平均粒径为100~200 nm的IMC亚微乳;另配制2%卡波姆934溶液, 三乙醇胺调节pH至6~7, 将亚微乳与凝胶基质混合均匀, 即得载药量为1%的IMC亚微乳胶。
2.2 IMC亚微乳胶的表征
按中国药典2015年版通则0631-pH值测定法, 直接测定亚微乳样品pH值, 亚微乳胶加水稀释超声分散均匀后测定pH值。所测样品均接近中性, 对皮肤刺激性小。亚微乳或亚微乳胶样品加水稀释100倍超声分散均匀后用马尔文粒径仪测定其平均粒径 (MD) 、多分散指数 (PDI) 、Zeta电位。亚微乳及亚微乳胶样品甲醇超声破乳定容, 用HPLC-UV测定IMC的含量。表征结果见表1。另取亚微乳胶样品少许, 使其黏附于铜网表面, 干燥器中静置晾干后, 置于透射电子显微镜样品台, 观察成像, 见图2。
表1 IMC亚微乳和亚微乳胶表征结果 (n=3) Tab.1 The characterization of IMC submicron emulsion and submicron emulsion gel (n=3)

图2 IMC亚微乳胶透射电镜图Fig.2 TEM figure of IMC submicron emulsion gel 2.3 IMC亚微乳胶的体外经皮渗透性试验[10]

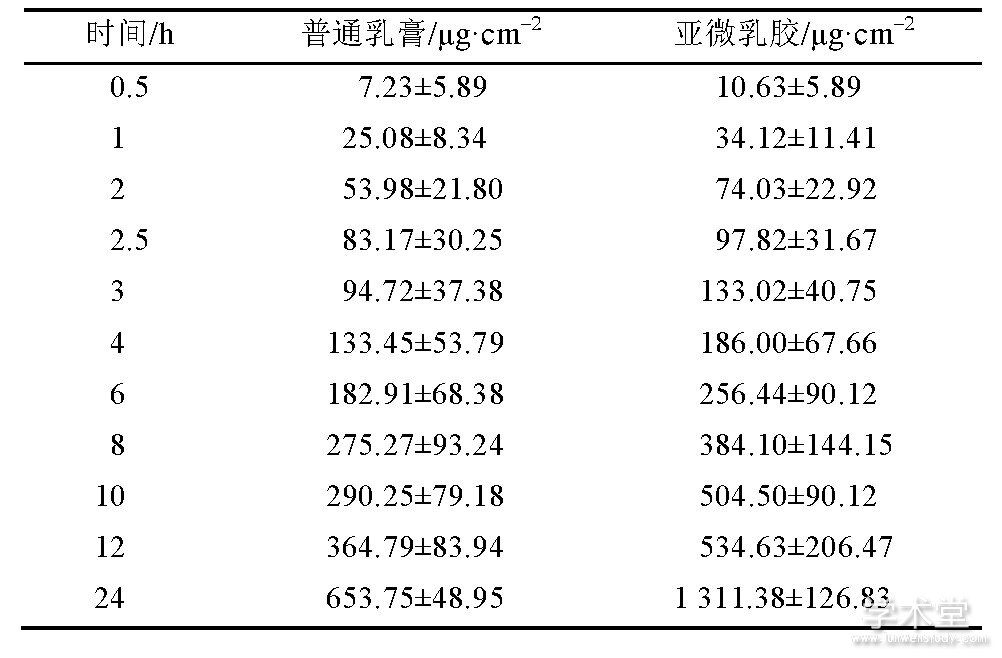
将处理好的鼠皮固定在改良的Franz立式扩散池的接收池和供给池之间, 角质层面朝上。分别称取IMC亚微乳胶和市售IMC乳膏0.2 g均匀涂抹在皮肤上, pH 7.4磷酸盐缓冲溶液作为接收液, 体积6.5 mL, (37±0.2) ℃恒温水浴, 200 r·min- (16) 恒速搅拌。分别于0.5, 1, 2, 2.5, 3, 4, 6, 8, 10, 12, 24 h各取样2 mL, 同时补充等量同温空白接收液;立即用0.45μm微孔滤膜滤过, HPLC进样分析, 计算IMC浓度。按Qn= (CnV+?i (28) 1i (28) n-1CiVi) /A计算药物的累积渗透量Q, 式中Cn:第n个取样点接收液中药物浓度;Ci:第n-1个取样点接收液中药物浓度;V:接收池容积;Vi:取样体积;A:皮肤有效扩散面积 (3.14 cm2) 。结果显示, 亚微乳胶中IMC的24 h累积透过量为市售IMC普通乳膏中IMC累积透过量的2倍, 表明IMC亚微乳胶的透皮效果优于市售IMC普通乳膏, 见表2。
表2 IMC亚微乳和亚微乳胶的体外经皮渗透量 (n=6) Tab.2 Cumulative transdermal permeation amount of IMC submicron emulsion and submicron emulsion gel (n=6)
2.4 IMC亚微乳胶在兔体内的药动学研究
2.4.1 给药方案及家兔血样采集
健康成年家兔12只, 随机分配成2组 (亚微乳胶组、市售普通乳膏组) , 每组6只, 家兔两侧腹部剔去毛发, 面积约40 cm2 (4 cm×5 cm×2=40 cm2) 。实验前禁食12 h, 自由饮水。分别给予亚微乳胶和普通乳膏10 g (相当于IMC 100 mg) , 给药前和给药后0.5, 1, 2, 2.5, 3, 4, 6, 8, 10, 12, 24 h于心脏取血, 3 000 r·min- (16) 离心10 min, 取血浆于-20℃保存。
2.4.2 家兔血样测定方法的建立
2.4.2. 1 血浆样品处理方法
精密吸取空白血浆500μL, 加入内标尼泊金丁酯溶液20μL (10.0μg·mL- (16) ) , 加入10%KH2PO4溶液200μL, 涡旋1 min。加入乙酸乙酯2.5 mL, 涡旋2 min。所得溶液3 000 r·min- (16) 离心15 min, 吸取上清液40℃氮气吹干, 加100μL甲醇复溶, 20μL进样分析。
2.4.2. 2 色谱条件及系统适用性试验
依力特Hypersil C18柱 (4.6 mm×200 mm, 5μm) , 流动相:甲醇-0.05%磷酸水溶液 (70∶30) , 流速:1.0 mL·min- (16) , 柱温:40℃, 检测波长260 nm, 进样量:20μL。分别将处理后的空白血浆样品、空白血浆加药物样品、给药后家兔血样按上述色谱条件进样分析, 见图3。在该色谱条件下, 内源性杂质对IMC与内标无影响, IMC保留时间约为10.0 min, 内标保留时间约为6.0 min。
图3 高效液相色谱图Fig.3 HPLC chromatograms
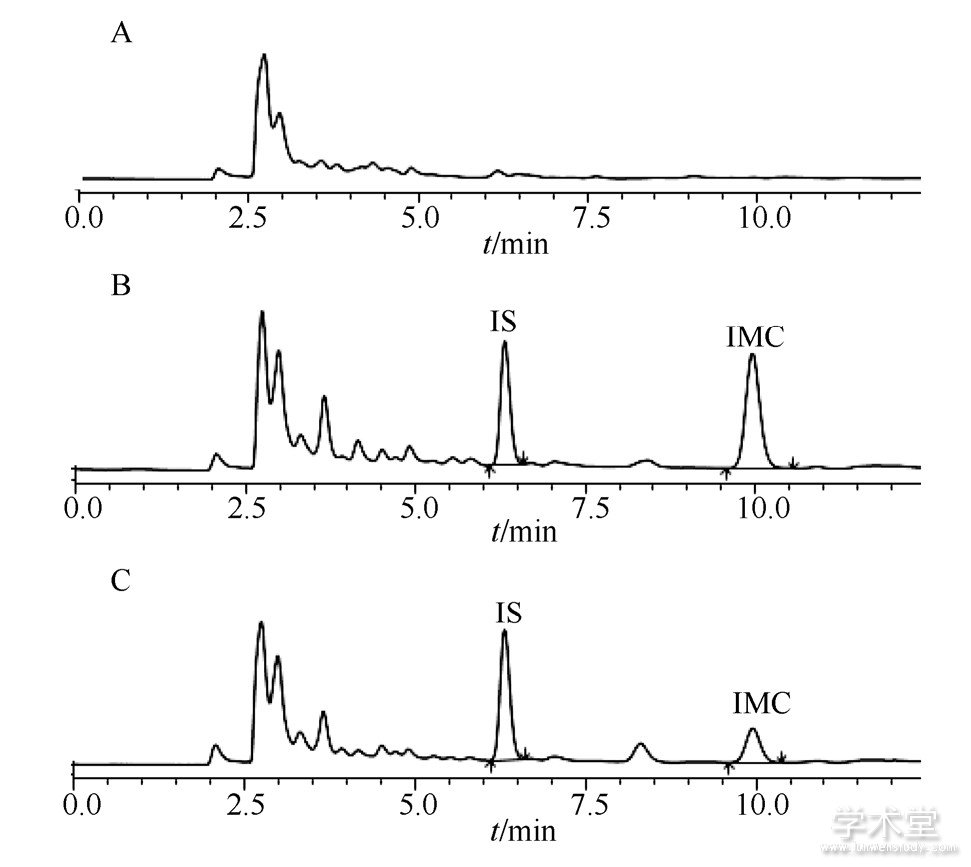
A-空白血浆;B-空白血浆+IMC+内标;C-给药后兔血样。A-blank plasma;B-blank plasma+IMC+internal standard;C-rabbit blood sample after administered IMC submicron emulsion gel.
2.4.2. 3 标准曲线及定量下限
用空白血浆配制系列IMC浓度 (0.02, 0.05, 0.10, 0.20, 0.50, 1.00, 2.00, 5.00μg·mL- (16) ) 的标准血浆溶液, 按“2.4.2.1”项下方法处理并按“2.4.2.2”项下色谱条件进样分析, 以IMC与内标的峰面积比 (Y) 与血药浓度 (X) 进行线性回归。得回归方程为:Y=0.001 3X+0.125 8 (r=0.998 9) , 血浆中IMC在0.02~5.00μg·mL- (16) 内与峰面积比线性良好, 最低定量浓度为0.02μg·mL-1 (S/N>10) 。
2.4.2. 4 提取回收率
用空白血浆配制浓度为0.05, 0.50, 2.00μg·mL-1的IMC血浆样品各5份, 按“2.4.2.1”项下方法处理, 并按“2.4.2.2”项下色谱条件进样分析;另用甲醇配制0.05, 0.50, 2.00μg·mL-1的IMC溶液各5份, 加入内标20μL并按“2.4.2.2”项下色谱条件进样分析, 记录IMC和内标的色谱峰面积;血浆样品峰面积与同浓度的标准溶液峰面积比值即回收率。低、中、高浓度IMC的平均提取回收率分别为 (86.91±5.87) %, (84.70±1.68) %, (89.02±3.64) %, RSD (n=15) 为6.46%, 内标的提取回收率为 (77.64±5.11) %, RSD (n=15) 为6.57%, 表明回收率较高, 且测定数据精密, 可重复, 符合生物样品测定要求。
2.4.2. 5 准确度与精密度
配制0.05, 0.50, 2.00μg·mL- (16) 的IMC血浆样品各5份, 按“2.4.2.1”项下方法平行操作, 根据标准曲线计算浓度, 连续测定3 d, 计算准确度及日内、日间精密度, 测定结果见表3。低、中、高浓度的血浆样品中IMC日内、日间RSD均<15%, 准确度在85%~115%内, 符合生物样品测试的方法学要求。
表3 血浆样本中IMC准确度与精密度Tab.3 Accuracy and precision of IMC in plasma
2.4.2. 6 稳定性
处理液稳定性:将0.05, 0.50, 2.00μg·mL- (16) 的IMC血浆样本按“2.4.2.1”项下方法处理, 得到血浆样品处理液, 室温放置0, 24 h后进样分析, 考察样品在进样瓶中的稳定性。结果见表4, 低、中、高浓度的血浆样本处理液室温放置24 h稳定。
3次冻融循环稳定性:将0.05, 0.50, 2.00μg·mL- (16) 的IMC血浆样本置于-20℃中冷冻3 d后, 室温解冻, 如此反复3次冻融和解冻过程, 然后按“2.4.2.1”项下方法处理, 并按“2.4.2.2”项下色谱条件进样分析, 考察血浆样本冻融稳定性, 结果见表4。结果表明, 低、中、高浓度的血浆样本反复冻融3次稳定。
长期稳定性:将0.05, 0.50, 2.00μg·mL- (16) 的IMC血浆样本置于-20℃中贮存, 于第30天取出, 然后按“2.4.2.1”项下方法处理, 并按“2.4.2.2”项下色谱条件进样分析, 考察血浆样本长期贮存稳定性, 结果见表4。结果表明, 低、中、高浓度的血浆样本-20℃放置30 d稳定。
2.4.3 家兔体内药动学研究
将IMC亚微乳胶及市售IMC普通乳膏家兔经皮给药后体内血药浓度绘制药时曲线见图4。用DAS 3.0处理药动学数据, 得到各药动学参数见表5。对主要药动学参数分别作独立样本t检验, AUC0-24, AUC0-∞差异具有统计学意义 (P<0.05) , 而Cmax、Tmax、K、t1/2差异不具有统计学意义 (P>0.05) 。IMC亚微乳胶的AUC0-24、AUC0-∞均为市售IMC乳膏的2倍, 且24 h时IMC亚微乳胶组中IMC浓度仍高于市售IMC普通乳膏组。说明将IMC制成亚微乳胶后可以增加IMC经皮渗透量, 即吸收入血的药物量增加, 而不改变IMC经皮吸收、代谢和排泄的速度, 相对生物利用度提高2倍。
图4 IMC亚微乳胶及市售IMC普通乳膏家兔经皮给药后体内血药浓度-时间曲线 (n=6) Fig.4 Plasma concentration-time curve of IMC in rabbits after single transdermal administration of submicron emulsion gel or commercial IMC cream (n=6)
表4 IMC的稳定性Tab.4 Stability of IMC

表5 IMC亚微乳胶及市售IMC普通乳膏的药动学参数对比 (n=6) Tab.5 The comparison of the pharmacokinetic parameters between IMC submicron emulsion gel and commercial IMC cream (n=6)
注:1) P<0.05。Note:1) P<0.05.
2.5 IMC亚微乳胶兔体内外相关性研究
采用反卷积分法 (Deconvolution) 对体外经皮渗透数据和体内药动学数据进行体内外相关性研究。累积经皮渗透量以Qn表示, 体内吸收则以各个时间点的AUC表示, 各个时间点的AUC占AUClast的百分数用Fraction Input (R) 表示。以体外累积渗透量占总渗透量的百分数Q (%) 为因变量Y, Fraction Input (R) 为自变量X, 进行线性回归, 得回归方程为Y=0.766 7X-0.918 4 (r=0.930) 。当自由度df=9时, 临界值r9, 0.01=0.735, r>r9, 0.01, 表明IMC亚微乳胶体外透皮与体内吸收具有良好的相关性。
3 讨论
IMC为难溶性NSAIDS, 本研究将其制备成粒径可控的亚微乳胶剂, 不仅可以增加药物溶解度, 避免药物析晶, 且水性凝胶基质易于涂抹, 不油腻, 可以增加患者顺应性。
药动学研究发现IMC亚微乳胶与市售IMC普通乳膏的Cmax, Tmax, K, t1/2没有显着性差异, 而AUC0-24, AUC0-∞具有显着性差异, 说明剂型的改变不影响IMC体内的药动学过程, 药物经皮渗透是决定IMC生物利用度的关键因素。IMC亚微乳胶的AUC0-∞是市售IMC普通乳膏的200.6%, 生物利用度增加, 可能是因为亚微乳的粒径小易透过皮肤, 同时亚微乳胶体系增加了皮肤的通透性[11]。本研究在活体动物水平说明亚微乳胶可以增加IMC经皮渗透量, 这说明亚微乳胶剂是一种有潜力的增加NSAIDS经皮渗透性从而降低不良反应的手段。
IMC的脂溶性强, 文献报道[12,13]IMC透皮给药后可在皮肤角质层中形成储库, 再缓慢释放入血, 导致药时曲线的双峰现象。IMC亚微乳胶透皮速度快, 皮肤滞留的储库效应相对市售普通软膏较弱, 从而双峰现象较市售软膏没那么明显, 导致其t1/2略为缩短, 但没有显着性差异。
目前, 对于亚微乳胶等新型TDDS的体外经皮渗透性研究较多, 而体内和体内外相关性研究较少, 而体外研究采用的是离体皮肤, 其可靠性有待验证。因此, 建立和评价体内外相关性, 从而依据体外数据预测其体内行为是非常有必要的[14]。反卷积分法是一种不需要进行房室模型拟合, 直接用数学方法以真实的药动学数据计算体内输入函数的数学计算方法[15,16]。本研究将其应用于IMC亚微乳胶的体外经皮渗透性实验和体内药动学相关性研究中, 结果表明IMC亚微乳胶的体内外相关性良好, 说明可以用体外经皮渗透性实验预测IMC亚微乳胶的体内药动学行为, 为NSAIDS的TDDS的开发和质量评价提供参考。
参考文献:
[1] FAN C, ZHANG M H, WANG C X.Mechanism of action of non-steroidal analgesic anti-inflammatory drugs[J].Chin JHosp Pharm (中国医院药学杂志) , 2003, 23 (2) :107-108.
[2] ZHANG X J.Indomethacin new use and indomethacin external use in the treatment of pruritus:China, 1543947[P].20030904.
[3] YOU S Z.Indomethacin clinical adverse reaction and prevention[J].J Mod Med Health (现代医药卫生) , 2007, 23 (9) :1330-1331.
[4] ROSTOM A, DUBE C, Dube, WELLS G A, et al.Prevention of NSAID-induced gastroduodenal ulcers[J].Cochrane Database Syst Rev, 2002, 4 (1) :101-103.
[5]ZUO J, DU L, LI M, et al.Transdermal enhancement effect and mechanism of iontophoresis for non-steroidal anti-inflammatory drugs[J].Int J Pharm, 2014, 466 (1/2) :76-82.
[6] ELLEITHY E S, IBRAHIM H K, SOROUR R M.In vitro and in vivo evaluation of indomethacin nanoemulsion as a transdermal delivery system[J].Drug Deliv, 2015, 22 (8) :1010-1017.
[7]EI MAGHRABY G M, ARAFA M F, OSMAN M A.Microemulsion for simultaneous transdermal delivery of benzocaine and indomethacin:in vitro and in vivo evaluation[J].Drug Dev Ind Pharm, 2014, 40 (12) :1637-1644.
[8] KWASIGROCH B, ESCRIBANO E, MORAN M D C, et al.Oil-in-water nanoemulsions are suitable for carrying hydrophobic compounds:Indomethacin as a model of anti-inflammatory drug[J].Int J Pharm, 2016, 515 (1-2) :749-756.
[9] MCCLEMENTS D J.Nanoemulsions versus microemulsions:terminology, differences, and similarities[J].Soft Matter, 2012, 8 (6) :1719-1729
[10] ZHAO Y J, YAO Y, DING Y F, et al.Determination of IMC-submicron emulsion gel content by HPLC and evaluation of the drug transdermal permeation in vitro[J].Chin J Mod Appl Pharm (中国现代应用药学) , 2009, 26 (11) :921-924.
[11]SCHWARZ J, WEISSPAPIR M, FRIEDMAN D.Enhanced transdermal delivery of diazepam by submicron emulsion (sme) creams[J].Pharm Res, 1995, 12 (5) :687-692.
[12]GOOSEN C, PLESSIS J D, M?LLER D G, et al.Correlation between physicochemical characteristics, pharmacokinetic properties and transdermal absorption of NSAID’s[J].Int J Pharm, 1998, 163 (1/2) :203-209.
[13] EL-LEITHY E S, IBRAHIM H K, SOROUR R M.In vitro and in vivo evaluation of indomethacin nanoemulsion as a transdermal delivery system[J].Drug Deliv, 2015, 22 (8) :1010-1017.
[14]MOHAMMED D, MATTS P J, HADGRAFT J, et al.In vitro-in vivo correlation in skin permeation[J].Pharm Res, 2014, 31 (2) :394-400.
[15] MARGOLSKEE A, DARWICH A S, GALETIN A, et al.Deconvolution and IVIVC:Exploring the role of rate-limiting conditions[J].AAPS J, 2016, 18 (2) :321-332.
[16] KESISOGLOU F, XIA B, AGRAWAL N G.Comparison of deconvolution-based and absorption modeling IVIVC for extended release formulations of a BCS III drug development candidate[J].AAPS J, 2015, 17 (6) :1492-1500.2018-03-14





