
1 脂解酶简介
1.1 脂解酶根据其催化特性分类
1.1.1 非特异性脂解酶(non-specificlipase)。此类脂解酶并不对三酸甘油酯的酯键有选择性,即脂解酶对三个酯键均可以进行反应(如水解、转酯化反应)。
1.1.2 1,3特异性脂解酶(1,3-specificlipase)。此类脂解酶只会对三酸甘油酯上之第1、3位之酯键进行反应,第2位之酯键则否。以水解三酸甘油酯为例:当1,3特定位脂解酶将三酸甘油酯水解成1,2或(2,3)-diglycerides,此时第2位酯键会自发性进行酰基转移(acyl migration)至第1或(3)位,进而再被1,3特异性脂解酶水解。
1.1.3 特定脂肪酸脂解酶(fatty acid specificlipase)。如Geotricbum candidium生产之脂解酶只对特定结构之脂肪酸有活性。此脂解酶只对三酸甘油酯中,第九个碳上有顺式双键的不饱和脂肪酸进行反应。对于饱和脂肪酸(无双键)、第九个碳上为单键则无反应。
1.2 生理及物理之特性
1.2.1 微生物脂解酶通常比植物或动物脂解酶更具稳定性。
1.2.2 嗜热微生物脂解酶在高温与不利的化学环境下较为稳定,极具工业应用之潜力。
1.2.3 由于酵素的专一性,不必要的副产物可以减少。
脂解酶是水解酵素的成员之一,作用于羧酸酯键。
其生理角色是水解三酸甘油酯产生双酸甘油酯、单酸甘油酯、脂肪酸、甘油。除了可水解羧酸酯键,脂解酶亦可在非水相环境下催化酯化反应、内酯化反应、转酯化反应。因此,多元化的催化能力使得脂解酶可以应用于食品、清洁剂、制药、皮革、纺织、化妆品、造纸工业等(Hasan et al.,2006)。
2 Pseudomonas cepacia脂解酶介绍
在醇解反应中探讨不同微生物来源之脂解酶,其中Pseudomonas cepacia脂解酶催化醇解反应并加入油重1~20wt%之水分,反应90h后脂肪酸甲酯含量超过80%.当水含量低时,Candida rugosa及P.fluorescens脂解酶其反应速度显着下降,显示水可避免甲醇使这些酵素失活。另外,P.cepacia脂解酶于醇解反应中醇油莫耳比高达2∶1或3∶1时,仍能达到高甲基酯含量,故P.cepacia脂解酶较其他微生物来源之脂解酶对醇类耐受性较高。
以X-ray结晶法分析P.cepacia脂解酶在无抑制剂下之结晶结构,结构显示脂解酶含有α/β水解酶折迭以及三个具催化活性之残基Ser87、His286、Asp264.此酵素与同源之P.glumae脂解酶及Chromobacterium viscosum脂解酶在结构上有数个共通点,其中包含Ca2+结合位。此脂解酶呈现openconformation,其中包含溶剂可接触之活性位;相较于P.glumae脂解酶,其活性位隐藏于关上之“lid”之下。P.cepacia脂解酶之open conformation显示此酵素可在油水接口活化,活化时应伴随二级结构之调整使“lid”开启,将活化位暴露于外。
3 包覆相脂解酶活性分析
(1)包覆相脂解酶活性测量方法是将810μL的50mMTris HCl buffer,pH8.0(含有0.4% TritonX-100及0.1%arabic gum)、90μL pNPL与100μL包覆相脂解酶溶液混合;(2)将此反应置于hybridization oven中反应温度37℃,50rpm,反应10min;(3)离心5min后抽取上清液,以去离子水稀释10倍后在A410下测量其吸收,再利用pNP标准曲线计算活性。
4 制备包覆相脂解酶
(1)取228μL tetramethoxysilane(TMOS)并加入1272μL 1mM HCl,于室温下反应15min使其水解,最终浓度为1M.由于水解后之TMOS长时间储存会凝结成胶,故每次包覆前均需准备全新之TMOS水解溶液;(2)包覆之反应溶液中包含7.5mL 0.1M KH2PO4(pH7.8,含有0.1NNaOH)、1.5mL 1M TMOS、1.5mL500mg/mL脂解酶与1.5mL去离子水,最后加入3mL 5mMPAA以起始反应;(3)于室温下反应5min后,以离心(×100g,2min)进行固液分离并抽出上清液,接着使用15mL去离子水清洗包覆相脂解酶两次,悬浮于去离子水中,最后将其冷冻干燥备用;(4)包覆效率系以下列公式计算:【1】
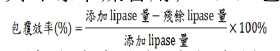
残余脂解酶量系指上清液及清洗液中脂解酶之含量,测定其脂解酶之活性,并由脂解酶浓度-活性标准曲线计算;(5)活性回收系以下列公式计算:【2】

5 包覆相脂解酶之特性
本研究中包覆效率(包覆相酵素质量/添加酵素质量)为93%±9%.未包覆脂解酶其比活性为24±11U/mg,包覆相脂解酶之比活性为15±8U/mg;平均活性回收(包覆相脂解酶比活性/液相脂解酶比活性)为58±5%,以上实验次数均为5次。先前研究中以TMOS将P.cepacia脂解酶包覆;其包覆率为96%,活性回收为51%,与本研究实验结果相近。而McAuliffe等人(2005)以polyethyleneimine(PEI)催化仿生氧化硅形成,用以包覆脂解酶,其活性回收低于10%;明显较本研究为低。
经钼硅酸盐比色法之结果显示,以PAA为形成氧化硅之模板,其氧化硅产量为每100μl反应体积产生0.73±0.09mg(N=3),可换算出酵素承载量为6.7±0.8g脂解酶/g SiO2(N=3)。Pencreac'h与Baratti指出Amano公司之商业化脂解酶,经过Lowry法之检测,脂解酶粉末所含之蛋白质约只占其质量6%(60mg/g powder,6%),水分约占2.3%.相较于Chen等人之研究结果,其氧化硅产量为每100μL反应体积产生0.24mg;其原因可能为本研究采用PAA之浓度为5倍(5mM vs.1mM),先前研究指出氧化硅生成量与催化剂使用浓度有关。
6 转酯化条件
无论有无包含脂解酶或经冷冻干燥处理,其形态并无明显之差异,均为颗粒与颗粒彼此相互融合或团聚而形成之结构。为准确控制含水量,采经冷冻干燥后之包覆相脂解酶进行生质柴油转化。
进行转酯化反应时,许多条件均会影响转酯化之结果,如反应温度、反应时间、醇油莫耳比、甲醇批次添加与否、含水量、酵素添加量等。以上诸多因子中选取有影响性之因子,再以反应曲面法探讨因子间之交互关系并找出最适化之反应条件。
制备生质柴油最常以蔬菜油为原料,但其成本过于高昂又有与民争食之疑虑,因此,选择成本较低廉之废食用油是为经济又环保的做法。
大豆油与废食用油之酸价分别为0.3±0.1、1.4±0.1mg KOH/g(N=3),显示废食用油于使用过程中可能发生氧化及水解,使酸价较大豆油高约5倍。而本研究所使用之大豆油及废食用油之皂化价分为175及195mg KOH/g,两者无明显差距。
7 结语
温度是决定酵素反应速率的因素之一,在一定的温度范围内酵素活性随温度升高而增加。高于此温度范围后,酵素之构型改变造成不可逆之活性丧失;低温时,酵素作用减缓,然其活性可藉由升温再度回复。
Noureddini等人研究固定化P.cepacia脂解酶之最适温度,发现于35℃时有最佳之转酯化活性。以反应曲面法探讨生质柴油之反应温度(40℃、50℃、60℃),结果最佳温度为52.1℃。





