
炎症痛是生活中常见的病痛,炎症是机体对损伤因子所发生的防御反应,其在临床上表现为红、肿、热、痛、功能障碍等局部变化及白细胞增多、组织细胞代谢增强等全身反应. 因此找到一种快速方便的消炎药物具有很好的开发前景.
2002 年,Lembo 等人从大鼠和人背根神经节和三叉神经节中成功克隆出一种 G 蛋白偶联受体,由于该基因仅仅特异性地表达于上述神经节中,因此命名为感觉神经元特异性受体 ( sensory neuron-specific receptors,SNSR )[1],该受体隶属于2001 年 Dong 等人发现的 Mrgs 超家族 ( Mas-related G pro-tein-coupled receptors,Mrgs)[2]. 该受体已经被证实参与了伤害性信息的传递过程. 在福尔马林疼痛模型中,应用 SNSR 受体的特异性激动剂 BAM8-22 和 MSH 均能抑制痛行为反应和脊髓背角 c-Fos 的表达[3]; 还可抑制鞘内注射 NMDA 引起的 NOS 的激活[4]. 在 CFA 炎症痛模型中,作者研究发现,激活 SNSR 受体,能降低大鼠痛觉过敏,增加抗伤害作用,同时能降低脊髓背角浅层和背根神经节中nNOS 和 CGRP 的表达[5 -6]. 那么,激活 SNSR 受体除了具有镇痛作用外,是否还具有消炎作用呢?
本文通过宏观和组织学方法观察应用 BAM8-22 和 MSH 特异性激活 SNSR 受体对 CFA 引起的炎症灶水肿的影响,观察其消炎效果,为临床消炎镇痛寻找新的治疗途径.
1 材料与方法
1. 1 实验动物
实验用清洁级 Sprague-Dawley 大鼠由福建医科大学实验动物中心提供. 均为雄性,体质量为 250~ 300 g. 动物饲养在恒温、恒湿的十万级洁净动物饲养房内,食物和水可以自由取得,人工控制昼夜周期各为12 h. 行为学实验均在白天进行. 实验中尽可能减少对动物的额外刺激和实验动物的使用数量. 动物实验符合国家 《实验动物管理条例》,并经福建师范大学实验动物伦理委员会认可.
1. 2 试剂
BAM8-22、MSH 和 BAM8-18 均为上海华大天远生物公司合成; CFA ( complete Freund's adjuvant,CFA) 为美国 Sigma 公司生产; 戊巴比妥钠为中国医药 ( 集团) 上海化学试剂公司产品; 苏木精染液为上海润成生物有限公司生产; 石蜡 ( 55 ~56 ℃) 为上海华灵康复器械厂生产; 其余试剂均为国产分析纯.
1. 3 主要仪器与设备
Microm HM 315R 型组织切片机为德国 MicRom GmbH 公司产品; Nikon Eclipse E200 型显微镜和Nikon Eclipse E200 型数码照像机均为日本制造; 大鼠固定装置为成都泰盟科技有限公司产品.
1. 4 实验方法
1. 4. 1 椎管内插管与椎管内注射
椎管内插管按 Yaksh[7]介绍的方法加以改进[5]. 具体是: 手术前,准备 1 根长 14 cm 的 PE-10 管,在中间 8 cm 左右处用热熔胶固定 1 个小球,以备椎管内置管后固定在肌肉上. 手术时,以 50 mg·kg- 1的戊巴比妥钠对大鼠进行腹腔麻醉后,剪去项部毛发,局部消毒,切开皮肤,分离肌肉,暴露枕骨与寰椎连接处,轻轻挑破寰枕膜. 用事先准备的、注好生理盐水 PE-10 管通过寰枕膜孔向大鼠尾端缓缓插入脊髓蛛网膜下腔,进管约 7. 5 ~8. 0 cm,见有液体从管中流出后即封住外口. 逐层缝合创口处的肌肉和皮肤,并将 PE-10 管上的热熔小球固定于浅层肌肉上,以防脱落. 手术后,每只大鼠单独饲养在一个笼子中,让其恢复至少 5 d. 选择行动正常的大鼠进行后续实验. 所有实验完成后,对大鼠进行体质量测量及插管位置检查. 选择体质量下降不超过 20%,插管位置位于脊髓腰膨大背面正中央的动物的测量数据进行统计.
1. 4. 2 CFA 炎性痛模型制备
CFA 炎性痛模型建立参照以往实验进行[5 -6],具体如下: 采用 27 号针对大鼠后脚掌足跖部皮下注射 150 μL CFA 溶液,从脚掌第 2 和第 3 个趾垫之间稍下方插入针头至皮下,并沿皮下向前推进至足底中心敏感区域,缓慢注入 CFA. 退针时注意避免 CFA 外流,并尽量减少对大鼠的损伤.
1. 4. 3 椎管内给药方法、观察指标与取材
椎管内给药时,动物在清醒状态下,放置于特制的固定装置内限制其活动,PE-10 管暴露在装置外. 通过 PE-10 管用微量进液器进行椎管内药物注射. 药物容量均为 10 μL,注射完毕后,再以 10μL 生理盐水缓慢冲洗,确保药物全部进入椎管内.在 -5 min、24 h 和 48 h 鞘内注射 3 次相关药物,在 0 h 足底注射 150 μL CFA. 于 6,24,48 h用游标卡尺测量脚掌中心的上下厚度,以两次测量平均值为准. 以大鼠脚掌厚度变化作为炎症水肿程度的指标. 正常脚掌厚度标记为 100%,将致炎后脚掌厚度与正常脚掌厚度相比作为评定药物对脚肿的影响程度,脚肿变化百分数 = 致炎后脚掌厚度/正常脚掌厚度 ×100 %.
在 48 h 测定好足掌厚度后,用过量戊巴比妥钠进行麻醉后处死. 对生理盐水组、BAM8-22 ( 30nmol) 组和正常大鼠的足底组织进行取材,用 Bouin's 液固定,常规石蜡包埋、切片,厚度为 5 ~ 8μm. H. E. 染色. 用 Nikon Eclipse E200 型显微镜观察,用 Nikon Eclipse E200 型数码照相机拍照. 每组至少观察 4 个标本,每个标本观察 10 个切片. 选取典型切片进行拍照.
1. 4. 4 动物分组
CFA 炎性大鼠随机分为 8 组: 生理盐水组,椎管内注射 20 μL 生理盐水; BAM8-22 ( 3. 3,10,30 nmol) 3 组,椎管内分别注射 3. 3,10,30 nmol BAM8-22; BAM8-18 组,椎管内注射 30 nmolBAM8-18; MSH ( 1. 7,5,15 nmol) 3 组,椎管内分别注射 1. 7,5,15 nmol MSH.
1. 5 统计方法
各级数据均以 mean ± SEM 表示. 数据统计分析应用 Sigmastat 软件进行,多组数据间差异用单因素方差分析 ( one way ANOVA) 并继之以 Tukey's 检验统计分析; 两组数据间差异用 t-test 检验进行比较. P <0. 05 认为差异有显着.
2 实验结果
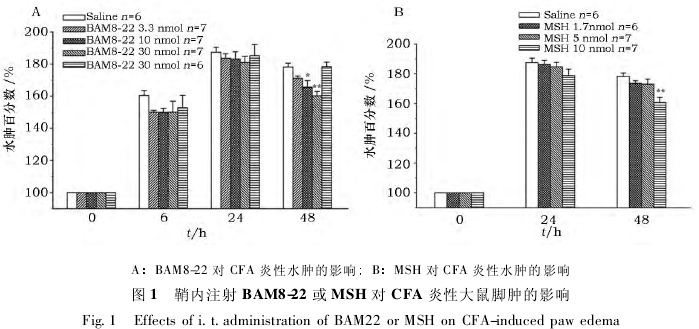
2. 1 激活 SNSR 受体削弱大鼠炎症水肿情况
图 1 显示椎管内给予 SNSR 受体的特异性激动剂激活受体后对 CFA 炎性大鼠脚肿的影响. 从图 1( A) 可以看出: 鞘内注射 BAM8-22 后,在致炎后 6 h 和 24 h,BAM8-22 ( 3. 3,10,30 nmol) 对 CFA引起的脚肿均没有影响,与生理盐水组相比没有显着性差异 ( P > 0. 05) ; 在 48 h 时,3. 3 nmol 的BAM8-22 不能抑制 CFA 引起的足掌肿胀现象,但 10 nmol 和 30 nmol 的 BAM8-22 能有效降低红肿程度,肿胀程度分别为正常的 ( 165. 8 ± 2. 7) % 和 ( 160. 2 ± 4. 1) %,与生理盐水组的 ( 178. 2 ±2. 3) % 比较存在显着性差异 ( P < 0. 05,P < 0. 01) . 而应用与 BAM8-22 结构类似但与 SNSR 受体不具亲合力的 BAM8-18 ( 30 nmol) 对大鼠的脚肿没有影响. 由此可见,BAM8-22 能明显促使脚肿的消退. 进一步应用另一种 SNSR 受体的激动剂 MSH 观察其对 CFA 炎性鼠脚肿的影响,得出了相同的结果. 从图 1 ( B) 中可以看出: 低剂量的 MSH ( 1. 7,5 nmol ) 不能抑制 CFA 引起的脚掌红肿,与Saline 对照组比较没有显着性差异 ( P > 0. 05) ,但应用高剂量的 MSH ( 15 nmol) 48 h 后,CFA 炎性大鼠的足跖红肿程度为 ( 160. 8 ± 3. 3) % ,与 Saline 对照组比较有统计学差异 ( P < 0. 05) ,以上结果进一步证明了激活 SNSR 受体能有效降低 CFA 炎性大鼠脚肿程度.
2. 2 大鼠炎症灶组织学观察
以下从组织学观察激活 SNSR 受体对炎症灶结构的影响. 从图 2 组织切片可见,正常大鼠足底皮肤由表皮和真皮层组织. 表皮包括角质层、透明层、颗粒层、棘层和基底层. 角质层各处厚薄不一,细胞轮廓不清,呈均质状. 透明层为很薄的一层粉红色的均质状结构组成,折光性强. 颗粒层由 2 ~5 层逐渐退化的细胞组成,呈梭形,与皮肤表面平行紧密排列. 棘层细胞由 2 ~ 5 层体积较大的细胞组成,胞体较大,细胞核大而圆. 基底层位于表皮的最下层,由一层立方形或矮柱状基底细胞紧密排列而成的一条波浪状结构 ( 图 2 ( A) ) ; 真皮层含大量的疏松结缔组织和少量弹性纤维,排列较为均匀整齐 ( 图 2 ( A) ) ; 真皮之下为皮下组织,含有大量脂肪细胞,H. E. 染色呈网格状,可见各级管径不等的动静脉 ( 图 2 ( B) ) . 皮下组织之下为足底的骨骼肌,骨骼肌排列整齐规则,在高倍镜下可见明暗相间的横纹,细胞核呈梭形,位于细胞膜下 ( 图 2 ( C) ) .
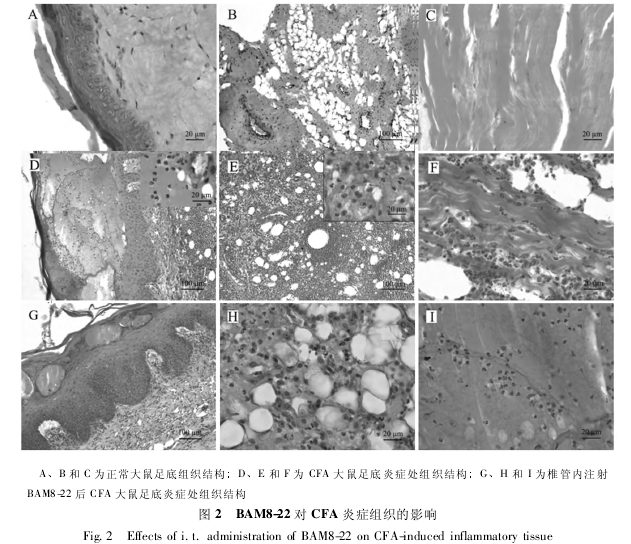
在生理盐水组,CFA 炎性组织结构出现了明显的变化: 表皮增厚,角质层纤维化明显. 在角质层与颗粒层之间出现大量的巨大水泡 ( 图 2 ( D) ) ,水泡内有大量的嗜中性粒细胞出现 ( 细胞核 2 ~4叶) 和蛋白质样溶质 ( 图 2 ( D) 中的小视窗) ; 棘层细胞层数增多,细胞体积增大 ( 图 2 ( D) ) ; 真皮层水肿明显,大量炎性细胞聚集一起,撑破组织,导致真皮层排列混乱 ( 图 2 ( D) ) ; 皮下组织也失去了原来的结构,脂肪组织变性,被大量的炎性细胞所取代,主要为中性粒细胞和淋巴细胞 ( 图 2( E) 中的小视窗) ,小毛细血管扩张,并有大量的炎性细胞渗出,以血管为中心聚集成团,形成炎性灶 ( 图 2 ( E) ) . 甚至在皮下的骨骼肌组织中,也有大量的炎性细胞渗入其中,导致肌纤维排列疏松混乱,明暗相间横纹不明显,肌纤维纤维化明显 ( 图 2 ( F) ) .
在 BAM8-22 ( 30 nmol) 组,炎症灶处的组织结构得到一定的恢复: 透明层明显,颗粒层增厚,其中水泡体积明显变小,水泡内白细胞数量减少; 棘层细胞层数明显增多,细胞体积增大 ( 图 2( G) ) . 真皮层疏松结缔组织排列较为规则,但仍可见一些炎性细胞 ( 图2 ( G) ) . 皮下组织炎症灶明显减少,可见脂肪细胞,组织间炎性细胞也明显减少 ( 图 2 ( H) ) . 骨骼肌纤维排列较为规律,体积显得较大,但仍可见一些嗜中性白细胞散布其中 ( 图 2 ( I) ) .
3 讨论
炎症的典型特征是红、肿、热、痛和功能障碍等局部变化. 完全弗氏佐剂 ( CFA) 是一种免疫佐剂,可以加强机体对抗原产生免疫的能力,诱导动物产生免疫反应性炎症. 足底注射 CFA 能引起类似于临床的炎症痛情形,能较好地复制炎症时的典型特征,是目前疼痛研究中一种理想的慢性痛模型[5-6].
牛肾上腺髓质 22 肽 ( bovine adrenal medulla 22,BAM22) 是目前发现的唯一一种体内自然存在的 SNSR 受体的激动剂[8]. 以前的研究发现,应用 BAM22 不仅能降低 CFA 炎性鼠的痛觉过敏,增强其抗伤害作用,还能削弱炎症灶处的肿胀现象[5]. 本文进一步从组织学角度,激活 SNSR 受体后这种肿胀消退时,炎症灶处的组织发生了哪些改变,为消炎提供组织学基础. 由于 BAM22 对 SNSR 受体和阿片受体均有亲合力[1,9],应用 BAM22 是通过 SNSR 受体还是阿片受体起作用的就无法确定. 因此,本次应用 SNSR 受体的特异性激动剂 BAM8-22 进行实验[1],专门观察是否是激活了 SNSR 受体导致削弱水肿现象. 由于目前 SNSR 受体还没有阻断剂,无法通过阻断的方式来观察阻断后的效果,所以本文特选用了另外两种多肽来证明 SNSR 受体的功能. BAM8-18 是一种与 BAM8-22 结构类似 ( 少了 4 个氨基酸残基) 但与 SNSR 受体没有亲合力的多肽[1],用其作为阴性对照,说明与 BAM8-22 结构类似的多肽并不能激活 SNSR 受体,参照 BAM8-22 使用剂量,BAM8-18 选择 30 nmol 剂量进行对照实验; MSH 含有 9 个氨基酸残基的多肽,是一种与 BAM8-22 结构完全不同但与 SNSR 受体具有亲合力的多肽[8],用其作为阳性对照,证明只有与 SNSR 受体具有亲合力的物质才能激活这个受体并发挥其功能.
本文通过组织学观察发现,应用 SNSR 受体激动剂能明显削弱 CFA 引起的足掌肿胀,主要是通过以下几个途径来实现的: ( 1) 减少渗出液的量,降低炎性水泡的体积; ( 2) 降低血管扩张和通透性,减少白细胞和淋巴细胞的渗出; ( 3) 改善恢复组织结构.
有研究表明,在组织损伤和炎症反应时,损伤部位将释放前炎性介质如肿瘤坏死因子 ( tumornecrosis factor,TNF) 、白细胞介素 ( inerleukin,IL) 、神经生长因子 ( nerve growth factor,NGF) 以及脑源神经营养因子 ( brain derived neurotrophic factor,BDNF) 等,这些物质进一步促进组织释放炎性介质,如前列腺素、缓激肽、P 物质 ( SP) 、组织胺、5-HT ( 5-hydroxytryptamine) 、血清素、NO、K+、H+以及降钙素基因相关肽 ( calcitionim gene-related peptid,CGRP) 等. 一方面增强外周伤害性感受器的敏化状态,使外周炎症部位持续产生伤害性冲动传入脊髓,引起中枢敏化,导致产生痛觉过敏; 另一方面,使炎症组织血管舒张、血浆蛋白和免疫细胞渗出增加并释放炎性介质,进而加剧了炎症组织的肿胀及痛觉过敏[10 -11]. 本课题组以前研究发现,激活 SNSR 受体后,能降低 CFA 炎性鼠的脊髓和背根神经节中 CGRP 和 nNOS 的表达[5]; 同时,还能调制阿片受体的功能,如能增强吗啡的抗伤害作用[12],延缓、翻转吗啡的耐受[13 -16],在 CFA 炎性痛中,还能促进脊髓和背根神经节中 MOR受体的 mRNA、脊髓中 β-内啡肽 ( β-endorphin) 和背根神经节中前阿皮素原 mRNA 的表达水平[6].
据此推测,激活 SNSR 受体很可能是通过以下两个途径直接或间接削弱炎症灶水肿: 一方面,BAM8-22 激活 SNSR 受体后通过直接抑制背根神经节中 nNOS 和 CGRP 等的表达[5],进而减少外周神经末梢NO 和其他炎性介质的释放,抑制血管扩张、血浆蛋白和免疫细胞的渗出[10 -11]; 另一方面,激活的SNSR 受体还可能促进背根神经节中 MOR 受体的表达,增强其功能,或促进阿片肽类物质的表达[6],进而间接降低炎性介质的释放,达到消炎效果,但确切机制有待于进一步探讨. 尽管如此,本实验有可能为研究激活 SNSR 受体产生消炎镇痛的药物打开新思路.
参考文献:
[1] Lembo P M,Grazzini E,Groblewski T,et al. Proenkephalin A gene products activate a new family of sensory neuron-specific GPCRs [J]. Nat Neurosci,2002,5 ( 3) : 201 - 209.
[2] Dong X,Han S,Zylka M J,et al. A diverse family of GPCRs expressed in specific subsets of nociceptive sensory neu-rons [J]. Cell,2001,106 ( 5) : 619 - 632.
[3] Chen T,Cai Q,Hong Y. Intrathecal sensory neuron-specifc receptor agonists bovine adrenal medulla 8-22 and( Tyr6) -γ2-MSH-6-12 inhibit formalin-evoked nociception and neuronal Fos-like immunoreactivity in the spinal cord of therat [J]. Neuroscience,2006,141 ( 2) : 965 - 975.
[4] Chen T,Hu Z,Quirion R,et al. Modulation of NMDA receptors by intrathecal administration of the sensory neuron-spe-cific receptor agonist BAM8-22 [J]. Neuropharmacology,2008,54 ( 5) : 796 - 803.
[5] 江剑平,付艳,洪炎国. 牛肾上腺髓质 22 肽削弱完全弗氏佐剂引起的早期痛觉过敏 [J]. 生理学报,2011,63( 1) : 9 -19.
[6] Jiang J,Wang D,Zhou X,et al. Effect of Mas-related gene ( Mrg) receptors on hyperalgesia in rats with CFA-inducedinflammation via direct and indirect mechanisms [J]. British Journal of Pharmacology,2013,170 ( 5) : 1027 - 1040.
[7] Yaksh T L,Rudy T A. Chronic catheterization of the spinal subarachnoid space [J]. Physiol Behav,1976,17 ( 6) :1031 - 1036.
[8] Grazzini E,Puma C,Roy M O,et al. Sensory neuron-specific receptor activation elicits central and peripheral nocicep-tive effects in rats [J]. P Natl Acad Sci USA,2004,101 ( 18) : 7175 - 7180.
[9] Boersma C J,Pool C W,Van Heerikhuize J J,et al. Characterization of opioid binding sites in the neural and intermedi-ate lobe of the rat pituitary gland by quantitative receptor autoradiography [J]. J Neuroendocrinol,1994,6: 47 - 56.
[10] Millan M J. The induction of pain: an intergrative review [J]. Prog Neurobiol,1999,57: 1 -164.
[11] Watkins L R,Maiser S F. Beyong neurons: evidence that immune and glial cells contribute to pathological pain states[J]. Physiol Rev,2002,82: 981 -1011.
[12] 江剑平,付艳,张文华,等. 牛肾上腺髓质 8-22 肽增加吗啡抗伤害作用 [J]. 福建师范大学学报: 自然科学版,2009,25 ( 2) : 97 -100.
[13] Jiang J,Huang J,Hong Y. Bovine adrenal medulla 22 reverses antinociceptive morphine tolerance in the rat [J]. Be-havioural Brain Research,2006,168 ( 1) : 167 - 171.
[14] 江剑平,陈雅娟,洪炎国. 椎管内注射牛肾上腺髓质 22 肽差异性翻转吗啡耐受作用 [J]. 生理学报,2006,58( 6) : 529 -535.
[15] Cai Q,Jiang J,Chen T,et al. Sensory neuron-specific receptor agonist BAM8-22 inhibits the development and expres-sion of tolerance to morphine in rats [J]. Behavioural Brain Research,2007,178 ( 1) : 154 - 159.
[16] 江剑平,胡粉娟,陈雅娟. 牛肾上腺髓质 8-22 肽在福尔马林持续性痛中对吗啡耐受的调制 [J]. 福建师范大学学报: 自然科学版,2013,29 ( 4) : 96 -102.





