摘 要: 神经干细胞长期存在于神经系统中, 在生理或病理状态下发挥重要的生物学功能。神经干细胞移植对神经系统疾病具有较好的治疗效果。神经干细胞移植治疗神经系统疾病的机制包括移植细胞本身对损失神经组织细胞的替代作用和移植细胞旁分泌所产生的旁观者效应。但移植细胞本身对损失神经组织细胞的替代作用非常有限。目前认为, 神经干细胞移植的治疗效果可能主要归因于神经干细胞的旁观者效应。神经干细胞的旁观者效应主要依靠生长因子、细胞因子、趋化因子、生物活性脂类、细胞外基质等旁分泌因子及细胞外囊泡, 通过不同的作用机制发挥神经系统保护作用。
关键词: 干细胞移植; 神经干细胞; 旁分泌; 神经营养因子; 细胞外囊泡;
随着社会发展和人口老龄化进程加快, 各种神经系统疾病, 如神经损伤性疾病、神经退行性疾病等成为困扰人类健康的重要问题。由于神经元具有不可再生性, 神经系统疾病的治疗难度大, 患者多有严重后遗症。神经干细胞是一类具有自我更新、多向分化潜能的干细胞, 能够分化为神经元、星形胶质细胞和少突胶质细胞[1]。神经干细胞作为一种种子细胞, 在神经干细胞移植中能替代损失的神经细胞, 支持损伤神经物理结构, 减少炎症反应, 以及分泌神经营养因子等[2,3], 目前已用于脊髓损伤、脑损伤、帕金森病等神经损伤或神经退行性疾病的治疗。但移植细胞本身对损失神经组织细胞的替代作用非常有限。神经干细胞本身可通过旁分泌机制调控微环境, 对干细胞自身特性的维持以及定向分化具有重要作用[4];在病理状态下, 神经干细胞可通过旁分泌进行细胞间应答[5]。因此认为, 神经干细胞移植的治疗效果可能主要归因于神经干细胞的旁观者效应。本文结合文献就神经干细胞的旁分泌类型、作用机制以及在不同疾病模型中的治疗效果作一综述。
1、 神经干细胞概述
1.1、 神经干细胞来源
在胚胎发育时期, 神经干细胞存在于大部分脑区, 而成体神经干细胞仅存在于脑内固定区域。1992年首次从大鼠脑组织纹状体中分离出神经干细胞[6], 之后脑室周、齿状回、海马等部位神经干细胞陆续被鉴定和分离出来[7]。目前认为, 成年哺乳动物神经干细胞所在区域为脑室下区和海马齿状回颗粒下层[8]。之后, 人们又陆续从脊髓、嗅球等组织分离出神经干细胞[9,10], 并形成了标准化分离、培养体系, 大大加速了神经干细胞的基础研究和临床转化应用。
1.2、 神经干细胞的特性
神经干细胞的生物学特性具有以下几点: (1) 来源于中枢神经系统, 具有多向分化潜能, 可分化为神经组织细胞; (2) 通过对称分裂产生的两个子细胞均为干细胞, 而通过不对称分裂产生的两个子细胞, 一个为干细胞, 另一个为祖细胞, 从而具有自我维持和自我更新能力; (3) 具有区域异质性, 如嗅球中间神经元和胼胝体的少突胶质细胞来源于室管膜下区的神经干细胞;齿状回神经元和星形胶质细胞来源于齿状回颗粒细胞下层的神经干细胞。
1.3、 神经干细胞的旁分泌功能
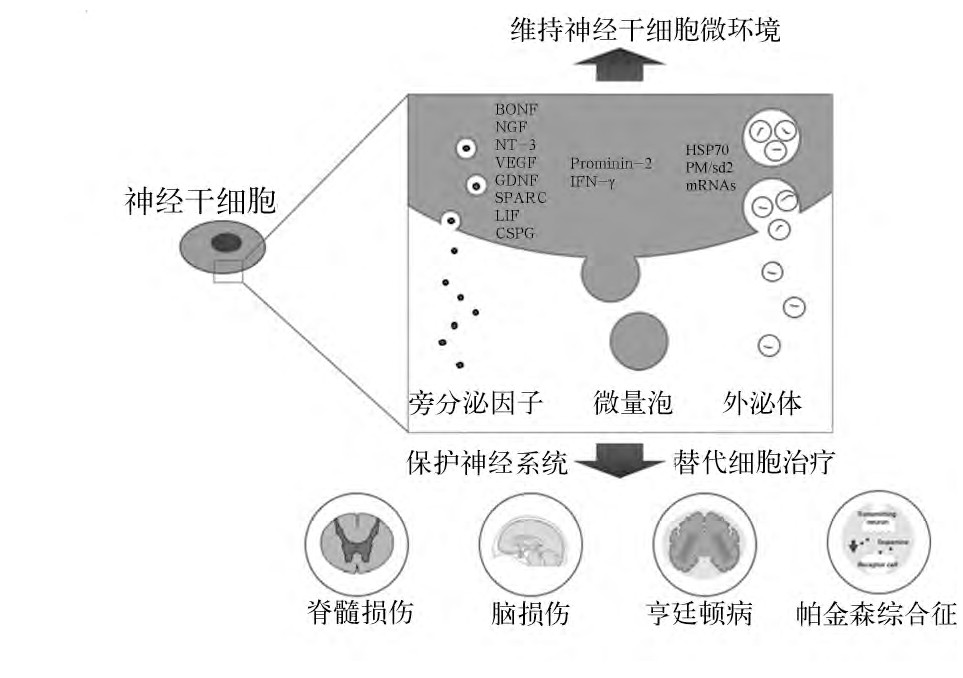
细胞之间的信号传递是调节细胞功能的重要方式, 包括内分泌、自分泌和旁分泌, 其中旁分泌是调节微环境稳态和应答外界不良刺激的重要机制。就神经干细胞而言, 其旁分泌方式可归纳为两类:一类包括生长因子、细胞因子、趋化因子、生物活性脂类以及细胞外基质等旁分泌因子, 一类是细胞外囊泡, 其中以外泌体最具代表性。见图1。
图1 神经干细胞旁分泌示意图
2、 神经干细胞旁分泌对神经系统的保护作用
神经干细胞移植治疗神经系统疾病的机制为移植细胞本身对损失神经组织细胞的替代作用和移植细胞旁分泌所产生的旁观者效应[11]。神经干细胞移植后能够在组织内存活, 并在一定条件下分化为神经细胞, 与原有组织形成生理性细胞间联系, 继而重建神经传导通路[12]。然而移植细胞面临的往往是一个病理性微环境, 结合移植本身带来的二次损伤, 易导致移植细胞坏死和凋亡。神经干细胞在自然分化状态下很难满足特定的细胞种类, 不能分化为理想的细胞种类。因此, 移植细胞本身对损失神经组织细胞的替代作用非常有限。目前认为, 神经干细胞移植的治疗效果可能主要归因于神经干细胞的旁观者效应。神经干细胞的旁观者效应是指神经干细胞旁分泌产物作用于移植部位对微环境所产生的优化, 包括减轻微环境中负性调控因子和增加内源性修复能力。研究证实, 脊髓损伤后神经干细胞移植能促进轴索再生, 增加髓鞘化, 并促进血管再生以及减少胶质瘢痕形成[13]。在卒中模型中发现, 移植的神经干细胞即使未分化, 仍能促进神经功能恢复[14]。在肌肉萎缩性侧索硬化症模型中, 移植的神经干细胞能够分泌神经营养因子, 促进运动神经元存活和再生[15]。提示这些过程同样依赖于神经干细胞的旁观者效应而非替代作用。
2.1、 旁分泌因子对神经系统的保护作用
2.1.1、 保护神经元
(1) 减少神经元凋亡。有研究发现, 神经干细胞条件培养基在体外能够增加M2型巨噬细胞比例, 并减少M1型巨噬细胞活化和炎性细胞因子释放, 脊髓损伤小鼠给予神经干细胞条件培养基, 能促进脊髓功能恢复[16]。持续给予脊髓损伤大鼠神经干细胞条件培养基还能增加皮质脊髓束和中间神经元之间的桥接, 减少神经元凋亡, 促进大鼠运动功能恢复[17]。另外, 在亨廷顿病大鼠模型中, 神经干细胞分泌的干细胞因子能够保护多巴胺能神经元, 减少神经元凋亡[18]。 (2) 分泌神经元保护因子。Lee等[19]研究发现, 神经干细胞条件培养基较普通培养基能够更好地发挥神经保护作用, 其保护作用归因于神经干细胞旁分泌的S-medium、神经生长因子 (NGF) 、神经胶质细胞源性营养因子 (GD-NF) 、血管内皮生长因子 (VEGF) 等神经营养因子。有研究证实, 神经干细胞移植后, 以脑源性神经营养因子 (BDNF) 为代表的多种神经营养因子在损伤部位表达持续升高[20];神经干细胞C17.2能够持续分泌神经营养因子, 包括BDNF、NGF、GDNF, 并且高表达NT3的神经干细胞还能显着增加NGF、BDNF表达[21];人源性神经干细胞能够分泌BDNF, 而且移植神经干细胞分泌的BDNF能够促进纹状体神经元存活[18]。
2.1.2、 神经重塑
研究发现, 神经干细胞移植能够增加中风患者脑组织VEGF、血小板反应蛋白1/2以及富含半胱氨酸的酸性蛋白表达, 而这些因子是促进树突生长、轴索可塑性和轴索运输的关键[14]。Chen等[22]通过对比神经干细胞条件培养基和普通培养基中32种细胞因子和趋化因子发现, 以白血病抑制因子 (LIF) 为代表的29种分泌因子均表达升高;神经干细胞分泌的LIF不仅能上调靶细胞LIF受体, 还通过JAK-STAT信号通路促进靶细胞增殖和存活[22]。有学者通过质谱分析方法从神经干细胞形成的神经球条件培养基中鉴定出了磷酸酶蛋白聚糖、载脂蛋白E以及血清胱抑素C, 其中磷酸酶蛋白聚糖是一种重要的硫酸软骨素蛋白聚糖, 能够促进神经球形成, 稳定神经球三维结构并促进神经干细胞本身存活, 其作用主要通过EGFR、JAK/STAT3及PI3K/Akt信号通路实现[23]。
2.1.3、 抗氧化应激
神经干细胞的旁分泌受细胞本身状态和微环境影响, 一些不良刺激能够引起细胞激活并促进细胞生长。目前已知的一些刺激因素, 如细胞激活、低氧或辐射、氧化应激等, 均可导致细胞旁分泌增加[24]。因此, 神经干细胞所处的特殊缺氧微环境可能决定其旁分泌产物具有增加细胞缺氧以及不良环境的耐受能力。研究证实, 神经干细胞条件培养基具有天然抗N-甲基-D-天冬氨酸导致的神经兴奋性毒性作用[25];使用3-硝基丙酸预处理神经干细胞能增加其抗氧化应激能力, 这一效应是通过增加神经干细胞BDNF、CNTF以及VEGF分泌实现的, 最终使神经元上调超氧化物歧化酶2实现抗凋亡和抗氧化应激作用[26]。
2.1.4、 免疫调理
研究证实, 神经干细胞移植能够在脊髓损伤中发挥免疫调理作用, 不仅能减少脊髓损伤后M1型巨噬细胞产生, 还能增加M2型巨噬细胞产生, 而M2型巨噬细胞能够吞噬细胞崩解产物并分泌抗炎因子, 起到抑制炎症反应的作用[27]。此外, 神经干细胞大量分泌的神经营养因子亦能减轻炎症反应[28]。在多发性硬化模型中, 移植的神经干细胞不仅能减少T淋巴细胞增殖, 还能通过分泌FasL、Trail、Apo3L等因子促进浸润的T淋巴细胞凋亡[29]。在中风模型中, 移植的神经干细胞也能通过旁分泌作用阻止外周巨噬细胞激活和动员[30]。
2.2、 旁分泌细胞外囊泡对神经系统的保护作用
近年来, 旁分泌细胞外囊泡获得了广泛关注。根据细胞外囊泡形成机制可分为微囊泡、外泌体以及凋亡小体[31]。在疾病治疗中具有潜力的主要是微囊泡和外泌体。微囊泡是由细胞质膜直接外翻形成的, 粒径较大 (100~1 000 nm) , 甚至可以包裹转运多核糖体[32]。外泌体是由多泡体与质膜结合释放的腔内囊泡, 粒径较小 (50~120 nm) , 可包裹大量蛋白质、mRNA以及miRNA, 其在细胞间信号转导中具有重要作用, 已成为当前研究的热点。
2.2.1、 外泌体来源蛋白
Kang等[33]通过串联质谱方法对人类神经干细胞来源外泌体进行蛋白测定, 鉴定出了103种蛋白, 包括HSP70、转铁蛋白受体、多肌炎/硬皮病自身抗原2等, 其中HSP70被认为是多种神经系统疾病的保护剂, 包括颅脑损伤、化学毒性神经损伤以及阿尔茨海默症, 其机制可能是通过抑制氧化应激而发挥保护作用的。在免疫调节方面, 神经干细胞的细胞外囊泡内蛋白质和核酸分选与炎症细胞因子诱导后干扰素γ信号通路激活有关;使用干扰素γ和肿瘤坏死因子α模拟神经炎症微环境, 可使神经干细胞的细胞外囊泡分选包装神经保护蛋白, 进而影响微环境中的T淋巴细胞、巨噬细胞、小胶质细胞以及树突细胞等免疫细胞, 从而改善微环境, 实现神经保护作用[34]。
2.2.2、 外泌体来源miRNA
Stevanato等[35]采用第二代测序技术对神经干细胞外泌体内的miRNA进行鉴定, 发现了113种miRNA;该研究还发现, 在miRNA包裹过程中存在明显的分选机制。目前已知多种miRNA对神经损伤和神经退行性疾病具有修复和治疗作用, 如miR-132、miR-21等, 神经干细胞在炎症等应激刺激下可通过独特的分选机制包裹保护性的miRNA, 进而将这些miRNA直接转运至靶细胞, 在靶细胞内表观遗传学水平调控细胞行为, 发挥神经保护作用。
综上所述, 神经干细胞能够通过旁分泌分泌多种因子及细胞外囊泡, 对神经系统起到神经再生、再髓鞘化、免疫调理及神经重塑等作用。目前对神经干细胞的旁分泌机制尚不完全清楚。今后研究的重点是进一步优化神经干细胞旁分泌的神经保护作用, 包括使用缺氧或辐射等理化手段刺激产生数量更多的旁分泌产物以及使用基因转染技术产生更多具有治疗潜力的因子或mRNA、miRNA等。神经干细胞的旁观者效应是神经损伤修复的重要机制, 其旁分泌产物对神经系统疾病治疗潜力巨大, 有可能成为替代神经干细胞移植的治疗手段。
参考文献:
[1]Assinck P, Duncan GJ, Hilton BJ, et al. Cell transplantation therapy for spinal cord injury[J]. Nat Neurosci, 2017, 20 (5) :637-647.
[2]Tang Y, Yu P, Cheng L. Current progress in the derivation and therapeutic application of neural stem cells[J]. Cell Death Dis, 2017, 8 (10) :e3108.
[3]Vanderhaeghen P. A butterfly effect on neural stem cells[J]. Neuron, 2017, 93 (4) :720-722.
[4]Bollini S, Gentili C, Tasso R, et al. The regenerative role of the fetal and adult stem cell secretome[J]. J Clin Med, 2013, 2 (4) :302-327.
[5]Drago D, Cossetti C, Iraci N, et al. The stem cell secretome and its role in brain repair[J]. Biochimie, 2013, 95 (12) :2271-2285.
[6]Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science, 1992, 255 (5052) :1707-1710.
[7]Mothe A, Tator CH. Isolation of neural stem/progenitor cells from the periventricular region of the adult rat and human spinal cord[J]. J Vis Exp, 2015 (99) :e52732.
[8]Landgren H, Curtis MA. Locating and labeling neural stem cells in the brain[J]. J Cell Physiol, 2011, 226 (1) :1-7.
[9]Weiss S, Dunne C, Hewson J, et al. Multipotent CNS stem cells are present in the adult mammalian spinal cord and ventricular neuroaxis[J]. J Neurosci, 1996, 16 (23) :7599-7609.
[10]Gritti A, Bonfanti L, Doetsch F, et al. Multipotent neural stem cells reside into the rostral extension and olfactory bulb of adult rodents[J]. J Neurosci, 2002, 22 (2) :437-445.
[11]De Feo D, Merlini A, Laterza C, et al. Neural stem cell transplantation in central nervous system disorders:from cell replacement to neuroprotection[J]. Curr Opin Neurol, 2012, 25 (3) :322-333.
[12]Gaillard A, Jaber M. Rewiring the brain with cell transplantation in Parkinson's disease[J]. Trends Neurosci, 2011, 34 (3) :124-133.
[13]Assinck P, Duncan GJ, Hilton BJ, et al. Cell transplantation therapy for spinal cord injury[J]. Nat Neurosci, 2017, 20 (5) :637-647.
[14]Andres RH, Horie N, Slikker W, et al. Human neural stem cells enhance structural plasticity and axonal transport in the ischaemic brain[J]. Brain, 2011, 134 (Pt 6) :1777-1789.
[15]Xu L, Yan J, Chen D, et al. Human neural stem cell grafts ameliorate motor neuron disease in SOD-1 transgenic rats[J]. Transplantation, 2006, 82 (7) :865-875.
[16]Cheng Z, Bosco DB, Sun L, et al. Neural stem cell-conditioned medium suppresses inflammation and promotes spinal cord injury recovery[J]. Cell transplant, 2017, 26 (3) :469-482.
[17]Liang P, Liu J, Xiong J, et al. Neural stem cell-conditioned medium protects neurons and promotes propriospinal neurons relay neural circuit reconnection after spinal cord injury[J]. Cell transplant, 2014 (23 Suppl 1) :S45-S56.
[18]Ryu JK, Kim J, Cho SJ, et al. Proactive transplantation of human neural stem cells prevents degeneration of striatal neurons in a rat model of Huntington disease[J]. Neurobiol Dis, 2004, 16 (1) :68-77.
[19]Lee NM, Chae SA, Lee HJ. Effects of neural stem cell media on hypoxic injury in rat hippocampal slice cultures[J]. Brain Res, 2017 (1677) :20-25.
[20]Baetge EE. Neural stem cells for CNS transplantation[J]. Ann N Y Acad Sci, 1993 (695) :285-291.
[21]Lu P, Jones LL, Snyder EY, et al. Neural stem cells constitutively secrete neurotrophic factors and promote extensive host axonal growth after spinal cord injury[J]. Exp Neurol, 2003, 181 (2) :115-129.
[22]Chen HC, Ma HI, Sytwu HK, et al. Neural stem cells secrete factors that promote auditory cell proliferation via a leukemia inhibitory factor signaling pathway[J]. J Neurosci Res, 2010, 88 (15) :3308-3318.
[23]Tham M, Ramasamy S, Gan HT, et al. CSPG is a secreted factor that stimulates neural stem cell survival possibly by enhanced EGFR signaling[J]. PLo S One, 2010, 5 (12) :e15341.
[24]Ratajczak MZ, Kucia M, Jadczyk T, et al. Pivotal role of paracrine effects in stem cell therapies in regenerative medicine:can we translate stem cell-secreted paracrine factors and microvesicles into better therapeutic strategies[J]. Leukemia, 2012, 26 (6) :1166-1173.
[25]Faijerson J, Thorsell A, Strandberg J, et al. Adult neural stem/progenitor cells reduce NMDA-induced excitotoxicity via the novel neuroprotective peptide pentinin[J]. J Neurochem, 2009, 109 (3) :858-866.
[26] Madhavan L, Ourednik V, Ourednik J. Neural stem/progenitor cells initiate the formation of cellular networks that provide neuroprotection by growth factor-modulated antioxidant expression[J].Stem Cells, 2008, 26 (1) :254-265.
[27]Cusimano M, Biziato D, Brambilla E, et al. Transplanted neural stem/precursor cells instruct phagocytes and reduce secondary tissue damage in the injured spinal cord[J]. Brain, 2012, 135 (Pt2) :447-460.
[28]Abrams MB, Dominguez C, Pernold K, et al. Multipotent mesenchymal stromal cells attenuate chronic inflammation and injury-induced sensitivity to mechanical stimuli in experimental spinal cord injury[J]. Restor Neurol Neurosci, 2009, 27 (4) :307-321.
[29]Pluchino S, Zanotti L, Rossi B, et al. Neurosphere-derived multipotent precursors promote neuroprotection by an immunomodulatory mechanism[J]. Nature, 2005, 436 (7048) :266-271.
[30]Lee ST, Chu K, Jung KH, et al. Anti-inflammatory mechanism of intravascular neural stem cell transplantation in haemorrhagic stroke[J]. Brain, 2008, 131 (Pt 3) :616-629.
[31]Gyorgy B, Szabo TG, Pasztoi M, et al. Membrane vesicles, current state-of-the-art:emerging role of extracellular vesicles[J].Cell Mol Life Sci, 2011, 68 (16) :2667-2688.
[32]Cocucci E, Racchetti G, Meldolesi J. Shedding microvesicles:artefacts no more[J]. Trends Cell Biol, 2009, 19 (2) :43-51.
[33]Kang D, Oh S, Ahn SM, et al. Proteomic analysis of exosomes from human neural stem cells by flow field-flow fractionation and nanoflow liquid chromatography-tandem mass spectrometry[J]. J Proteome Res, 2008, 7 (8) :3475-3480.
[34]Cossetti C, Iraci N, Mercer TR, et al. Extracellular vesicles from neural stem cells transfer IFN-gamma via Ifngr1 to activate Stat1signaling in target cells[J]. Mol Cell, 2014, 56 (2) :193-204.
[35]Stevanato L, Thanabalasundaram L, Vysokov N, et al. Investigation of content, stoichiometry and transfer of miRNA from human neural stem cell line derived exosomes[J]. PLo S One, 2016, 11 (1) :e0146353.





