
低等动物不像高等脊椎动物可以提取骨髓制备染色体分散片,其染色体的制备方法较少,很多动物因为都没能制备出合适的染色体片,而导致其相关遗传学研究收到影响.国内关于低等扁虫类染色体制备的方法最早见于李光鹏[1],一些研究者也曾进行过方法的改进[2,3],染色体制备方法的改进目的在于得到理想的结果,为进一步揭示它的生命现象本质提供可靠的遗传资料,本研究在前人基础上,采用离心重悬,对低等扁虫染色体制备各环节进行了相应改进,以供参考.
1 材料与方法
1.1 材料
采自南阳宝天曼的活体扁虫数条
1.2 药品
0.02%秋水仙素,0.1%KCL溶液,固定液I(酒精:冰醋酸:蒸馏水=3:3:4),固定液II(酒精:冰醋酸=1:1),固定液III(酒精:冰醋酸=1:4),5%Giemsa染色液.
1.3 方法
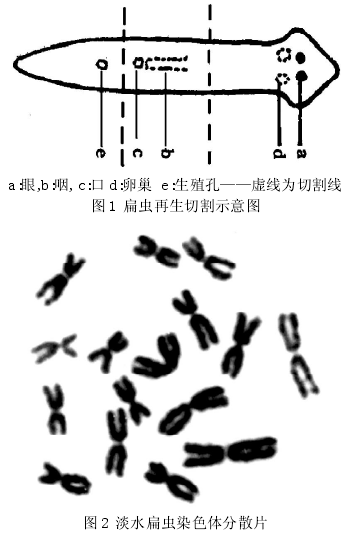
(1)再生组织的培养.取饥饿一周左右的健康虫体,用单面刀片于咽前和咽后切断虫体(如图1),片段放入培养皿加去氯自来水,控温15℃左右(冬季室内即可),培养3~5天.
(2)分离再生组织.再生良好的片段,用毛笔轻轻移至培养皿盖上,用单面刀片切下1mm左右的再生片段,放入去氯水的洁净培养皿中,余下虫体片段继续培养,可用于有关再生的其他实验.
(3)秋水仙素处理.分离得到的再生组织,加入少许0.02%秋水仙素(以能淹没材料为宜),然后在培养箱(15℃左右)中,处理1.5~2.5小时,观察材料状况,以近似圆形或椭圆形无解体现象者为优.
(4)低渗处理.将处理良好的再生组织,用0.1%KCL溶液冲洗2-3次,再加入少许0.1%KCL溶液,后于培养箱内处理1~1.5小时左右.
(5)离心重悬.将上述低渗处理过的组织移入2ml离心管,用无菌大头针轻轻捣碎.然后加入ml固定液I震荡30s,后1000r离心,弃上清;再加入固定液II重复一次.
(6)固定分离后细胞.上述离心管中,加入1ml固定液III,震荡30s,将混合液悬滴于干净的载玻片上,室温晾干即可.
(7)染色.上述制片用5%的Giemsa染液染色10-15分钟左右,用蒸馏水轻轻洗去多余的染液,室温晾干.
(8)封片.先在显微镜下粗略观察,选择染色体分散良好的涂片,用中性树胶(二甲苯稀释适中),封片保存.
2 结果
淡水扁虫染色体分散片如图2.
3 讨论
离心重悬处理是本实验的关键环节,它既可以去除细胞碎片的染色干扰,又可以使中期分裂细胞适度的破裂,得到分散良好的染色体结果.整个操作过程最好在室温(20℃)左右进行,而材料处理过程在15℃左右的恒温培养箱中进行,结果显示:中期分裂相多,染色体形态完整清晰.温度过高易导致操作过程和/或处理过程中扁虫再生片段的解体,很难完成实验.当然,以上几个环节的操作可适当调整,进一步优化.
参考文献
[1]李光鹏.淡水涡虫染色体的制备方法[J].动物学杂志,1992,27(5):30-31.
[2]马金友,陈广文,刘德增.中国淡水三角涡虫的染色体研究(I)[J].遗传学报,2003,30(11),1045-1050.
[3]刘翔.淡水涡虫染色体的制备方法[J].氨基酸和生物资源,2004,26(4):30~31.





