
腺苷( Adenosine) 化学名为 6-氨基-9-β-D-呋喃核糖基-9-氢嘌呤,在医药和食品领域有广泛的应用。早在 20 世纪 50 年代,应用微生物发酵法生产腺苷的研究就已经开始,但是对腺苷研究的报道主要集中在菌种的选育和培养基的优化,使用基因工程技术改造腺苷生产菌的研究却很少。本实验室保藏的腺苷生产菌 Bacillus subtilisXGL,是通过长期诱变筛选而成,但是进一步诱变对产苷影响不大,要获得更加优良的菌株,需要利用新的方法对其进一步改造。
前期研究显示,对嘌呤合成途径改造,改变途径中关键酶的活性进而影响嘌呤合成速率,可以有效地提高肌苷、核黄素的产量。因此,嘌呤合成途径的强弱直接影响核苷类物质的合成。嘌呤合成途径的重要中间代谢物肌苷酸( IMP) 是腺苷合成的直接前体物,肌苷酸的供应很可能是工程菌中腺苷合成通量的主要限制因素之一。因此,增加葡萄糖到IMP 的合成途径通量能够提高腺苷合成中前体物的供应,继而促进腺苷的积累。
在枯草芽孢杆菌中,嘌呤核苷酸合成相关的基因组成嘌呤操纵子,嘌呤操纵子( purEKB-purC( ORF) QLF-purMNH( J) -purD) 全长 13339 bp,由于嘌呤操纵子整体较大,而嘌呤合成途径中关键酶PRPP 转酰胺酶编码基因 purF 位于嘌呤操纵子的中下游,距离启动子较远,转录效率不高。因此本研究以 B. subtilis XGL 为出发菌株,以温敏质粒 pKS1 为骨架,构建整合质粒 pKF,利用单交换的方式将强启动子 P43 插入至嘌呤操纵子中,不仅过表达了嘌呤合成途径中关键酶 PRPP 转酰胺酶编码基因 purF,而且其下游基因 purM、purN、purH 和 purD 表达水平也得到不同程度的提高。这些相关基因的共同表达将比单一增强表达 purF 基因催化更多的嘌呤前体物谷氨酰胺、甘氨酸、10-甲醛四氢叶酸进入嘌呤途径,将更加有效地提高嘌呤合成途径通量。
1、 材料和方法
1. 1 材料
1. 1. 1 菌株和质粒: 表 1 为本研究所用菌株和质粒。
1. 1. 2 引物: 表 2 为本研究使用的引物,均由Primer Premier 5. 0 软件设计。
1. 1. 3 培养基:①种子培养基( g/L) : 葡萄糖 20,酵母粉 5,味精 5,蛋白胨 8,尿素 5,黄嘌呤 0. 03,L-组氨酸 0. 03,MgSO4·7H2O 0. 4,KH2PO41,玉米浆 25mL,豆饼水解液 10 mL,pH 7. 0。②摇瓶发酵培养基( g/L) : 葡萄糖 80,味精 10,黄嘌呤 0. 03,L-组氨酸0. 03,酵 母 膏 5,KH2PO41,MgSO4·7H2O 0. 4,( NH4)2SO45,CaCO320 ( 干热灭菌) ,豆饼水解液15 mL,玉米浆 15 mL,pH 6. 7,灭菌条件均为 115℃ ,15 min。培养基必要时添加 5 μg / mL 的红霉素。③发酵罐发酵培养基( g/L) : 葡萄糖 80,味精 12,酵母膏 18,葡萄糖酸钠 1. 5,黄嘌呤 0. 03,L-组氨酸0. 03,( NH4)2SO412,MgSO4·7H2O 5,K2HPO42,MnSO40. 06,FeSO40. 06,CaCl22,玉米浆 15 mL,pH6. 7。其中葡萄糖分消灭菌,灭菌条件均为 115℃ ,15 min。工程菌种子培养基添加 5 μg / mL 的红霉素。
1. 1. 4 主要试剂和仪器: Solution I 连接酶和 RNA提取试剂盒,大连宝生物工程有限公司; Taq DNA 聚合酶,北京全式金生物技术有限公司; 限制性内切酶和 1 kb DNA marker,Fermentas 公司; UltraSYBR 二步法荧光定量 PCR 试剂盒,北京康为世纪生物科技有限公司; 质粒小量快速提取试剂盒,北京博迈德生物技术有限公司; PCR 产物纯化试剂盒和胶回收试剂盒,北京天恩泽基因科技有限公司; 引物合成与基因测序,北京华大基因。实时定量 PCR 仪,美国ABI 公司; 电穿孔仪,Eppendorf 公司; 高效液相色谱系统,美国安捷伦公司。
1. 2 感受态的制备及转化
枯草芽孢杆菌的制作方法与转化方法参考文献,载体连接化学转化感受态制备及质粒连接体系转化均参照连接试剂盒和化学转化试剂盒说明书进行。
1. 3 实时定量 PCR 分析
将 B. subtilis XGL 和 B. subtilis XGLF 菌株接于5 mL 摇管过夜培养,以 1% 的接种量接种于 30 mL的 LB 培养基中培养至对数期,按照 RNA 提取试剂盒说明书提取总 RNA,利用反转录试剂盒获得cDNA,并以之为模板,以细菌 16S rRNA 为参比,通过实时定量 PCR,根据 2- ΔΔCT法计算相关基因的转录水平。
1. 4 PRPP 转酰胺酶活性检测
粗酶液的制备、蛋白质定量分析和 PRPP 转酰胺酶活性分析参见文献。
1. 5 细胞内 IMP 含量测定
胞内 IMP 含量的测定参考 Müller 等的方法,胞内 IMP 含量的测定改进如下: 取生长至对数期的菌液 1 mL,冰浴 5 min,然后 10000 × g,4℃ 离心 1min,弃上清后加入 250 μL 去离子水重悬,加入3 μL50 mg / mL 的溶菌酶,37℃ 处理 20 min,加入 250 μL细胞裂解液,混匀后室温下静置 5 min,然后加入约350 μL 的细胞中和液,10000 × g,离心15 min,取上清利用 HPLC 方法测定 IMP 的含量。
1. 6 发酵培养及分析方法
摇瓶培养条件参考文献,发酵周期为48 h。
发酵罐培养条件参考文献,发酵过程中,取适量发酵液稀释 20 倍后用紫外可见分光光度计测定600 nm 处的吸光度值,监测菌体生长情况。葡萄糖浓度采用 SBA-40E 生物传感仪测定。另取适量发酵液离心后取上清,用去离子水稀释 100 倍,将得到的稀释液用高效液相色谱法测定腺苷含量。
2、 结果
2. 1 整合质粒的构建
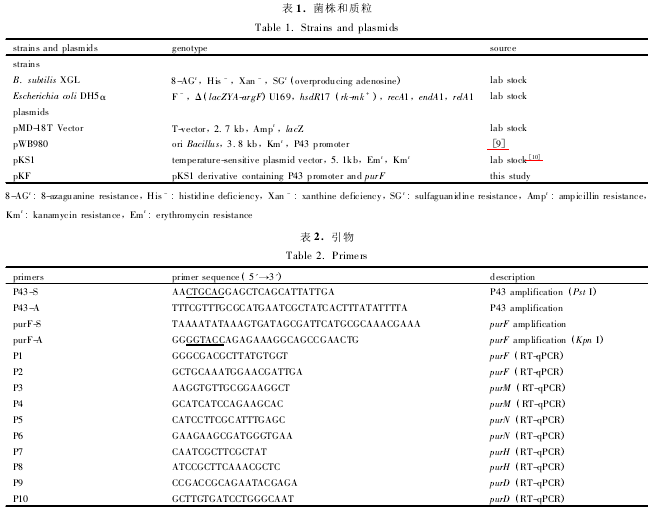
以 pKS1 质粒为基本骨架构建整合质粒 pKF。分别以质粒 pWB980 与腺苷生产菌 B. subtilis XGL的基因组为模板,引物分别为 P43-S、P43-A 和 purF-S、purF-A 扩增强启动子 P43 与基因 purF。采用重叠 PCR 的方法扩增重叠片段 P43-F,以上述 PCR 产物为模板,P43-S、purF-A 为上下游引物进行重叠PCR,扩增出重叠片段 P43-F。经限制性内切酶 Pst I和 Kpn I 双酶切重叠片段和温敏质粒 pKS1,切胶法回收重叠片段和载体,通过 Solution I 连接,构建整合质粒 pKF。
2. 2 质粒 pKF 整合 B. subtilis XGL
重叠片段中 purF 基因作为与基因组进行整合的位点,通过单交换整合的方式将质粒 pKF 整合到基因组上,使强启动子 P43 插入到基因组 purF 基因的上游。构建步骤如图 1 所示。
2. 3 相关基因的转录分析
通过单交换整合的方式,将强启动子 P43 插入嘌呤操纵子中,以加强嘌呤合成途径的通量。purF、purM、purN、purH 和 purD 作为紧邻 P43 启动子后的基因,其 mRNA 含量可以反映嘌呤操纵子的转录水平。本文对相关基因的转录水平进行 RT-qPCR 分析,与出发菌株 B. subtilis XGL 相比,purF 基因及其下游 purM、purN、purH 和 purD 基因的表达水平在工程菌 B. subtilis XGLF 菌株中均有不同程度的提高,分析结果见表 3。
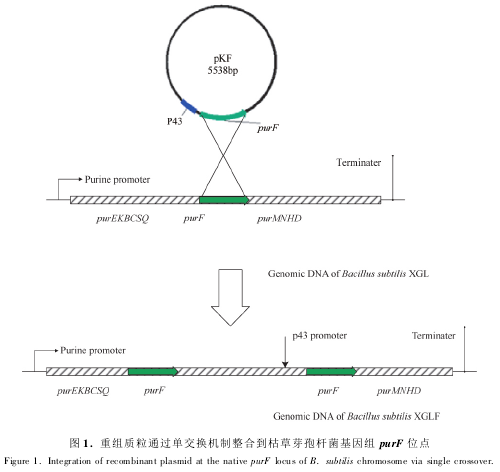

2. 4 PRPP 转酰胺酶活性分析
PRPP 转酰胺酶是嘌呤合成途径中的第一个酶,催化 5-磷酸核糖焦磷酸生成 5-磷酸核糖胺,而且是肌苷酸 IMP 合成的限速酶,其活性的高低直接影响嘌呤前体物 IMP 的生成,进而影响腺苷的合成量。酶活性分析结果( 图 2) 表明 purF 基因的过表达使工程菌 B. subtilis XGLF 的 PRPP 转酰胺酶的活力达到19. 2 U/g,是出发菌株 B. subtilis XGL 的2. 4倍。
2. 5 胞内 IMP 含量分析
IMP 主要是在枯草芽孢杆菌嘌呤合成途径中生成的,其含量可以直接表征嘌呤合成途径通量的强弱。此外,IMP 还是腺苷合成的重要前体物,IMP 的供应会直接影响腺苷的合成,因此,本文对枯草芽孢杆菌细胞内 IMP 的含量进行检测分析。结果表明,工程菌 B. subtilis XGLF 胞内 IMP 含量明显高于出发菌 B. subtilis XGL,说明 P43 启动子的插入能够加强嘌呤途径合成通量,从而可增加腺苷前体物 IMP的供给量。出发菌 B. subtilis XGL 和工程菌 B.subtilis XGLF 胞内 IMP 含量见图 2。
2. 6 腺苷发酵
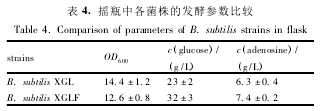
为了研究嘌呤合成途径的改造对腺苷积累的影响,本研究进行了腺苷摇瓶发酵和 5 L 发酵罐腺苷发酵,分别比较了出发菌和工程菌的生长情况、耗糖速率和腺苷产量。表 4 为腺苷摇瓶分批发酵 48 h后的发酵参数。由结果可知,与出发菌 B. subtilisXGL 比较,嘌呤合成途径改造后的工程菌腺苷产量提高 17. 5%,糖苷转化率提高 26. 1%,但是菌体生物量却有所减少。由于嘌呤合成途径的改造提高了相关基因的转录表达,另外,整合的重组质粒 pKF约5. 5 kb,还包含了抗性基因,这些都可能增加了工程菌生长代谢的负担,导致菌体生长受到影响。此外,本研究在 5 L 发酵罐上进行了腺苷的分批发酵实验。结果显示( 图 3) ,在同样投入 80 g/L 葡萄糖的情况下,出发菌 B. subtilis XGL 发酵 32 h 后葡萄糖已消耗完,但腺苷对葡萄糖得率仅有 0. 092 g 腺苷/g 葡萄糖; 然而在同样发酵时间下,工程菌 B.subtilis XGLF 的腺苷对葡萄糖得率为 0. 123g 腺苷 / g葡萄糖。

3、 讨论
本实验室前期工作中曾经利用穿梭表达质粒pBE43,构建含有 PRPP 转酰胺酶编码基因 purF 的重组质粒并转入腺苷生产菌 B. subtilis XGL,试图增加嘌呤合成途径中限速酶量来增加腺苷合成前体物的生成,进而提高腺苷的产量。但实验结果表明,单独过表达 PRPP 转酰胺酶不能提高腺苷产量,这可能是因为单个基因的过表达会导致胞内代谢通量失衡,并使终产物合成途径中的某种中间产物积累过多而对细胞造成毒性。本研究基于代谢工程理论,对枯草芽孢杆菌嘌呤合成途径进行了改造,利用单交换的方式将 P43 启动子插入嘌呤操纵子中基因purF 上游,增加关键酶基因 purF 及相关基因 purM、purN、purH 和 purD 的转录表达水平,达到了嘌呤合成途径增强的目的。
本研究中工程菌 B. subtilis XGLF 积累腺苷的能力增强,可能是由于 P43 启动子的插入使 purF、purM、purN、purH 和 purD 的表达强度得到了不同程度的增强。这些基因编码的产物谷氨酰胺、甘氨酸和 10-甲醛四氢叶酸均是嘌呤合成的前体物,同时也是嘌呤途径的重要节点,改变这些分支节点的通量比例,使更多的嘌呤前体物进入嘌呤合成途径,提高嘌呤合成途径通量,从而提高腺苷产量。此外,本研究选择在嘌呤操纵子的 purF 位点上游插入强启动子,主要是因为 purF 编码蛋白为嘌呤合成途径的限速酶,该酶的过表达有助于解决代谢瓶颈。
本研究通过单交换整合的基因操作除了达到提高关键基因拷贝数的目的,还将庞大的嘌呤操纵子分成了 2 个较小的操纵子,从而提高嘌呤合成代谢中其它基因的转录水平。细胞内 IMP 含量的测定结果显示工程菌 B. subtilis XGLF 胞内 IMP 含量升高,这说明工程菌嘌呤合成途径得到了加强,嘌呤操纵子的改造达到了预期的效果。但是,改造后工程菌生长受到影响,耗糖速率减慢,这可能是因为重组质粒插入枯草芽孢基因组后增加了工程菌生长的负担,导致工程菌代谢减慢,从而耗糖速率减慢。相似的结果在核黄素的研究中也被报道。因为枯草芽孢杆菌中 IMP 的生成主要来源于嘌呤合成途径,而嘌呤合成途径通量的增加将有利于提高腺苷产量。
下一步研究拟在工程菌 B. subtilis XGLF 的基础上对 IMP 到腺苷的代谢途径进行改造,如增加腺苷合成关键酶———腺苷琥珀酸合成酶编码基因 purA 的拷贝数,从而增强由 IMP 至腺苷的代谢通量,可进一步提高腺苷的产量。





