摘要:近年来,3D生物打印技术引起了生物医学工程和临床应用领域人们的广泛关注。这种技术允许无与伦比的结构控制,可以克服传统生物制造技术的限制。同时可以精确分配载细胞的生物材料,用于构建复杂的3D功能活体组织或人造器官。利用3D生物打印技术,多种基于GelMA的生物墨水得到了开发和应用。综述了3D生物打印技术的原理、GelMA的合成和表征以及GelMA在3D生物打印技术中的研究进展及应用。
关键词:GelMA;3D生物打印技术;生物墨水;水凝胶;
3D生物打印技术是生物制造、增材制造、组织工程和再生医学融合的产物。利用计算机辅助设计软件(CAD),将含活细胞的生物材料(生物墨水)连续堆叠和组装,从而设计出一个有活性的三维结构。该技术旨在人工开发活体组织和器官的替代品,用于组织工程、再生医学、药代动力学和生物学研究[1]。
一种理想的生物墨水应该具有目标组织的适当的机械、流变和生物特性,这对确保生物打印组织和器官的正确功能至关重要。GelMA由于其具有的可调节机械性能、良好的生物相容性、原位光聚合能力以及可打印性,越来越被人们认为是一种重要的生物墨水材料[2]。GelMA合成最早是由BULCKE等报道的,GelMA是一种基于明胶的工程材料,已被证明可用于组织工程、药物输送、细胞培养和3D打印等领域[3]。
近几年,基于GelMA水凝胶的生物墨水在3D生物打印技术中被大量研究,这些研究主要集中于生物医学领域,本文总结了3D生物打印技术的原理、GelMA的合成和表征以及GelMA在3D生物打印技术中的研究进展及应用,以期为基于GelMA的3D生物打印技术的应用提供参考。
1 3D生物打印技术
组织工程的成功主要依赖于构建复杂、充满细胞的3D结构能力,这些结构与原始的活组织非常相似。因此,设计和创建生物材料支架的结构和地形的策略是功能性组织工程的一个重要方面。根据工作原理,3D生物打印技术可分为3种,即喷墨生物打印、激光辅助生物打印、挤压生物打印。这些生物打印策略可以单独使用或联合使用,以实现预期的目标和组织制造。
1.1 喷墨打印
喷墨生物打印与传统的2D喷墨打印非常相似。将生物墨水储存在墨盒中,然后将该墨盒连接到打印机头,并在电子控制的打印过程中充当生物墨水源。在打印过程中,通过热致动器或压电致动器使打印头变形并挤压产生可控制大小的液滴,如图1(a)所示。喷墨打印的优势为构造简单、成本低、打印速度快、有较高细胞生存能力(通常从80%到90%)。缺点也相当明显,如高黏度的材料或高密度的细胞会导致喷头堵塞。
1.2 激光辅助打印
这种生物打印策略源于激光诱导正向转移(LIFT)效应,以精确和微米分辨率打印不同的活细胞和生物材料。激光辅助打印系统的关键部分是响应激光刺激的供体层。该供体层为缎带结构,顶部为吸能层(如钛或金),底部为悬浮生物墨水溶液层。在印刷过程中,聚焦的激光脉冲用于刺激吸收层的一小片区域。激光脉冲使部分供体层汽化,在生物墨水层的界面产生高压气泡,推动悬浮生物墨水[4]。下落的生物液滴被收集到接收底物上,然后交联,如图1(b)所示。与喷墨打印相比,激光辅助打印可以避免分配器与生物墨水之间的直接接触。这种非接触式打印方法不会对细胞造成机械压力,因此细胞存活率高通常高于95%。此外,激光辅助打印可以打印高黏性材料。缺点是成本较高,同时由于激光源的存在通常使这类打印机比较笨重和复杂。
1.3 挤压打印
挤压打印是喷墨印刷的一种改进。为了打印喷墨打印机无法沉积的黏性材料,挤出打印使用空气泵或机械螺杆柱塞来分配生物墨水,如图1(c)所示。通过施加一个连续的力,挤压印刷可以打印不间断的圆柱线,而不是单一的生物墨水滴。几乎所有类型的不同黏度的水凝胶预聚合物溶液以及细胞密度高的聚集物都可以用挤压生物打印机打印。
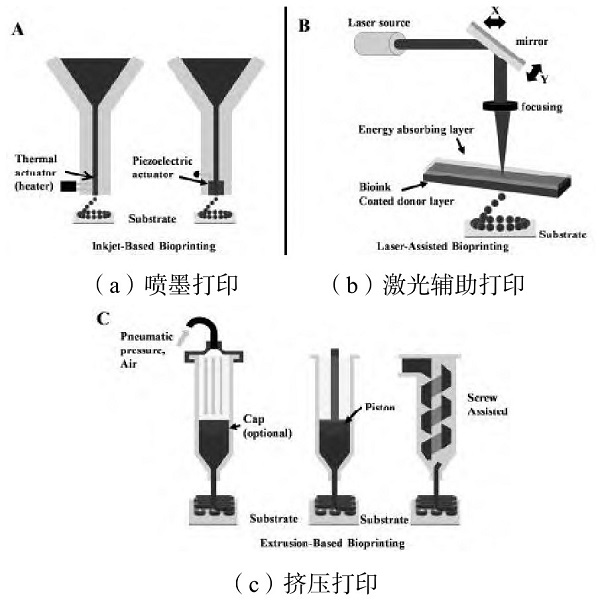
图1 3D生物打印技术原理图[4]
2 GelMA的合成
制备GelMA的方法,都是基于BULCKE等首次报道的一般方法的微小变化。合成方法如下[5]:将明胶加入至PBS中,50℃搅拌至完全溶解,然后以一定的速率加入MA,反应3 h。混合溶液用PBS稀释以停止反应,通过透析5~7 d,完全去除具有潜在细胞毒性的低分子量杂质。最后,将透析液冷冻干燥后冷藏待用。
3 GelMA生物墨水表征
生物墨水在生物打印中扮演着重要的角色。它们不仅与细胞直接接触以提供结构支持,而且还支配着生物墨水的化学和物理特性。理想情况下,用于生物打印的水凝胶应该具有如下特性。
3.1 可打印性和可交联性
可打印性指生物墨水和基质之间的关系,可以打印出准确、高质量的结构。在生物打印中,可打印性通常与表面张力有关。生物墨水经加压后,只有快速交联才能保证打印结构的保真性。
3.2 机械性能
水凝胶应在聚合后保持足够的机械性能,为细胞提供稳定的附着、增殖和分化环境[6]。这些力学性能包括应变、剪切应力、压缩模量和质量膨胀比。
3.3 生物相容性
生物相容性指材料在特定情况下与宿主发生适当反应的能力。生物相容性要求材料本身对细胞增殖无害,并具有提供与细胞适当结合的能力。同时要求材料可以被细胞降解或与细胞融合,而不会产生有害的副产品或与细胞产生负面的相互作用。
3.4 降解性
不受控制的快速降解是GelMA在生物医学领域面临的主要挑战,组织支架的基本职责是在整个结构的预期使用寿命内保持细胞增殖和所需的细胞分布。因此在设计生物墨水时,一个重要的考虑因素是支架在生物降解和愈合过程中的功能依赖性在支架和新生组织之间的转变。
4 3D生物打印技术应用
本部分从几种常见的组织类型等方面综述了3D生物打印技术的应用现状。
4.1 血管
传统的微加工技术无法创建复杂的多尺度结构,如血管内皮与周围结缔组织和薄壁细胞之间的界面,3D生物打印技术可能解决这个问题。例如TURNER等[7]设计了一种定制的细胞响应型生物墨水,该墨水由GelMA外壳包裹着肽功能化的细胞负载的琥珀酰壳聚糖/葡聚糖醛核心,成功地进行了生物打印,结果产生了有组织的微设计,显示出出色的细胞活力及随后血管形成。XU等[8]在GelMA中添加透明质酸、甘油和明胶,形成具有良好打印性、机械强度和生物相容性的生物墨水,利用三维微挤压生物打印机在固体平台上一步制备出一种小直径、异质双分子层血管样结构,与天然血管高度相似,保持了较高的细胞存活率和增殖能力。
4.2 软骨
迄今为止,关节软骨损伤的治疗仍然具有挑战性。混合生物打印结合了发育生物学、生物材料科学和3D生物打印的原理,是发展新的再生疗法的一个有前途的策略。在这种方法中,使用小直径的无支架软骨微组织作为构建块,与光交联水凝胶结合,然后进行生物打印。ZHOU等[9]利用GelMA和聚二丙烯酸酯打印3层梯度支架,涂上赖氨酸功能化玫瑰形纳米管,以改善脂肪来源间充质干细胞的软骨分化。结果表明可以促进间充质干细胞增值分化,软骨形成良好。MU等[10]从人体脂肪组织分离脂肪干细胞(hADSCs),取第3代细胞与GelMA水凝胶和光引发剂混匀制成生物墨水,然后采用3D生物打印技术制备出hADSCs-GelMA复合支架。对其进行培养检测,结果表明复合支架具备稳定的三维结构,细胞存活率高,可在体内、外诱导分化为软骨组织,可用于体内外构建组织工程软骨。以上研究为应用3D生物打印技术构建组织工程软骨提供了一定的思路和研究基础。
4.3 皮肤
现在,利用3D生物打印技术可以模拟和制造出人体最大、最复杂的多层器官,即皮肤。3D打印皮肤具有巨大的潜力,可用于伤口愈合、烧伤皮肤置换以及用于产品和药物测试的体外人体皮肤模型。ZHOU等[11]研究利用基于GelMA的仿生生物墨水结合数字光处理的3D打印技术,成功打印出一种功能活性皮肤,具有相互连接的微通道,促进细胞迁移、增殖和新组织的形成。体内研究表明,活体皮肤具有即时防御功能,在促进大型动物皮肤附肢真皮再生方面具有优越的表现。JIN等[12]利用脱细胞真皮基质和GelMA生物墨水,成功打印出一种功能皮肤模型(FSM)。研究表明FSM不仅能促进细胞增殖和存活,还能支持体外表皮重建。在体内移植后,FSM可维持细胞活力至少1周。此外,FSM促进创面愈合和上皮再生,刺激真皮ECM分泌和血管生成,提高创面愈合质量。
5 结语
生物打印技术是一种先进的基于生物墨水负载细胞的技术,具有广阔的发展前景,同时也面临许多挑战和问题。由于生物打印在微尺度、高通量、细胞沉积等方面的优势,其应用正在迅速扩大。基于GelMA的3D生物打印技术已成为一种强大的制造工具,以创建复杂的微观和宏观尺度生物医学系统。即使已经取得了这些进展,生物打印仍然是一项具有惊人潜力的新兴技术。
参考文献
[1] DECANTE G,COSTS J B,SILVA-CORREIA J,et al Engineering bioinks for 3D bioprinting[J] Biofabrication,2021,13(3):032001.
[2] BAE L,NATHANIEL L,LI S,et al.Synthesis and characterization of types a and b gelatin methacryloyI for bioink applications[J].Materials,2016,9(10):.797.
[3] VAN D, BOGDANOV B, ROOZE N D, et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels[J]. Biomacromolecules ,2000,1(1):31-38.
[4] IM A.GK A.ASBCD F,et al.Progress in 3D bioprinting technology for tissue/organ regenerative engineering-scienceDirect[J] Biomaterials,2020,226:119536.
[5]梦玲光交联水凝胶可打印性与生物活性研究[D].杭州:浙江大学, 2019.
[6]法理,顾忠伟生物3D打印高分子材料发展现状与趋势[J]中国材料进展, 2018,37(12):22.
[7] TURNER P R,MURRAY E,MCADAM C J,et al.Peptide chitosan/dextran core/shell vascularized3D constructs for wound healing[J] ACS applied materials&interfaces ,2020, 12(29):32328-32339.
[8] XU L, VARKEY M, JORGENSEN A, et al. Bioprinting small diameter blood vessel constructs with an endothelial and smooth muscle cell bilayer in a single step[J] Biofabrication,2020, 12:045012.
[9] ZHOU X,TENAGLIO S, ESWORTHY T,et al.Three-dimensional printing biologically inspired DNA-based gradient scaffolds for cartilage tissue regeneration[J] .ACS applied materials&interfaces,2020, 12(29):33219-33228.
[10] MU L,ZENG J.HUANG Y,et al.Experimental study on tissue engineered cartilage constructed by three-dimensional bioprinted human adipose-derived stem cells combined with gelatin methacryloyI[J].Chinese journal of reparative and reconstructive surgery,2021,35(7):896-903
[11] ZHOU F,HONG Y,LIANG R,et al.Rapid printing of bio-inspired 3D tissue constructs for skin regeneration[J] Biomaterials ,2020,258:1202
[12] JIN R,CUI Y,CHEN H.et al.Three-dimensional bioprinting of a fll-thickness functional skin model using acellular dermal matrix and gelatin methacrylamide bioink[J] .Acta biomaterialia,2021,131:248-261.





