摘 要: 单克隆抗体药物是生物药物的重要分支,因其靶向性、特异性高而受到广泛关注。随着单克隆抗体技术的不断发展,抗体药物在疾病预防、诊断和治疗方面发挥着举足轻重的作用。但是,抗体药物作为一种人工合成蛋白质的天然属性,其在生产、储存及体内使用过程中,容易受到体内外复杂环境的物理和化学方面的影响,发生多种形式的理化性质改变,进而导致其免疫原性增加,半衰期缩短,甚至失效。因此如何提升抗体药物的稳定性,降低免疫原性,延长半衰期,提高其体内生物利用度是目前抗体药物应用中亟待解决的关键问题。本文从影响抗体稳定性的因素(结构、环境及制备工艺)、理化机制以及提高抗体稳定性的方法等几个方面,对近期文献报道的相关研究进行简要的综述。
关键词 : 单克隆抗体;理化因素;稳定性提高;生物制药;
Abstract: Monoclonal antibody(mAb)drugs have attracted widespread attention for their high targeting and specificity as an important branch of biopharmaceutics. With the rapid development of mAb drugs,they play an irreplaceable role in disease prevention,diagnosis and treatment. While as a kind of large synthetic molecule,due to its natural attribute,the mAb is easy to be affected in stability by the physicochemical factors in vitro and vivo during manufacturing,storage and application. Various forms of physical and chemical properties change of mAb will lead to increased immunogenicity,shortened half-life,and even failure. Therefore,how to improve the stability,reduce immunogenicity,extend half-life,and then increase bioavailability is a key issue that needs to be urgently solved in the application of antibody drugs. This article review the latest research about the factors including protein structure,environmental stress,manufacturing technique that affect the antibody stability. Besides,the mechanism and the methods of optimization are also referred.
Keyword: Monoclonal antibody; Physicochemical factors; Stability improvement; Biopharmaceutical;
在过去的30年里,单克隆抗体(monoclonal anti?body,mAb)的研发和优化技术已经取得了长足的发展,现阶段治疗性单克隆抗体药物已经广泛应用于自身免疫病、肿瘤以及病毒感染等疾病的临床治疗或预防,且已成为生物制品类药物中发展最快的一类。学者们在长期研究中除了重点关注抗体结构的优化,还针对抗体稳定性的各种影响因素提供了诸多解决方案,以此降低抗体药物的开发、储存成本,并提高其临床疗效[1,2,3]。本文简要回顾了近些年单克隆抗体稳定性的影响因素和理化机制以及抗体稳定性改造方案等方面的研究进展。
1 、抗体分子结构及稳定性研究意义
1.1、 抗体分子结构
抗体是指由机体产生能与抗原特异性结合的免疫球蛋白。抗体由B淋巴细胞转化而来的浆细胞分泌产生,每个B淋巴细胞株只能产生一种它专有的、针对一种特异性抗原决定簇的抗体。这种从一株单一细胞系产生的抗体就叫单克隆抗体(mAb),简称单抗。常规的单抗分子是由两条重链(HC)及两条轻链(LC)通过链间二硫键连接成“Y”形结构(图1),它又可分为3个功能组分:两个抗原结合片段(Fab)和一个结晶区(Fc),两个Fab通过铰链区连接到Fc,且构象变化相比于Fc更为灵活。由来自重链和轻链的一对可变区(VH和VL)组成Fab的Fv区,通常Fv区被糖基化修饰,是决定抗体如何与适应性免疫及体液免疫系统中的其他成分相互作用的关键。
1.2 、稳定性研究意义
研究发现,某些单克隆抗体药物虽然在体外实验中表现出良好的药物活性,但在进入临床试验阶段却会遭遇到体内活性降低的问题[4]。因此在药物研发的初期就要兼顾其药效动力学的问题。抗体药物的稳定性是影响抗体药效动力学的关键因素之一,首先抗体的高亲和力与高特异性都需要以稳定的结构为基础,这是其正确行使生物学功能的保障。其次,抗体的稳定性越高,则其新生肽链在细胞内装配时产生错误折叠(mis-folding)的概率越低,可溶性表达量也越高[5]。良好的热稳定性所带来的紧凑结构使抗体的蛋白酶切位点更不易暴露,并其影响药品保质期及存放条件,关系到药物成本。目前,提高蛋白质热稳定性的方法主要有非共价修饰、化学修饰、添加蛋白质稳定剂、蛋白质工程,以及在液体状态利用矿化技术直接在蛋白表面形成磷酸钙矿化外壳以提高蛋白质的稳定性[6]。
由此可见,在保证抗体亲和力及表达量等性质不受太大影响的情况下,最大程度上提高其稳定性,对抗体药物的研发具有重要的现实意义。
图1 完整IgG抗体带状图[来源:蛋白结构数据库(PDB);ID:1igt]
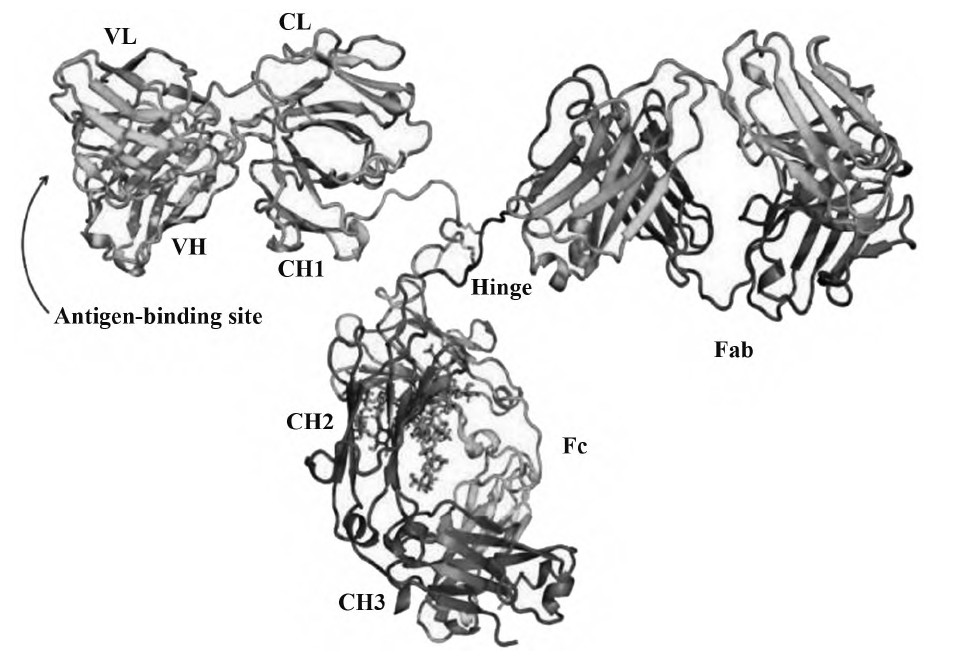
Fig.1 Complete structure of IgG[From:Protein Data Bank(PDB);ID:1igt]
2 、影响抗体稳定性的因素
2.1、 抗体分子自身性质
抗体分子一级结构(蛋白序列)对其聚集性有着重要影响,例如当抗体分子的等电点(pI)过高或过低时决定簇互补区(com?plementarity-determining region,CDR)都会促进聚集,不同的是较低pI的分子所产生的分子间静电相互作用形成了可溶的聚集物,而较高pI的分子,尤其是当和带有负电荷的容器表面接触时,则会形成沉淀性聚集[7]。例如有研究比较了英夫利昔单抗(infliximab)及其仿制药在强制性降解试验(forced degradation)中的表现[8],发现二者尽管在生产工艺和制造过程上有些许不同,但在该试验中并未表现出明显差异,说明一级结构仍然在很大程度上决定了抗体分子的稳定性。还有研究比较了IgG分子的3个亚型(IgG1、IgG2、IgG4)在分别经过酸性处理(pH=3.3)之后的表现,结果IgG1保持了单体形式,而另外两个亚型均表现出二聚化倾向,且当恢复到正常pH时导致IgG4形成聚集体[9]。该结果与pH在4~7范围内IgG亚型聚集性(IgG1<IgG2<IgG4)的强弱对比相印证[10]。KERR等[11]通过高分辨率质谱分析了治疗性抗体高级结构(HOS)对曲妥珠单抗、贝伐珠单抗及利妥昔单抗药物储存的影响,发现贝伐珠单抗可变区和恒定区在特定温度下存在肽键水解。
2.2、 环境应力因素
温度:高温能够破坏单抗结构,且通常不可逆,进而导致聚集;同时伴随温度增高,脱酰胺和氧化反应发生的概率也增加[12]。当环境温度下有50%左右的蛋白天然结构展开时,将该温度定义为熔解温度(melting temperature,Tm),每种蛋白都有其Tm,一般该温度范围为40℃~80℃之间,而通常生物药品储存运输的温度在2℃~8℃之间,远低于该温度[13]。此外过低温也会引起蛋白变性,尤其是在反复冻融的情况下。随着冻融次数增加,会出现缓冲液pH值下降、溶质分子浓缩、水冰界面形成等因素的影响[14]。当0.5 mg/ml贝伐珠单抗(bevacizumab)溶液经受1~30次冻融循环时,其单体峰通过(size exclusion chromatography,SEC)分析,发现随着循环次数的增加而降低。在类似的研究中,对于固定数量的循环冻融(10个循环),单体峰值随着贝伐珠单抗浓度的增加而降低,这表明在较高浓度下冻融循环的稳定性有所提高[15]。
光照:蛋白质的芳香族残基(以色氨酸残基为主)对光照非常敏感,易发生光氧化形成氧化自由基,随后发生断裂和交联,尤其是紫外光相较于白光影响更大[16]。有研究证实光照对蛋白质二级和三级结构的影响取决于其存在形式,通常冻干粉比液体制剂更能耐受光照。LUIS等[17]通过采用ICH Q1B(International Council for Harmonisation,ICH Q1B conditions)推荐值(132万勒克斯小时)和环境光照强度(24万勒克斯小时)评估了两种单克隆抗体的光稳定性,结果显示出巨大的差异,表明单抗药物的光稳定性取决于总的曝光量而不是光强度。SHAH等[18]发现了在ICH光照条件下虽然总体上未观察到明显的抗体结构变化,但CH2结构域仍然存在降解。蛋白质药物主要的光暴露发生在储存运输和给静脉输液患者用药期间,因此在药品应用阶段规避这一因素的影响就显得尤为重要。
机械应力:在单抗药物生产使用过程中还会受到机械应力(如搅拌或剪切力)的影响。研究证实由于疏水性基团(主要是巯基)暴露,在该过程中形成了大量规格在1.5~80μm不等的聚集体,且聚集水平与气-液界面积呈指数关系[19]。药物制剂在通过输液管或注射器时会产生剪切力作用,已有研究报道了高浓度单抗溶液的剪切稀化现象(剪切力下黏度的降低),这可能与自身聚集的单抗分子解离有关,但目前尚不清楚过滤过程中的剪切力是否会引起其他改变[20]。
2.3、 存储方式因素
浓度:高浓度下的单抗制剂由于黏度增加,分子间相互作用增强也会促进聚集[21]。HAUPTMANN等[22]发现高浓度仅仅会增加制剂中小颗粒的数量,而分子量大的聚集物反而减少了;NICOUD等[23]则观察到聚集物随浓度增加而增加的现象。有研究指出,虽然降低抗体浓度可以使结合性较弱的聚集体解离,但若不同时改变抗体分子与辅料的比例,则会稀释药物制剂中的辅料(具有保护性的糖类、表面活性剂或精氨酸),影响了溶液本身的pH值和离子强度,导致抗体分子化学稳定性降低[24]。此外,蛋白质分子自身具备聚合倾向,是由分子间的电荷相互作用所主导,且受溶液的离子强度影响[25]。
包装:除对单抗药物固有属性及结构的优化外,也不能忽略在现有生产条件下包装存储方式的影响。蛋白质作为表面活性分子,有吸附到疏水界面的倾向从而导致产品损失、效力降低和潜在的剂量不足[26]。KUMRU等[27]的研究结果表明聚氯乙烯(PVC)材质的输液袋(Ⅳ-bags)相较于聚烯烃材质对1 mg/ml的IgG4溶液吸附效果更明显,且颗粒物和浑浊度明显增加,而在加入聚山梨酯20后两种输液袋中的颗粒数降低至接近阴性对照。
3、 影响抗体不稳定性的机制
造成抗体不稳定性的因素大致划分为化学不稳定性因素和物理不稳定性因素。它们各自对抗体性质产生影响,且彼此相互作用:相关化学反应可导致物理不稳定性[13],物理不稳定性又可使某些活跃的化学基团产生变化,或将有可能相互作用的基团间距离拉近[28]。
3.1、 化学不稳定性的作用机制
氧化作用:化学降解不仅不利于抗体药物的储存,在应用中还会使药物有效性发生损耗。氧化反应(包括二硫键的形成)是最常见的引起化学降解的因素,这种氧化可以发生于氧化剂(例如:光照、过氧化物或者活泼金属)存在的情况下,也可以自发氧化的形式产生[29]。抗体分子中相当一部分氨基酸基团易被氧化,例如甲硫氨酸、组氨酸和半胱氨酸[29,30]。二硫键的形成即发生在两个半胱氨酸的巯基之间,且类似的氧化不仅可发生在单个分子内部,也可在分子间产生。
脱酰胺作用:另一个引起降解的因素便是脱酰胺化,涉及含天冬酰胺(Asn)和谷氨酰胺(Gln)残基的位点。脱酰胺化类似于酸碱反应,是在临近反应位点的质子供体(通常为丝氨酸或者苏氨酸)参与下形成环酰亚胺中间物,从而破坏抗体本身的结构[31]。例如Asn经脱酰胺化往往生成琥珀酰亚胺,之后很快自发水解为天冬氨酸或异天冬氨酸(Asp)。
水解作用:在抗体分子中另一大化学性质不稳定因素便是二硫键或肽键的断裂[29]。其中在单抗药物正常使用过程中“单价抗体”的形成就是由二硫键断裂导致[29]。而肽键断裂则形成大量性质和大小不一的小分子量片段,且尚不能确定该现象是由酶解导致。同样的,抗体分子中铰链区的水解机制亦不明确,例如在研究木瓜蛋白酶对单抗裂解的过程中加入蛋白酶抑制剂并不能改变抗体分子的断裂,因此推测可能是由某种非酶解机制导致的该现象。尽管具体机制尚不明确,但抗体分子这一降解途径通常发生在强酸或者高温环境中[30]。
辅料作用:除了上述可能由环境影响发生的降解外,糖类作为常用的辅料亦会对抗体分子产生影响。研究发现蛋白质在还原糖作用下可发生糖基化(glycosylation),最终形成酮胺而导致褐变,且从抗体在胞内克隆直至静脉注射,该反应都有可能发生[31,32]。虽然现在大多厂商以非还原糖作为辅料,但其依然可以降解为还原糖从而影响单抗药物结构和功能[32]。
化学修饰对于单抗药物性质的影响程度取决于其修饰位点[33]。例如,脱酰胺化在Fc段发生所造成的影响很小,但若发生在CDR上则会降低单抗的亲和力及效价;同样的,氧化反应若是发生在Fc段则不仅会降低结合亲和力,更会增加单抗在人体内的清除率从而降低血药浓度[34]。一些研究表明,化学不稳定性还会导致蛋白构象的改变和分子聚集,例如甲硫氨酸氧化易引起二级结构稳定性改变。
3.2 、物理不稳定性相关机制
蛋白质变性往往意味着高级结构的展开,上述化学不稳定性改变、环境因素(温度及pH)等都有可能导致这一结果,并随之降低抗体铰链区的活动性,增加聚集性[29]。聚集性增加是最主要的物理不稳定性改变,聚集体由多个蛋白质分子通过非共价键(范德华力、氢键、疏水和静电相互作用)相链接,而不涉及一级结构和蛋白序列的变化。此外还有部分聚集体是通过二硫键等共价键相缔合,称为共价聚集[13]。这两种聚集最终都有可能形成可溶性或不可溶性聚集物。
抗体的聚集大多都是不可逆的,尤其是在后期当形成的聚集物是由大量非天然结构的抗体分子组成的时候[35]。有学者提出了抗体聚集物有可能通过两种途径使正在接受单抗类药物治疗的患者产生免疫原性:T细胞依赖途径以及细胞因子激活途径。而且分子量越大的聚集物其免疫原性越强,且糖基化程度、聚集产物来源等亦对其有影响[2,36,37]。最终,免疫原性反应不仅大幅降低了药物的体内疗效,而且易引发Ⅰ型超敏反应。当然,上述现象仅在体外实验及动物模型中观察到,并预测了聚集物在人体内的风险效应,其具体的机制仍然有待探究[38]。
4 、抗体稳定性评估方法
生物技术产品稳定性评估通常包括生物活性分析、分子结构和纯度分析(含降解产物的定量检测)以及相关参数的监测(如外观、pH值等),综合以上数据来对样品的热稳定性、聚集性和分子间作用力大小做出评估。在对抗体效价和稳定性进行评估的方法中,除了最常用的间接ELISA法外,还常应用差示扫描量热仪(DSC)测量蛋白质热稳定性,其不仅可以得到熔化温度,还可以得到与熔化有关的焓、熵和自由能[39]。进一步发展而来的差示扫描荧光法(DSF)、圆二色(CD)光谱法、动态光散射(DLS)检测技术都朝着高通量、高精度或者对蛋白质水动力学监测等方向改进[40]。此外在蛋白质溶解性预测方面,研究者们相继提出了交叉作用色谱法(CIC)、亲和捕获自身相互作用-纳米粒子光谱法(AC-SINS)或克隆自身相互作用-生物层干涉法(CSI-BLI)等技术,取得了一定的进展,这些方法评估单克隆抗体在低蛋白浓度下的交叉或自身相互作用的可能性,从而预测单克隆抗体在高浓度下的特性。随着计算机辅助设计在生物大分子开发中的应用,对不确定晶体结构的分子,可以利用大量的建模和仿真软件来预测抗体-抗原复合物的三维结构;也可使用不同的力场进行分子动力学(molec?ular dynamics,MD)模拟[41],获得更多有关结合相互作用、稳定性的详细信息,并使非共价键能(疏水能、静电能、非极性能和结合能)的计算变得更容易。
5 、稳定性改造方案
5.1 、抗体分子结构改造
基于抗体分子易受化学修饰位点进行结构改造,一直以来是其稳定性优化的重要方向。其中抗体CDR区的去酰胺作用可能导致对抗原结合功能丧失,已有研究逐步阐明去酰胺化和化学修饰的机制以及它们的影响。且有研究证实Gln的脱酰胺速率比Asn慢得多,因此,通过将Asn突变为Gln来移除脱酰胺位点或者降低脱酰胺效应的发生概率被视为一种解决方案[42]。研究还发现在一级序列中紧跟在Asn后面的氨基酸类型被认为是脱酰胺倾向的重要决定因素,若采用侧链较大的氨基酸(通常为缬氨酸和异亮氨酸)替代能够使得Asn对脱酰胺作用的抵抗力更强[42]。本课题组前期工作中利用计算机分子模建系统发现HER2抗体赫赛汀(Herceptin)LC-Asn30和HC-Asp102两个脱酰胺和异构化的降解热点,经同性突变为LC-Gln30和HC-Glu102后,抗体稳定性得到明显提高且原有生物学活性没有发生改变[43]。
此外,抗体特定位点的糖基化修饰,决定其不同效应配体的功能,同时糖基化可以增强单克隆抗体药物的稳定性和溶解性,并能降低单克隆抗体药物的聚集趋势[44]。HIGEL等[44]使用多变量数据分析评估了单克隆抗体糖基化与培养液中氨基酸种类及数量的关系,为今后在细胞培养过程中进行控制糖型的研究提供了新思路。THARMALINGAM等[45]通过一种新型的实时糖基化监测仪器(微量顺序注射系统与超高效液相色谱相结合)研究Mn2+浓度对抗体糖基化的影响,实现了通过调节培养基中Mn2+浓度来控制产物糖型结构,为糖基化研究提供了新方法。SHA等[46]基于生产工艺的改进,通过代谢分析和数学模型相结合的方法进一步控制了重组蛋白的糖基化程度,实现了对产物效应功能的优化。
5.2、 生产工艺优化
有研究指出,过酸或过碱条件下抗体都会发生不同途径的降解[47]。在pH6.8静脉注射用免疫球蛋白(IGIV)制剂中,这种由pH导致的不稳定性通过加入麦芽糖稳定剂可以得到改善;而在以CHO细胞系为表达系统的体系中,HOGIRI等[48]建立以活细胞数、凋亡细胞数、死细胞数、产物量(mAb),培养体积和pH值等6大参数为主体的pH依赖性动力学模型,用数值优化方法来估计整个细胞培养时间内的pH值变化规律,进而在生产阶段制定出有效的pH优化策略。
表面活性剂通常被添加到单抗药物配方中,以减少疏水区的暴露,或者通过竞争吸附位点从而减少蛋白质相互作用和界面诱导的聚集,其中常用的非离子表面活性剂有聚山梨酯20和聚山梨酯80[49]。此外,某些氨基酸也常被作为赋形剂用以保护聚集,常用的精氨酸(Arg)能够增加蛋白质的溶解度,并能保护其免受光照和高温诱导的聚集。TOTH等[50]证实了(Arg)氢氯化物能够提升热稳定性,同时减少搅拌诱导的聚集。脯氨酸(Pro)作为一种环状氨基酸,被认为通过与芳香残基和暴露的疏水区结合而增强mAb的溶解,从而降低蛋白质-蛋白质的相互作用和溶液黏度,减少其pH值在pI附近时的聚集[51]。
而通过对抗体药物成品在储存或包装方式上的改进往往更具经济性。SREEDHARA等[52]研究表明,去除输液袋的顶部空隙可以减少搅拌诱导的聚集体形成;此外容器对药物溶液中的辅料(缓冲液、表面活性剂、防腐剂、其他稳定剂等)的吸附也会导致它们浓度的降低从而不再满足单抗药物稳定性的要求。迄今为止防止蛋白质与容器表面相互作用的方法是对表面进行涂层,即表面钝化。涂层大致可分为两类:单层涂层(较常用)和多层涂层(不太可控),较常用的涂层聚合物包括乙二醇或环氧乙烷[53]。此外,若使用带极性或中性电荷的聚合物涂层也能够减少蛋白质的吸附[54]
6 、结语
治疗性单克隆抗体药物是当下生物医药领域的研发热点,且以此为基础开发出的单链抗体(scFv)、单域抗体、抗体-药物偶联物(ADC)等应用于各器官系统疾病的药物也相继获批上市。如何在不改变药物靶向性、兼顾疗效和免疫原性的同时提高药物自身稳定性,尽可能延长药物半衰期,保持有效的血药浓度是当下亟待解决的问题。抗体稳定性受到环境、配方、自身结构及生产操作等多种因素影响,而对抗体稳定性的有效评估是进行个体化改造的前提。稳定性评估不应仅仅根据有无降解产物或稳定性分子的浓度来定义,而应该包含以下3方面:物理稳定性研究的评估应该涵盖聚集体和碎片数目以及单抗结构;化学稳定性研究应关注蛋白降解情况;生物稳定性研究应保证单克隆抗体对靶点的活性与其物理化学稳定性保持一致。深入探讨抗体稳定性影响因素及评估方法,有助于抗体药物的合理优化以及新药的研发。
参考文献
[1] MANNING M C. ,CHOU D K,MURPHY B M,et al. Stability of protein pharmaceuticals:An update[J]. Pharm Res ,2010.27(4):544-575. DOI:10. 1007/s11095- 0090045-6.
[2] UCHIYAMA S. Liquid formulation for antibody drugs[J]. Biochim Biophys Acta,2014, 1844(11):2041-2052. DOI:10. 1016/j. bbapap. 2014. 07. 016.
[3] WADA R,MATSUI M.KAWASAKI N. Infuence of N-glycosylation on effector functions and thermal stability of glycoengineered lgG1 monoclonal antibody with homogeneous glycoforms[J]. MAbs,2019.11(2):350-372. DOI:10. 1080/19420862 .2018. 1551044.
[4] GRAWE R W,KNOTTS T AT. The effects of tether placement on antibody stability on surfaces[]. J Chem Phys,2017,146(21):215102. DOI:10. 1063/1. 4983705.
[5] WUS J,LUO J,O'NEIL K T,et al. Structure- based engineering of a monoclonal antibody for improved solubiliy[J. Protein Eng Des Sel,2010 .23(8)643-651. DOl:10. 1093/protein/gzq037.
[6]闵娅君,肖云菊。肖江明,等通过矿化提高蛋白疫苗稳定性的研究[J]中国免疫学杂志, 2020,36(13):1545-1557. DOl:10. 3969/j. issn. 1000-484X. 2020.13. 002.
[7] FUKUDA J,IWURA T,YANAGIHARA S,et al. Factors to govern soluble and insoluble aggregate- formation in monoclonal antibodies[J]. Anal Sci,2015,31(12):1233-1240. DOl:10.2116/analsci. 31.1233.
[8] PISUPATI K,BENET A.TIAN Y,et al. Biosimilarity under stress:A forced degradation study of Remicade@and Remsima“"[J]. MAbs .2017,9(7):1197-1209. D0l:10. 1080/19420862.2017. 1347741.
[9] SKAMRIS T,TIAN X.THOROLFSSON M.et al. Monoclonal Antibodies fllw distinct aggregation pathways during productionrelevant acidic incubation and neutralization[J]. Pharm Res,2016,33(3):716-728. DOI:10. 1007/s11095-015-1821-0.
[10] WEN J,BATABYAL D,KNUTSON N,et al. A Comparison between emerging and current biophysical methods for the assessment of higher-order structure of biopharmaceuticals[J]. J Pharm Sci,2020,109(1):247-253. DOl:10. 1016/j. xphs .2019.10. 026.
[11] KERR R A,KEIRE D A,YE H. The impact of standard accelerated stability conditions on antibody higher order structure as assessed by mass spectrometry[J]. MAbs,2019,11(5):930-941. DOl:10. 1080/19420862. 2019.1599632.
[12] KHODABANDEHLOO A.CHEN D D. Particle sizing methods for the detection of protein aggregates in biopharmaceuticals[J] Bioanalysis,2017,9(3):313-326. DOl:10. 4155/bio-2016-0269.
[13] MAHLER H C,FRIESS W,GRAUSCHOPF U,et al. Protein aggregation:Pathways,induction factors and analysis[J]. J Pharm Sci,2009,98(9):2909-2934. DOl:10. 1002/ips. 2156
[14] FALCONER R J. Advances in liquid formulations of parenteral therapeutic proteins[J] Biotechnol Adv,2019,37():107412.D0l:10. 1016/j. biotechadv. 2019. 06. 011.
[15] HAGEMAN T,WEI H,KUEHNE P,et al. Impact of tryptophan oxidation in complementarity-determining regions of two monoclonal antibodies on structure function characterized by hydrogen-deuterium exchange mass spectrometry and surface plasmon resonance[J]. Pharm Res,2018,36(1):24. DOl:10. 1007/s11095-018-2545-8.
[16] LEI M,QUAN C,WANG Y J,et al. Light-induced covalent buffer adducts to hitidine in a model protein[J]. Pharm Res .2018,35(3):67. DOl:10. 1007/s11095-017-2339-4.
[17] LUIS L M.HU Y,ZAMIRI C.et al. Determination of the acceptable ambient light exposure during drug product manufacturing for long-term stability of monoclonal antibodies[J].PDAJ Pharm Sci Technol,2018,72(4):393-403. DOl:10. 573 1/pdajpst.2018. 008581.
[18] SHAH D D.ZHANG J,MAITY H,et al. Effect of photo-degradation on the structure stabilityaggregation,and function of an lgG1 monoclonal antibody[J]. Int J Pharm,2018.547(1-2):438-449. DOl:10. 1016/j. ipharm. 2018. 06. 007.
[19] DOBSON J,KUMAR A,WILLS L F,et al. Inducing protein aggregation by extensional flow[J]. Proc Natl Acad Sci U S A,2017.114(18):4673-4678. DOl:10. 1073/pnas. 1702724114.
[20] ALLMENDINGER A,MUELLER R,HUWYLER J,et al. Sterile flration of highly concentrated protein formulations:lmpact of protein concentration,formulation composition,and filter material[J]. J Pharm Sci,2015,104(10);3319-3329. DOl:10.1002/jps. 24561.
[21] SCHERMEYER M T.WOLL A K,KOKKE B,et al. Characterization of highly concentrated antibody solution-A tolbox for the description of protein long-term solution stability[J].MAbs,2017,9(7):1169-1185. DOI:10. 1080/19420862. 2017. 1338222.
[2] HAUPTMANN A,PODGORSEK K,KUZMAN D,et al. Impact of buffer, protein concentration and sucrose additin on the aggregation and particle formation during freezing andthawing[J]. Pharm Res,2018,35(5):101. DOl:10. 1007/s11095-018-2378-5.
[23] NICOUD L,JAGIELSKI J,PFISTER D,et al. Kinetics of monoclonal antibody aggregation from dilute toward concentrated conditions[J]. J Phys Chem B,2016, 120(13):3267-3280.D0l:10. 1021/acs. jpcb. 5b11791.
[24] BL AFFERT J,HAERI H H,BLECH M,et al. Spectroscopic methods for assessing the molecular origins of macroscopic solution properties of highly concentrated liquid proteinsolutions[J]. Anal Biochem,2018,561-562:70-88. DOl:10. 1016/j.ab. 2018. 09.013.
[25] KALONIA C,TOPRANI V,TOTH R,et al. Effects of protein conformation, apparent solubility, and protein-protein interactions on the rates and mechanisms of aggregation for anIgG1monoclonal Antibody[J]. J Phys Chem B,2016, 120(29):7062-7075. DOl:10. 1021/acs. jpcb. 6b03878.
[26] RICCI M S,FRAZIER M,MOORE J,et al. In-use physicochemical and microbiological stability of biological parenteral products[J]. Am J Health Syst Pharm,2015,72(5):396-407.DOl:10. 2146/ajhp140098.
[27] KUMRU 0 S,LIU J,J1 J A.et al. Compatibility physical stability, and characterization of an lgG4 monoclonal antibody after dilutin into diferent intravenous administration bags[J]. J Pharm Sci,2012, 101(10):3636-3650. DOl:10. 1002/ps 23224.
[28] KANT RVAN D E R,KAROW-ZWICK A R,DURME J V A N,et al. Prediction and reduction of the aggregation of monoclonal antibodies[J]. J Mol Biol,2017,429(8):1244-1261. D0l:10. 1016/j. jmb. 2017. 03. 014.
[29] FINKLER C,KRUMMEN L. Introduction to the application of QbD principles for the development of monoclonal antibodies[J]. Biologicals. 2016.44(5)-:282-290. DOl:10. 1016/j.biologicals. 2016.07. 004.
[30] MEL SHEIMER R,CAL MANN M,DERITIS A.et al. Ensuring product quality, consistency and patient supply over time for a large-volume biologic Experience with remicadel(R))[J]. BioDrugs ,2018,32(5):405 414. DOI:10. 1007/s40259-018-0300-7.
[31] TOKHADZE N,CHENNELL P,LE BASLE Y,et al. Stability of infliximab solutions in different temperature and dilution conditions[J]. J Pharm Biomed Anal,2018, 150:386-395. D0l:10. 1016/j. jpba. 2017.12. 012.
[32] LEBL ANC Y,BIHOREAU N,JUBE M,et al. Glycation of polyclonal lgGs: Effect of sugar excipients during stability studies[J]. Eur J Pharm Biopharm,2016, 102: 185-190. DOl:10.1016/j. ejpb. 2016. 03. 016.
[33] DU Y,WALSH A. EHRICK R,et al. Chromatographic analysis of the acidic and basic species of recombinant monoclonal antibodies[J]. MAbs,2012,4(5):578-585. DOl:10. 4161/mabs.21328.
[34] YANG R,JAIN T,LYNAUGH H,et al. Rapid assessment of oxidation via middle- down LCMS correlates with methionine side-chain solvent-accessible surface area for 121 clinical stage monoclonal antibodies[J]. MAbs,2017,9(4):646-653. DOl:10. 1080/19420862. 2017. 1290753.
[35] SVILENOV H.WINTER G. The ReFOLD assay for protein formulation studies and prediction of protein aggregation during long-term storage[J]. Eur J Pharm Biopharm,2019,137:131-139. DOl:10. 1016/j. ejpb. 2019. 02. 018.
[36] PANTUSO E,MASTROPIETRO T F,BRIUGLIA M L,et al.On the aggregation and nucleation mechanism of the monoclonal antibody anti-CD20 near liquid-liquid phase separation(LLPS)[J]. Sci Rep,2020,10(1):8902. DOl:10. 1038/s41598-020-65776-6.
[37] KURIAKOSE A.CHIRMULE N,NAIR P. Immunogenicity of biotherapeutics :Causes and association with posttranslational modifications[J]. J Immunol Res,2016,2016: 1298473.DOl:10. 1155/2016/1298473.
[38] KRAUS T,WINTER G.ENGERT J. Test models for the evaluation of immunogenicity of protein aggregates[J]. Int J Pharm,2019,559:192-200. DOl:10. 1016/j. ipharm. 2019.01.015.
[39]邵敏,王新颖,卢毓璁,等抗人蔗糖酶卵黄抗体的制备及其稳定性和体外活性研究[J]中国免疫学杂志, 2016,32(12):1785-1789. DOl:10. 3969. j issn. 1000-484X. 2016. 12. 013.
[40] LIU W W,ZHU Y,FANG Q. Femtomole. scale high-throughput screening of protein ligands with droplet-based thermal shift assay[J]. Anal Chem,2017,89(12):6678-6685. DOl:10.1021/acs. analchem. 7b00899.
[41] SALMASO V,MORO S. Bridging molecular docking to molecular dynamics in exploring ligand-protein recognition process:An overview[J]. Front Pharmacol,2018,9:923. DOl:10.3389/fphar. 2018.00923.
[42] VERMAA,BURNS D L. Improving the stability of recombinant anthrax protective antigen vaccine[J]. Vaccine ,2018,36(43):6379-6382. DOl:10. 1016/j. vaccine. 2018. 09. 012.
[43] YANG Y,ZHAO J,GENG S,et al. Improving trastuzumab's stability profile by removing the two degradation hotspots([J. J Pharm Sci,2015. 104(6):1960-1970. DOl:10. 1002/jps.24435.
[44] HIGEL F,SEIDL A.SORGEL F,et al. N-glycosylation heterogeneity and the infuence on structure ,function and pharmacokinetics of monoclonal antibodies and Fc fusion proteins[J]. Eur J Pharm Biopharm,2016. 100:94-100. DOI:10. 1016/j. ejpb. 2016.01. 005.
[45] THARMALINGAM T,WU C H.CALLAHAN S,et al. A framework for real-time glycosylation monitoring(RT-GMjin mammalian cell culture[J]. Biotechnol Bioeng,2015, 12(6)1146-1154. DOI:10. 1002/bit. 25520.
[46] SHA S,AGARABI C,BRORSON K,et al. N-glycosylation design and control of therapeutic monoclonal antibodies[J]. Trends Biotechnol,2016,34(10):835-846. DOl:10. 1016/j. tibtech.2016. 02.013.
[47] ZHENG S,QIU D,ADAMS M.et al. Investigating the degradation behaviors of a therapeutic monoclonal antibody associated with pH and buffer species[J]. AAPS Pharm Sci Tech,2017,18(1):42-48. DOl:10. 1208/s12249-015-0403-0.
[48] HOGIRI T,TAMASHIMA H,NISHIZAWA A,et al. Optimization of a pH-shift control strategy for producing monoclonal antibodies in Chinese hamster ovary cell cultures using apH-dependent dynamic model[J]. J Biosci Bioeng,2018, 125(2):245-250. DOl:10. 1016/j. jbiosc. 2017. 08. 015.
[49] AGARKHED M,O'DELL C,HSIEH M C,et al. Effect of surfactants on mechanical,thermal,and photostability of a monoclonal antibody[J]. AAPS Pharm Sci Tech,2018,19(1):.79-92. DOl:10. 1208/s12249-017-0845-7.
[50] TOTHR T T,PACE S E,MILLS B J,et al. Evaluation of hydrogen exchange mass spectrometry as a stabilty-indicating method for formulation excipient screening for an lgG4monoclonal antibody[J]. J Pharm Sci,2018,107(4):1009-1019. DOl:10. 1016/j. xphs. 2017. 12. 009.
[51] HUNG J J,DEAR B J,DININ A K,et al. Improving viscosity and stability of a highly concentrated monoclonal antibody solution with concentrated proline[J]. Pharm Res,2018,35(7):133. DOI:10. 1007/s11095-018-2398-1.
[52] SREEDHARA A,GLOVER Z K,PIROS N,et al. Stability of lgG1 monoclonal antibodies in intravenous infusion bags under clinical in-use conditions[J]. J Pharm Sci,2012, 101(1):21-30. DOl:10. 1002/jps. 22739.
[53] WANG Q,JIN H,XIA D,et al. Biomimetic polymer-based method for selective capture of C-reactive protein in biological fluids[J]. ACS Appl Mater Interfaces,2018, 10(49):41999-42008. DOl:10. 1021/acsami. 8b15581.
[54] GIAMBLANCO N,MARLETTA G,GRAILLOT A,et al. Serum protein-resistant behavior of multisite -bound Poly(ethylene glycol)chains on iron oxide surfaces[J]. ACS Omega,2017,2(4):1309-1320. DOl:10. 1021/acsomega. 7b00007.





