制药设备论文第三篇:工程设备对药品技术转移的影响性评估
摘要:当前制药行业环境中,很多情况下均会涉及药品技术转移活动,如新药开发到商业化生产的良好过渡,企业建造新生产基地,集团并购、CRO/CMO/CDMO外包活动等。药品技术转移涉及了工艺、分析方法、文件、物料、工程和设备等关键要素,将针对药品技术转移过程中工程和设备方面需要考虑的项目进行分析说明。
关键词:药品技术转移; 厂房设施; 公用工程; 工艺设备; 药品生命周期;
Several Issues in Engineering and Equipment for Drug Technology Transfer Process
Jia Xiaoyan Ke Zhengxian
Austar Pharmaceutical Equipment (Shijiazhuang) Co.Ltd
Abstract:In current pharmaceutical industry, drug technology transfer will be involved in many cases, such as the transition from new drug development to commercial production, construction of new production bases, group mergers & acquisitions, and CRO/CMO/CDMO outsourcing activities. The drug technology transfer involves key elements such as processes, analytical methods, documents, materials, engineering and equipment. In this paper, the items to be considered as respect to engineering and equipment in the process of drug technology transfer were analyzed and explained.
近年来,随着制药行业技术的发展、监管法规趋严等形势背景,药品技术转移逐渐成为关注重点。WHO技术报告系列,No.961,附件7《制药产品生产的技术转移指南》中将技术转移定义为:控制研发方和生产方,或两个生产场所之间所有工艺及其文件和专业技术转移的逻辑程序[1],并将两方定义为转出方(SU)和接收方(RU)。ICH Q10《制药质量体系》中将药品技术转移分为:从研发到生产,或是从一个生产场地到另一生产场地两种情况[2]。
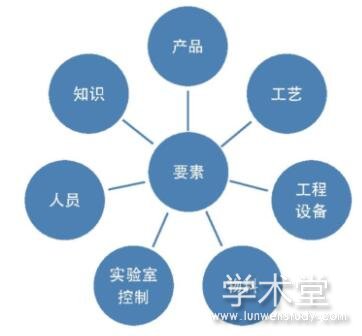
无论哪种形式的药品技术转移项目,转出方和接收方都希望缩短投放市场的时间、最大程度降低成本、有效的知识管理和共享,总之是希望“一次就把事情做对”。但是由于转出方和接收方可能位于不同的区域,如某些制药企业研发中心在总部进行集中管理,生产基地分布在全国乃至全球各地;委托研发和生产组织(CRO/CMO)的应用模式多样化;涉及的法规监管背景不同,如FDA cGMP、EU GMP或是中国GMP等;技术能力不同,如自动化程度、产品生产经验成熟度等诸多情况存在,导致药品技术转移是一个影响因素多而复杂的过程[3]。在药品技术转移之前应考虑所有相关因素,如图1所示。
在图1展示的要素中,工程和设备涉及到投资成本、建设周期等转出方和接收方都关注的问题。另外,双方还需要考虑所有监测或控制产品关键质量属性(CQA)和关键工艺参数(CPP)的关键工程和设备,例如和产品直接接触的工艺设备;提供洁净生产环境的厂房设施、HVAC系统;提供制药用水和工艺气体的洁净公用工程等均会给转入的药品质量产生重要的影响,因此工程和设备是药品技术转移过程中需要考虑的一个关键方面。
图1 药品技术转移项目要素
药品技术转移项目执行过程中,工程和设备需求应基于转出方的工艺和接收方的未来产能放大进行综合考虑。结合对接收方进行的差距分析以识别新产品针对工程和工艺设备的特定需求,以使接收方的工程和设备能够与新产品的生产相适应,同时,接收方的工程和设备需要满足GMP要求,需要考虑新产品的生产量、批量(例如等同或放大)以及生产周期等要素。在药品技术转移之前对工程设备的影响性进行评估和考虑,为药品能在接收方成功重现提供保证。
1 厂房设施的考虑
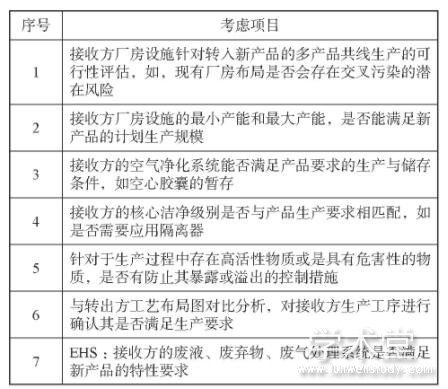
在执行药品技术转移活动之前,针对新产品的特点在接收方进行厂房设施方面的考虑,如表1所示。
表1 厂房设施的考虑方面
2 洁净公用工程的考虑
与新产品生产情况以及产品工艺的要求对洁净公用工程系统,如制药用水系统、工艺气体系统等的设计、能力、适用性等方面进行比较分析,可以从以下方面进行考虑,如表2所示。
表2 洁净公用工程的考虑方面
3 工艺设备的考虑
将接收方与转出方研发设备或生产设备的原理、能力及工序对应设备要求,如:尺寸、形状、材质等进行比较,根据比较结果以及预期用途,对接收方用于生产新产品的设备性能提出用户需求说明或进行对比分析。在工艺设备方面,接收方通常希望与转出方设备“等同”[3],实际情况是这种希望在转出方和接收方之间并不能完全实现。转出方和接收方之间的工艺设备一般存在如下三种情况:
3.1 作为项目的一部分,转出方转移工艺和设备
这种情况可能发生在一个集团向不同的子公司生产现场转移产品,这些不同生产现场的设备由集团指定一家供应商进行集中采购,并且和集团生产该产品使用的设备“等同”。在这种情况下,与转移产品和工艺相关设备的使用和操作知识是知识转移的重点。
在工艺设备转移成为药品技术转移一部分的情况下,特别强调设备知识信息成为技术转移成功的关键因素,项目团队要注意分享工艺设备操作方面的经验。技术转移过程中对工艺设备方面的了解不足,可能导致分配给调试和确认活动的时间不足,从而出现商业化生产的延迟或日常生产期间出现不良品或是偏差。
3.2 转出方和接收方使用相同或类似的设备(新设备或现有设备),但分别位于两个现场
这种情况可能发生在异地新建项目或项目搬迁中,随着自动化信息化技术在新建项目的使用,将带来产品的关键质量属性(CQA)、关键工艺参数(CPP)控制监测、计算机化系统验证(CSV)、数据可靠性(DI)等多方面的影响。在这种情况下,需要考虑设备的操作经验、系统配置(如增加的自控系统、CIP清洗模块等)和不同的操作细节。
在旧生产车间中生产操作可能存在粗放的手动操作,工艺设备的计量精度不高,如手动加料200L,可能仅依靠罐上面的刻标粗略估计,但是当在新车间时,可能有精度控制的液位计或流量传感器,此时按旧生产的原有工艺“加料200 L”方式放到新系统可能得到的结果显示为精准的“242.2 L”,而“242.2 L”有可能不符合注册工艺的参数控制区间。当在新旧工艺进行技术转移时,自动化系统运行上线,这种矛盾会凸显:旧工艺是经过验证的,但是可能存在数据可靠性问题,而新生产车间采用计算机化系统控制下的生产工艺目前未经过验证,但理论上却能得到更精准的控制和监测。
在此阶段,技术转移项目组将根据现有工艺设备的实际情况,包含材质、运行或性能参数等与待转入产品工艺参数的要求进行逐一核对,确认现有工艺设备满足新产品的要求,如果满足要求则继续使用;如果不满足要求则改造、新购设备。
3.3 转出方和接收方使用相似但不完全相同的设备,接收方可能需要采购或操作设备来实现工艺
由研发向中试车间、商业化生产车间的过渡转移,此阶段关注的是工艺放大带来的对产品关键质量属性(CQA)、关键工艺参数(CPP)的影响。在这种情况下,重要的是产品和工艺能够在新车间的实现结果,而实现方法或过程(尤其是在操作上)可能有所不同。
例如,应用200 L的小反应器下搅拌桨叶的线速度不会剪切损伤细胞,但是当放大到1 200 L时则可能导致桨叶半径变大相同转速下,桨叶把细胞切碎的情形,甚至产生很多损伤细胞的副产物。基于产品、工艺、产能、批量、生产与维护费用等综合分析,放大的形式有可能采取“Scale out”(同等工艺规模下产能扩大),应用200 L×6台套,也可能采取“Scale up”(规模放大),应用1 200 L×1台套,甚至采取不锈钢反应器与一次性反应器系统相结合的“混合”方案。另外考虑,200 L规模更容易将温度稳定控制在±0.5℃范围,但是当达到1 200 L规模时则有可能不具备有效的控制能力。
4 自动化系统的考虑
技术转移的范围也许会包括使用工厂自动化和/或企业级别的某种信息技术(例如制造执行系统MES)。若存在这种情况应确定专门的IT工程资源和主题专家(SME),并将其用于规划复制或实施适当的自动化和/或网络基础设施,尤其是需要特别注意数据可靠性和网络安全方面的风险。
在药品技术转移过程中,转出方和接收方之间的自动化/网络基础设施或治理常常不同,因此,有必要在技术转移项目早期进行详细的规划和评估。此外,作为技术转移项目收尾的一部分,可能需要进行特定的IT工程评审,以确保所有风险都得到了解决。
5 结束语
基于项目特点,药品技术转移项目团队需要了解在整个技术转移过程中应该收集的工程和设备知识信息,遵循质量源于设计(QbD)的原则进行技术转移项目的整体规划,建立项目过程中需要收集工程和设备知识信息的制度和文件,并将此任务分配给不同的主题专家(SME)。必要时,在药品技术转移项目进程中的不同阶段,如:准备→计划→实施→关闭[4],对工程和设备知识信息收集情况进行阶段性评审,从而保证工程和设备信息的完整性,为实现成功的药品技术转移提供保障。
参考文献
[1] ICH Q10 Pharmaceutical Quality System[S].
[2] WHO Technical Report Series, No. 961, Annex 7 WHO guidelines on transfer of technology in pharmaceutical manufacturing[S].
[3] ISPE GPG Technology Transfer[S](Third Edition).
[4] PDA TR No. 65 Technology Transfer[S].
点击查看>>制药设备论文(精选范文8篇)其他文章