
茶叶生物化学是研究茶树生命化学的科学,在生物化学与分子水平探讨茶树生命的本质,研究茶树特别是茶树新梢中分子的结构与功能、物质代谢与调节,及其在生命活动中的作用;研究茶树新梢的化学分子在加工及贮藏过程中的转化规律以及对茶叶品质及茶叶健康功能的影响;茶叶生物化学是茶学发展的基础科学。茶叶生物化学的研究成果为茶树栽培和育种、茶叶加工及深加工、茶叶贸易和文化提供了坚实的理论依据。茶叶生物化学研究的不断深入为茶产业的发展提供了动力源泉。
作为叶用植物,茶树新梢是茶树代谢最为旺盛的部位之一,在次级代谢上有其独特性,具体表现在新梢含有极其丰富的儿茶素、咖啡碱和茶氨酸等特征性次级代谢产物上,因而它们在茶树体内的生物合成及其在制茶过程中的转化等机制研究是茶叶生物化学的核心问题。近年来,茶树功能基因、次级代谢关键酶及基因、茶叶代谢谱、茶叶功能成分与健康等的相关研究呈现爆发式增长。本文就近五年来茶叶生物化学研究主要的进展内容综述如下。
1 茶树次级代谢途径的研究
植物次级代谢是植物在进化中与环境相互作用的结果。与其他植物比,茶树次级代谢的特点是,富含儿茶素、咖啡碱和茶氨酸等特征性次级代谢产物。近年来,茶树次级代谢研究主要集中在这些特征性次级代谢产物儿茶素、咖啡碱和茶氨酸的代谢途径中的关键酶及相关基因的研究,已取得一些重大进展。
1.1 茶树中儿茶素代谢相关研究进展
儿茶素类物质(黄烷-3-醇)对茶叶品质和健康功效的贡献度极高,其代谢特别是合成代谢一直是茶树次级代谢研究的重中之重。儿茶素由莽草酸途径合成而来,近年来儿茶素 B 环5′羟基化途径和 C 环没食子酰基化途径已成为儿茶素类化合物合成代谢研究中的重点[1].2004 年,Punyasiri 等的研究表明,在茶树儿茶素合成途径中,EC 和 EGC 是由花白素经花青素合成酶(ANS)和花青素还原酶(ANR)的二步催化形成[2],而不是由儿茶素和没食子儿茶素直接表构而成,但儿茶素的没食子酰基化研究仍是空白。新近夏涛研究小组发现,酯型儿茶素合成以非酯型的 EC 和 EGC 为前体,涉及两步合成反应,即没食子酸首先在没食子酰基-1-O-β-D-葡萄糖基转移酶(UGGT)催化下,被活化形成 1-O-没食子酰-β-葡萄糖(βG),以此作为活化的酰基供体(1-O-Glc esters),再在 1-O-没食子酰基-β-D-葡萄糖-O-没食子酰基转移酶(ECGT)作用下,将没食子酰基转移到顺式非酯型儿茶素的 C 环 3 位上而形成酯型儿茶素 ECG 和 EGCG(图 1)[3].此外,该研究组还发现了高活力的酯型儿茶素水解酶(GCH),该酶可能属于单宁酶类,可水解酯型儿茶素为没食子酸和非酯型儿茶素。儿茶素还可进一步聚合形成原花青素(PAs),在茶树根和茎中大量积累,而叶片中含量很低[4].
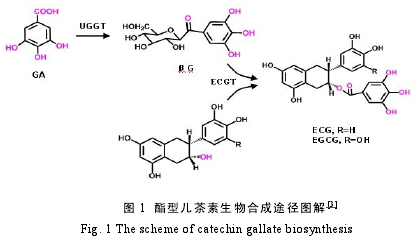
上述研究结果为茶树酯型儿茶素的合成与转化提供了较为清晰的途径。
儿茶素代谢途径受到多种转录因子的调控。安徽农业大学茶叶研究小组发现相关转录因子 MYB、WD40 和 bHLH 等参与了茶树中多酚类物质的代谢调控[5].此外,还对茶树发育相关和组织特异性相关的酚类物质积累模式、63 个酚类物质合成相关结构基因和转录因子基因表达模式进行了相关分析[6].
利用体外表达手段(原核与真核),对酚类物质合成关键酶基因 CAD(肉桂醇脱氢酶)、ANR1、ANR2、DFR1、DFR2、LCR1、F3H、F3′5′H、MYB5 功能进行了有效鉴定。Umar等[7]利用茶树 F3H、DFR 和 LCR 构建了大肠杆菌基因工程菌,以圣草酚(3′,4′,5,7-四羟基黄烷酮)为底物合成了 EC、ECG、(+)-C和 CG.
茶树中儿茶素的合成代谢还受到外界环境的影响。Rani 等对茶树儿茶素合成途径中的关键基因 F3H、DFR、ANS 和 ANR 的表达,以及干旱、脱落酸、赤霉素、伤害处理对其表达影响进行了研究分析[8].刘仲华研究组以白化茶树品种为研究对象,发现苯丙氨酸裂解酶(PAL)基因和黄酮醇合成酶(FLS)基因表达与儿茶素浓度呈负相关,而黄烷酮-3-羟化酶(F3H)基因表达呈正相关[9].夏涛等发现大田遮荫处理可使茶树酚类物质中的黄酮醇、原花青素合成显著下降;但儿茶素和木质素总量稍下降,而对 EGCG 含量影响最小[10].进一步发现黑暗培养的茶愈伤组织移至光下培养后,木质素、花青素、儿茶素的积累量明显增加。与黑暗处理相比,弱光处理后茶籽苗中非酯型儿茶素含量增加,酯型儿茶素积累却显著下降[11].
1.2 茶树中咖啡碱代谢相关研究进展
咖啡碱(1,3,7-三甲基黄嘌呤)代谢与腺嘌呤核苷酸代谢密切相关。茶树咖啡碱主要在幼嫩叶片和茶花中进行生物合成,合成部位可能在叶绿体。2000 年,Kato 等从茶树叶片中纯化出 咖 啡 碱 生 物 合 成 关 键 酶 咖 啡 碱 合 成 酶(3-NMT+7-NMT),并对该酶基因进行克隆和测序[12].植物体内咖啡碱生物合成的核心途径为:黄嘌呤核苷→7-甲基黄嘌呤核苷→7-甲基黄嘌呤→可可碱→咖啡碱,其中包括 3 步由N-甲基转移酶催化的转甲基化反应和 1 步由核糖核苷水解酶催化的脱核苷反应(图 2[13]);而咖啡碱的降解主要路径为咖啡碱→茶叶碱→3-甲基黄嘌呤→黄嘌呤→尿酸→尿囊素→尿囊酸→尿素→NH3+CO2[13].
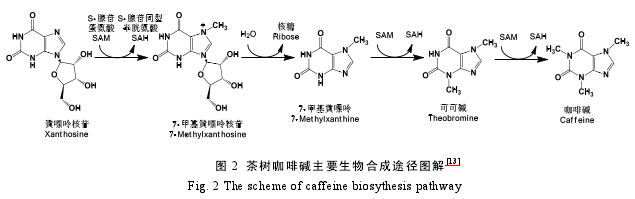
近年来相关研究主要集中在咖啡碱代谢途径中关键酶及其基因的的克隆、结构与功能的关系以及表达调控机制等。通过克隆源自咖啡的黄嘌呤核苷甲基转移酶基因(CaXMT1)和源自茶树的咖啡碱合成酶基因(TCS1)导入酵母中进行组合表达后,饲喂黄嘌呤核苷(XR)和 SAM,成功合成了咖啡碱[14].刘祥琦通过疑似 N-甲基核苷水解酶基因(STx)的克隆和大肠杆菌表达发现该酶具有催化 XR脱核糖反应的功能[15].金基强等从白叶一号茶树中,获得了 6 种 NMTs 的基因组 DNA 全长,发现了 3 种 TCS3、TCS4 和 TCS5 基因[16].魏艳丽从茶树中克隆出了 AMP 脱氨酶基因的cDNA 全长(GenBank:AGJ84350.1)[17].
由于一些特殊人群对咖啡碱敏感,低咖啡碱茶树品种的选育一直是科研工作者的目标之一。Mohanpuria 等采用 RNAi 技术培育出TCS 基因沉默的转基因茶树植株,咖啡碱和可可碱的含量与对照比分别下降了 44%~61%和46%~67% ;同时,还利用农杆菌侵染导入RNAi 片段,使得茶树幼苗新梢中咖啡碱和可可碱含量最高分别下降了 67%和 61%[18-19].
1.3 茶树中茶氨酸代谢相关研究进展
茶氨酸(N-乙基-γ-L-谷氨酰胺)系茶树特征性非蛋白质氨基酸,主要通过茶氨酸合成酶 TS 催化谷氨酸和乙胺合成茶氨酸,现已在Genebank 登录的 TS 基因有 3 条(DD410895,DD410896、JN226569)。尽管这些基因序列和植物中的谷氨酰胺合成酶(GS)序列高度同源,但通过大肠杆菌和拟南芥体外功能验证实验已先后证明其具有 GS所不具备的体外合成茶氨酸的能力[20].TS1 主要在根部和叶部高表达;TS2 在盛花期表达量最高;TS3 的表达量在单芽萌发阶段和主侧根中最高(结果未发表)。茶氨酸的合成具有明显的时空特异性,参与多个器官的氮素贮藏与转运,受到复杂的分子调控。
茶氨酸的合成还受到诸多生物和非生物因素的调控。盐胁迫、外源施加 ABA、NO 等激素信号分子也会促进茶树体内茶氨酸大量积累,说明茶氨酸与茶树抵御逆境胁迫息息相关,通过染色体步移技术克隆到 TS 基因的启动子区域,发现多个响应光调节、激素调节和逆境胁迫等的顺式作用元件,若对其进行深入研究与验证,将有助于解析茶树体内大量积累茶氨酸的生物学意义[21].
1.4 茶树萜烯类香气物质代谢研究进展
茶鲜叶中含有 30 余种糖苷态萜烯类香气物质,如芳樟醇及其氧化物和香叶醇等。这些挥发性萜类及其糖苷的含量和水解对成品茶的香气类型有重要影响。植物经 2-C-甲基-D-藓糖醇-4-磷酸(MEP)和甲羟戊酸(MVA)途径合成萜烯类物质。单萜和倍半萜合成酶是挥发性萜类化合物生物合成途径中的关键酶;糖基转移酶可能与茶鲜叶中糖苷态萜类香气化合物的合成和积累有关;而糖苷水解酶则催化糖苷态香气物质的水解,导致香气物质的释放[22].Yang 等[23]对茶树中的香气物质生物合成途径进行了系统总结,如图 3 所示。
茶树中萜烯类物质合成途径中的相关酶基因报道较少,而更多地侧重在糖苷水解酶相关基因的研究。陈亮等研究发现,8 个品种中茶树 β-葡萄糖苷酶基因表达量是 β-樱草糖苷酶的 2.4~45.6 倍,但 β-葡萄糖苷酶活性测定结果与基因表达量之间的相关性不明显[24].
1.5 茶树基因组研究进展
现代生物技术的迅猛发展为茶树次生代谢的研究提供了重要的技术手段和方法。虽然茶树次级代谢的分子生物学研究起步较晚,但目前仍是茶叶学科中最活跃和进展最快的一个领域。在此领域中业已分离和筛选出茶树特征性次级代谢物的相关功能基因,并对其功能进行了研究。
在茶树分子生物学研究中,AFLP、RAPD、RFLP 和 EST-SSR 等技术等已成功应用于茶树DNA 分子标记,构建了茶树次级代谢物差减杂交 cDNA 文库、龙井 43 新梢和幼根的 cDNA 文库和阿萨姆杂交种 TV-1 嫩梢的 cDNA 文库[25];并利用 cDNA 芯片技术获得了安吉白茶不同白化期的 671 个差异表达基因[26].Wu 等利用454 测序技术对茶树叶部的转录组进行了研究,获得了 25 637 个编码基因(unigene)和3 767 个 EST-SSRs 标记[27].李娜娜等利用Solexa 法对福鼎大白茶和小雪芽品种叶部的转录组进行了研究,获得了 79 797 个 unigenes和 6 439 个 SSRs 标记[28].
2009 年,安徽农业大学茶叶重点实验室启动茶树基因组研究计划,对 2 个栽培种和 1 个古茶树进行了 45 倍深度基因组测序,获得了基因和分子标记信息,为茶树基因组序测序方法和材料选择上提供了重要依据;同时进行了茶树全器官转录组与功能表达谱研究[29];以茶树带芽茎段为外植体建立了离体再生体系[30].这些研究结果为进一步揭示茶树优质、高产和抗逆的分子机理提供了重要的基础数据与平台。
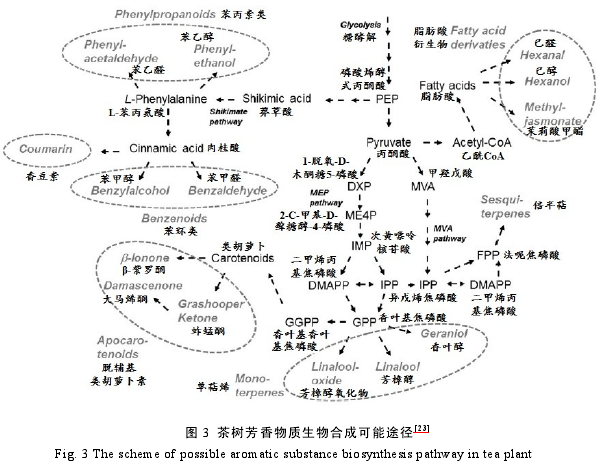
2 茶树次级代谢谱的研究进展
近年来,茶树次级代谢的研究还体现在特征性次级代谢物的代谢谱研究上,包括特异性种质资源代谢谱、茶叶加工过程代谢谱和环境以及农艺措施对茶树代谢谱影响等相关研究。
2.1 特异性种质资源代谢谱的研究
张凯等[31]在川渝地区 11 种野生大茶树中发现南川 1 号中 EGCG 含量大于 13%,南川 1号和 2 号中咖啡碱含量高于 5%和咖啡碱含量仅有 0.32%的黄山苦茶等特异性资源。谢吉林等[32]研究了滇西南茶区的 468 份晒青毛茶样品,发现咖啡碱含量春茶最高,夏秋茶依次下降,且咖啡碱的含量与游离氨基酸总量存在显著相关。贵州绿茶样品中儿茶素和咖啡碱含量分别在 9.14%~27.28%和 1.08%~3.33%之间[33].Kilel 等[34]发现,与中国的 Hanlu 种和日本的 Yabukita 种相比,肯尼亚 12 个紫芽叶品系绿茶中总多酚含量更高,10 个品系茶氨酸较高。
从紫色芽叶中还分离鉴定了 7 种花色素物质,其中锦葵素的含量最为丰富。在同一品种中,儿茶素含量和花青素含量存显著负相关[35].Wang 等[36]通过 119 份茶树种质资源研究发现,阿萨姆种中 β-胡萝卜素和叶黄素含量最高。
2.2 茶叶加工和贮藏过程中代谢谱的变化
王秀梅[37]研究发现,祁门红茶加工揉捻过程中醇类和醛类香气成分大幅增加,而酮类和烷烃类变化不明显;多糖类含量呈下降趋势,单糖含量略有增加;生物碱基本保持不变,干燥后氨基酸含量变化明显。陈红霞对普洱茶渥堆发酵过程进行检测发现,在渥堆发酵过程中,儿茶素类、黄酮醇类和茶氨1主体,酯型儿茶素和茶氨酸中无检出,缬氨酸含量持续增加;嘌呤碱中的咖啡碱和可可碱含量无显著改变,而黄嘌呤、次黄嘌呤、腺嘌呤、鸟嘌呤、甜菜碱等含量则不断增加。
此外,姜姝等和吕昌勇还分别对普洱茶不同发酵时期微生物群落的宏转录组和宏基因组学进行了研究。Ku 等[39]利用 LC-PDA-ESI/MS 技术比较了不同贮藏年限的 18种普洱生茶和 12种普洱熟茶中的代谢谱,发现木麻黄素、三没食子酰葡萄糖、绿原酸、EGC、ECG、EGCG 和茶没食子素在生茶中含量较高,而熟茶中 GA 含量较高;生茶中,随着贮藏年限的增加,EGCG、ECG、EGC、奎宁酸、绿原酸和木麻黄素显著降低,而 GA 显著增加;而不同贮藏年限的熟茶间主要化合物差异不明显。曹艳妮[40]
用SDE-GC-MS 比较了 10 种普洱生茶和熟茶的香气,发现生茶独有组分 13 种,而熟茶独有组分有 36 种;生茶以具有木香、花香的萜烯类和具有强烈新鲜香气的二氢猕猴桃内酯为主,而熟茶则以具有霉味和陈香的甲氧基苯类为主。
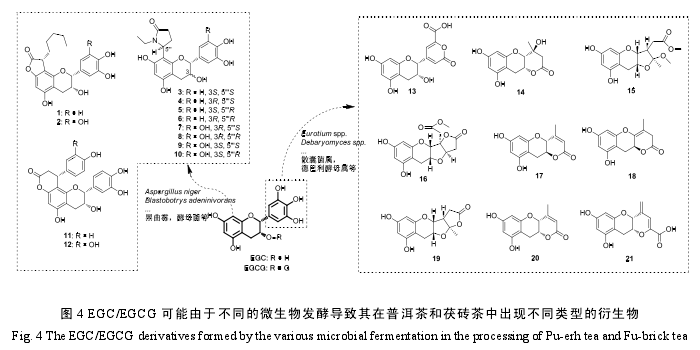
近年来,儿茶素物质在黑茶加工过程中的转化产物受到了特别关注。经渥堆发酵后的黑茶中出现了许多结构奇特的儿茶素类衍生物。
据报道,普洱茶中的这类衍生物包括普洱茶素A(1)和 B(2),普洱茶素 I-VIII(3-10)等新化合物,以及表儿茶素-[7,8-bc]-4α-(4-羟苯基)-二氢-2(3H)-吡喃酮(11)和 cinchonain lb(12)等[41-42].茯砖茶中发现的儿茶素衍生物则包括新化合物茯砖素 A-F(13-18),plancholA(19),文冠木素(20),teadenol A(21)等(图 4)[43-44].普洱茶中主要是儿茶素 A 环通过碳碳键连接新的基团,而茯砖茶中的衍生物则主要是儿茶素 B 环裂环后的产物。这很可能是源于两种黑茶中不同的微生物优势菌群。
2.3 农艺措施对茶树代谢谱的影响
杨亦扬等[45]利用1H-核磁共振(1H-NMR)的代谢组学非靶标分析与 HPLC 定量分析结合,研究了不同施氮水平对白天和夜晚茶树新梢代谢谱的差异,表明昼夜主要差异组分为茶氨酸、谷氨酸、葡萄糖、蔗糖、EC 和 GC;而不同施氮水平对天冬氨酸和儿茶素组分影响显著。
Yang 等[46]利 用 UPLC-TOF-MS 、CE-TOF-MS(毛细管电泳飞行质谱联用)、HPLC 和 GC-MS 等技术,对遮荫 3 周后的薮北种新梢进行化学分析后发现,挥发性脂肪酸衍生物(如:2-己醛、2-戊烯-1-醇、3-己烯醇乙酯、(Z)-3-己烯-1-醇、壬醛、壬醇和辛醇)和苯丙素类/苯环型挥发物(VPBs,如苯甲醛、水杨酸甲酯、苯甲醇、2-苯乙醇)等显著提高;而(S)-芳樟醇、顺式或反式芳樟醇氧化物(呋喃型和吡喃型)、橙花醇、香叶醇、α-萜品醇和橙花叔醇等萜烯类香气组分和糖苷类香气前体变化不显著;进一步研究发现,遮荫处理后 VPBs 合成的上游前导物如莽草酸、预苯酸和苯丙酮酸含量显著降低,但 VPBs 合成另一前导物氨基酸中的绝大多数氨基酸(含 L-苯丙氨酸)的含量则显著增加;生物碱中的咖啡碱含量增加,而可可碱含量降低;遮荫处理除琥珀酸和 GABA 略有降低外,对 TCA 循环其他代谢物无明显影响;儿茶素含量显著下降。
3 茶叶品质化学研究进展
近年来,随着茶叶分析技术的快速发展,茶叶品质化学的研究得到进一步加强。
3.1 儿茶素氧化缩聚产物的研究
茶鲜叶中儿茶素在红茶和黑茶的加工过程中发生了剧烈的氧化聚合和缩合反应,产生了茶黄素、茶红素和茶褐素等氧化产物。Sang等[47]综述了茶叶成分化学及其生化转化,儿茶素不仅可发生 2 聚合反应生成茶黄素,而且茶黄素还可进一步与儿茶素反应,形成具有 2个或 3 个苯骈卓酚酮结构的化合物,如图 5.
这些结果表明茶黄素类可进一步参与茶红素的形成。据报道,茶红素主要由分子量在 2 100 Da以下的化合物聚合而成,这些化合物主要由儿茶素及其没食子酸酯、酚酸和茶黄素等组成,并且可能是多羟基化的寡聚体[48].
3.2 茶叶苦涩味研究
我国生产的大部分夏季绿茶滋味较春茶偏苦涩。2005年德国学者 Scharbert和 Hofmann通过对红茶内含成分的分离和测定,结合感官分析,确定了引起红茶中涩味的主要物质为EGCG 和黄酮醇苷,苦味物质是 EGCG 和咖啡碱[49].宛晓春研究组收集测定了我国绿茶主产区 160 个春季和夏季绿茶样品中主要呈味成分,并结合感官定量评定法和数据判别分析,发现夏季绿茶中茶多酚和咖啡碱含量较高,而茶氨酸和其他氨基酸含量偏低,这可能是导致夏季绿茶苦涩味偏重的主要原因[50].在加工过程中,通过改进摊放工艺、杀青工艺、揉捻工艺以及添加外源酶等可减轻成品茶的苦涩味。

3.3 茶叶香气化学的研究
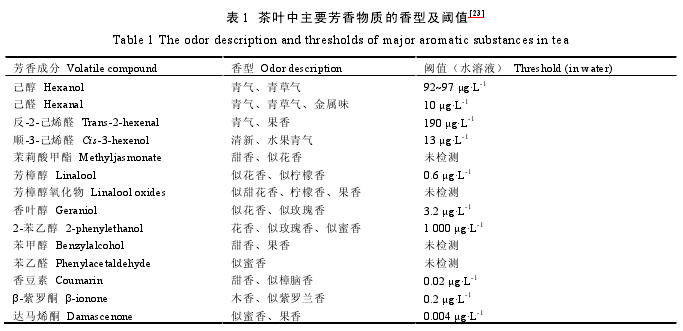
袁海波等、施梦南和龚淑英以及 Yang 等对茶叶香气物质的生物合成、加工过程对成茶香气形成的影响、茶叶香气的特征和茶叶香气的分析检测方法等方面,进行了较为系统的综述。Yang 等[23]归纳总结了茶汤中部分特征性香气物质的香型及阈值(表 1)。
3.4 茶叶化学品质差异研究
李万春[51]利用衍生化 GC/MS 方法,对 18个乌龙茶(12 个铁观音和 2 个水仙)、3 个绿茶、1 个白茶和 2 个红茶样品进行了代谢谱(糖类、有机酸、氨基酸和咖啡碱)分析,结果表明铁观音和水仙能清楚分类,红茶和其他茶类差异最大。Zhang 等[52]应用 GC-TOF-MS 和LC-Q-TOF-MS 技术检测了 12 种绿茶、12 种乌龙茶和 9 个红茶的代谢谱,分别获得 1 812和 2 608 个特征峰,在 3 类茶中共筛选出 90种存在显著差异的化合物,其中包含儿茶素、氨基酸、糖、有机酸和黄酮苷类等成分。叶茂[53]比较发现了 22 种普洱茶的化学成分与 1 种西湖龙井和 1 种立顿红茶有显著差异,且不同品种、产地、年份的普洱茶中的化学成分差异显著。
近红外光谱技术(NIR)具有快速和无损分析等优点,近年来在成品茶和茶鲜叶品质的的研究上亦取得重要进展。NIR 技术已尝试应用于茶叶含水量、咖啡碱、茶多酚、茶黄素和茶红素、总氮量、纤维素、茶叶抗氧化活性等方面的快速检测;NIR 技术还应用于茶叶等级、茶叶种类、茶叶真伪等方面的判别上;此外,NIR 技术在茶鲜叶质量评价(嫩度、匀净度和新鲜度)上[54]和茶鲜叶产地判别上[55]也进行了尝试。近年来计算机成像技术和数字处理技术的有效结合,已初步应用于茶叶加工过程中的品质控制和茶叶分级[56].
参考文献
[1] 夏涛, 高丽萍。 类黄酮及茶儿茶素生物合成途径及其调控研究进展[J]. 中国农业科学, 2009, 42(8): 2899-2908.
[2] Punyasiri P A N, Abeysinghe I S B, Kumar V, et al.Flavonoid biosynthesis in the tea plant Camellia sinensis:properties of enzymes of the prominent epicatechin andcatechin pathways [J]. Archives of Biochemistry andBiophysics, 2004, 431(1): 22-30.
[3] Liu Y J, Gao L P, Liu L, et al. Purification andcharacterization of a novel galloyltransferase involved incatechin galloylation in the tea plant (Camellia sinensis) [J].The Journal of Biological Chemistry, 2012, 287(53):44406-44417.





