
1、 引言
DNA 是染色体的主要化学成分, 是储存、复制和传递遗传信息的物质基础, 在生物体的生长、发育和繁殖等生命活动中发挥着重要的作用. DNA 的双链结构对于维持遗传物质的稳定性和复制的准确性极为重要, 其拓扑结构的变化与细胞凋亡和肿瘤发生密切相关. 近年来, 深入研究 DNA 的结构和功能以及金属配合物与 DNA 之间的相互作用成为生物无机化学的研究热点, 尤其是钌配合物与DNA之间的相互作用引起了广泛关注[1~4]. 钌配合物具有良好的热力学稳定性, 丰富的光化学、光物理和氧化还原特性, 以及低毒性、易吸收并可很快排泄的特点, 使其成为继铂类药物之后最有前途的抗癌药物之一. 已有研究发现, 抗癌药物由于能阻滞 DNA前体的合成, 或阻止 DNA 复制, 或直接破坏癌细胞DNA, 致使癌细胞的生长繁殖受到抑制, 促使癌细胞凋亡, 因此, 钌配合物断裂 DNA 的研究对于钌类抗癌药物的研发具有重要的意义. 本文列举了近年来一些代表性的研究工作, 简要综述钌配合物诱导DNA 断裂以及作用机理的研究进展.
2、 钌配合物的 DNA 断裂机理
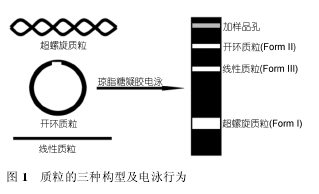
根据文献报道, 许多钌配合物包括单核、双核和杂核等不同组成与结构的钌配合物均具有断裂 DNA的作用. 钌配合物对 DNA 的断裂可采用凝胶电泳技术进行研究. 质粒 DNA 有三种构型: (1) 两条主链均完整的闭合环状 DNA 分子, 以超螺旋形式存在, 称为超螺旋质粒(Form I); (2) 仅一条主链保持完整的开环质粒 DNA 分子, 具有游离末端, 称为开环质粒(FormII); (3) 两条主链均已断裂的线性质粒 DNA 分子, 称为线性质粒(Form III). 三种构型的质粒 DNA 在琼脂糖凝胶中的迁移速率为: 超螺旋质粒 > 线性质粒 >开环质粒. 通常情况下, 质粒 DNA 主要以超螺旋构型存在, 当与钌配合物作用时会断裂为开环质粒或(和)线性质粒. 由于它们在凝胶中具有不同的泳动速率,经溴化乙啶(EB)染色后进行紫外观察即可看到不同的DNA 条带(图 1).
虽然钌配合物断裂 DNA 后均产生开环质粒或(和)线性质粒, 但其断裂机理却不相同. 根据文献报道, 钌配合物断裂 DNA 的机理包括水解机理、活性氧机理、氧化还原机理及碳类自由基机理等.
2.1 水解机理
水解机理是指钌配合物通过促使 DNA 结构中的磷酸二酯键水解而造成断裂, 水解断裂的产物在DNA 连接酶的作用下重新连接. 在钌配合物断裂DNA 的研究中, 水解机理并不常见.
Barton 等发现,在金属离子 Cu(II)、Co(II)、Zn(II)、Cd(II)和 Pb(II)催化下, Ru(DIP)2Macron+(1, 图2)能够使 pBR322 DNA 以水解方式断裂, 断裂效率为Cu(II) > Co(II) > Zn(II) ≈ Cd(II) ≈ Pb(II). Macro 是螯合配体, 可以与金属离子配位结合, 当 Ru(DIP)2Macron+与 DNA 键合时,金属离子作为亲核试剂进攻DNA 的磷酸骨架, 造成 DNA 磷酸二酯键水解而断裂. 在 T4 DNA 连接酶作用下, 非氧化还原活性离子Zn(II)、Cd(II)和 Pb(II)催化得到的 DNA 断裂产物可以大部分连接起来, 这证明了断裂机理属于水解机理; 而氧化还原活性离子 Cu(II)和 Co(II)催化得到的DNA 断裂产物只有少部分连接起来, 推断可能是水解机理和其他氧化还原反应共同作用的结果.
Deshpande 等发现,[Ru(N-N)2(BPG)]2+(2~5,图 3)、[Ru(N-N)(BPG)2]2+(6~9, 图 3)和[Ru(BPG)3]2+(10, 图 3)系列配合物可以水解断裂 pBR322 DNA,其中[Ru(dppz)2(BPG)]2+(5)和[Ru(bpy)(BPG)2]2+(6)的断裂效率最高, 其在 37℃保温 18 h 后几乎将 DNA 完全断裂. 因此推断, 辅助配体 BPG 中的 N–H 与 DNA磷酸骨架中的氧原子形成氢键与该系列配合物以水解途径断裂 DNA 有关.

2.2 活性氧机理活性氧机理是指在氧气存在的条件下, 钌物经一定波长的光照射后通过能量转移至3O2产生1O2, 以及通过电子转移产生2O·-和 OH·,1O2、2O·-和OH·活性氧物种, 可以从脱氧核糖骨架中脱氢,即氧化脱氧核糖骨架而造成 DNA 断裂. 在钌配合物断裂DNA 的机理中, 活性氧机理最常见. 表 1 总结了文献中报道的涉及活性氧机理断裂 DNA 的钌配合物. 在这些钌配合物中, 有些主要通过1O2断裂 DNA, 有些主要通过1O2和 OH·断裂 DNA, 有些主要通过1O2和2O·-断裂 DNA, 个别配合物主要通过 OH·断裂DNA, 还有些配合物虽然没有明确的结论, 但根据实验推断其为活性氧机理. 从这些机理中可以看出,1O2是钌配合物断裂 DNA 最关键的活性氧物种.
钌配合物的1O2产生量子效率可通过 1,3-二苯基异苯并呋喃(DPBF)法来测定. 当用 405 nm 波长的单色光对DPBF进行激发时, DPBF会发射荧光, 在479 nm 处出现一个发射峰. 若将一定浓度的 DPBF与光敏试剂—钌配合物混合在一起, 并用 480 nm的单色光进行照射, 则钌配合物产生的1O2会与DPBF 反应, 使 DPBF 浓度减小, 如图 4 所示. 因此,随着 DPBF 与单线态氧的反应, DPBF 的荧光强度逐渐降低. DPBF 浓度的减小、DPBF 荧光强度的降低和光照时间符合下述关系式:
-D[DPBF]/t = (I0– It)/t = IinFabFDFr(1)k/ks= FabFD/FabsFΔs (2)
式中 Iin为照射的单色光强度, I0和 It分别为未经单色光照射之前和照射 t 时间后 DPBF 的荧光强度, Fab为光敏试剂即钌配合物的吸收光效率, FD为钌配合物的1O2产生的量子效率, Fr为与 DPBF 反应的单线态氧的量子效率, 角标 s 代表参比物[Ru(bpy)3]2+. 用(I0- It)或(I0- It)/I0对 t 作图, 得到一条直线, 斜率为 k.当这种钌配合物是参比物[Ru(bpy)3]2+时, 直线的斜率为ks. 样品钌配合物与参比物[Ru(bpy)3]2+的吸收光效率Fab和Fabs可通过相同浓度下它们在480 nm处的吸光度得到. [Ru(bpy)3]2+的1O2产生量子效率FDs已知,在甲醇溶液中为 0.81, 在乙腈溶液中为 0.57, 因此,根据式(2)即可求得样品钌配合物的FD值. 文献中报道的一些钌配合物FD值见表 2, 其中 Ru-2An (11, 图5) 最 高 , 为 0.96; [Ru(bpy)2(dppz)]2+最 低 , 仅0.09.
据研究发现, 钌配合物的1O2产生量子效率与其3MLCT 激发态的寿命相关,3MLCT 激发态的寿命越长,1O2的产生量子效率越高. 例如, [Ru(bpy)2-(mitatp)]2+(12, 图 5)和[Ru(bpy)2(nitatp)]2+(13, 图 5)的3MLCT 激发态寿命分别为 427 和 355 ns, 其1O2产生量子效率分别为 0.43 和 0.36; [Ru(bpy)2(dpb)]2+

(14, 图 5) 、 [Ru(bpy)(dpb)(dppn)]2+(15, 图 5) 和[Ru(bpy)2(dppn)]2+(16,图 5)的3MLCT 激发态寿命为66、229 和 13000 ns, 其1O2产生量子效率为 0.22、0.43和 0.79. 钌配合物的1O2产生量子效率与其断裂DNA 的能力相关, 一般地, 钌配合物的1O2产生量子效率越高, 其断裂 DNA 的能力越强, 表 2 中许多钌配合物的实验结果证明了这一点. 本课题组在研究中发现, 配合物[Ru(bpy)2(fip)]2+(17, 图 5)、[Ru(bpy)2(Happip)]2+(18,图 5)、[Ru(bpy)2(pip)]2+(19, 图 5)、[Ru(bpy)2(Htip)]2+(20, 图 5)和[Ru2(bpy)4(H2bipt)]4+(21,图 5)均能以活性氧机理断裂 pUC18 DNA, 而且通过DPBF 法测得它们的1O2产生量子效率分别为 0.50、0.33、0.37、0.42 和 0.46, 其中结构相似的配合物 17、18、19 和 20 的 DNA 断裂效率顺序为 17 > 20 > 19 > 18,同样含有噻吩结构的双核配合物 21 与单核配合物 20的 DNA 断裂效率顺序为 21 > 20, 这与其1O2产生量子效率的高低一致.
除1O2的产生量子效率外, 钌配合物与 DNA 的键合强度也被认为是其断裂 DNA 的影响因素. 在具有相似结构的钌配合物中, 与 DNA 键合强度越大的配合物断裂 DNA 的能力越强, 表 3 中钌配合物的实验结果支持此结论. 此外, 钌配合物中取代基的给电子能力也被认为与其断裂 DNA 的能力有关. 取代基的给电子能力越强, 配合物断裂 DNA 的效率越高, 如 N(CH3)2、NH2、OCH3、H 和 NO2的给电子能力为 N(CH3)2> NH2>OCH3H 或者 NO2, 相应钌配合物断裂 DNA 的能力为[Ru(tpy)(dppz)(py-N(CH3)2)]2+> [Ru(tpy)(dppz)(py-NH2)]2+> [Ru(tpy)(dppz)(py-OCH3))]2+[Ru(tpy)(dppz)(py)]2+或[Ru(tpy)(dppz)(py-NO2)]2+. 此外, 本课题组还发现, 有些配合物在高浓度时会使 DNA 产生沉淀现象, 因而只能在低浓度条件下测定该配合物的 DNA 断裂情况, 如配合物 21 只能在 2 μmol/L 以下研究其 DNA 断裂能力, 因此, 配合物对 DNA 的沉淀作用也是影响其断裂 DNA 的因素。

值得注意的是, 上述因素对钌配合物 DNA 断裂能力的影响并不是绝对的, 有时会出现相悖的情况,这是多种影响因素共同作用的结果. 例如, 配合物12的DNA键合常数(8.38±0.3) × 106L/mol 小于配合物 13的(1.07±0.4) × 107L/mol, 但 12 的 DNA 断裂效率却高于 13, 这是因为 12 的3MLCT 激发态寿命(427 ns)和1O2产生量子效率(0.43)均大于 13 (355 ns, 0.36).
2.3 氧化还原机理
氧化还原机理是指在外加还原剂或氧化剂的辅助作用下钌配合物对质粒 DNA 的断裂过程. 例如,[Ru(NH3)4(diimine)]2+(diimine = bpy、phen、5,6-dmp、4,7-dmp、2,9-dmp 和 Me4phen) (22~27, 图 6)和[Ru(NH3)4(L)]2+(L = ip、pip、hpip、dip、qdppz) (28~32,图 6)系列配合物在氧化剂氧气和还原剂抗坏血酸钠作用下使 pBR322 DNA 产生了断裂现象, 其中[Ru(NH3)4(diimine)]2+(diimine = 5,6-dmp、2,9-dmp、Me4phen) (24、26 和 27, 图 6)和[Ru(NH3)4(L)]2+(L =qdppz) (32, 图 6)的断裂能力最强, 推断是反应过程中产生的 HO·从 DNA 分子中抽取氢原子, 使糖骨架碎裂, 碱基释放, 最终造成 DNA 断裂. 还有研究发现, 钌配合物在光照无氧情况下会断裂 DNA,

原子所带的正电荷显著高于基态. 如配合物 19 的电荷分布中 Ru原子由基态时的 0.9750增加到激发单线态的 1.1757 和三线态的 1.1823. 也因此, 激发态的Ru 原子比基态时具有更强的氧化性. 由于主配体接受了中心 Ru 原子转移过来的电子, 主配体在激发态时所带的正电荷明显低于基态. 如配合物 19 的电荷分布中主配体由基态时的 0.3425 减小到激发单线态的 0.2983 和三线态的 0.2789, 而且配合物已占轨道中的电子会激发到空轨道中, 因而主配体与 DNA 碱基对之间的相互作用大幅度减弱, 也同时使得 DNA碱基对的还原能力增强. 与基态时相比, 激发态时(Ru–N)m和(Ru–N)co(m = 主配体, co = 辅助配体)键长大幅度增加, 键角(N–Ru–N)m明显减小. 如配合物19 激发单线态时 (Ru–N)m和(Ru–N)co键长分别为0.2249 和 0.2329 nm, 大于基态的 0.2181 和 0.2177 nm;激发单线态时键角(N–Ru–N)m为 75.5°, 小于基态的77.5°. 因此, 激发态时, 中心 Ru 原子与配体之间的相互作用显著减弱. 这些结果说明, 钌配合物在激发态时近似于具有强氧化性的三价钌离子, 它靠近DNA 并氧化 DNA 的碱基对, 最终导致 DNA 断裂.
4、 结论与展望
综上所述, 对于钌配合物与 DNA 相互作用的研究已有较多报道, 但钌配合物断裂 DNA 的详细作用机制还需进一步深入阐释, 钌配合物对 DNA 的断裂与其抗肿瘤作用之间的关系也需深入研究, 这些研究对于理解生命的过程及调控, 合成筛选出高效、广谱、低毒副作用的钌类抗肿瘤药物有着极为重要的意义.
致谢:
本工作得到国家自然科学基金(21171022, 90922004)和北京师范大学分析测试基金资助, 特此一并致谢.
参考文献:
1 Moucheron C, Kirsch-De Mesmaeker A, Kelly JM. Photoreactions of ruthenium(II) and osminum(II) complexes with deoxyribonucleic acid(DNA). J Photochem Photobiol B, 1997, 40: 91–106.
2 Schatzschneider U. Photoactivated biological activity of transition-metal complexes. Eur J Inorg Chem, 2010: 1451–1467.
3 计亮年, 张黔玲, 巢晖. 多吡啶配合物在大分子 DNA 中的功能及其应用前景. 科学通报, 2001, 46: 451–460.
4 Gao F, Ji LN. DNA binding, photocleavage, and topoisomerase inhibition of functionalized ruthenium(II)-polypyridine complexes. Chem Biodivers, 2008, 5: 1962–1979.
5 Basile LA, Raphael AL, Barton JK. Metal-activated hydrolytic cleavage of DNA. J Am Chem Soc, 1987, 109: 7550–7551.
6 Deshpande MS, Kumbhar AA, Kumbhar AS. Hydrolytic cleavage of DNA by a ruthenium(II) polypyridyl complex. Inorg Chem, 2007, 46:5450–5452.
7 Deshpande MS, Kumbhar AA, Kumbhar AS, Kumbhakar M, Pal H, Sonawane UB, Joshi RR. Ruthenium(II) complexes of bipyridine-glycoluril and their interactions with DNA. Bioconjugate Chem, 2009, 20: 447–459.
8 Jain A, Slebodnick C, Winkel BSJ, Brewer KJ. Enhanced DNA photocleavage properties of Ru(II) terpyridine complexes upon incorporation of methylphenyl substituted terpyridine and/or the polyazine bridging ligand dpp (2,3-bis(2-pyridyl)pyrazine. J Inorg Biochem,2008, 102: 1854–1861.
9 McCrate A, Carlone M, Nielsen M, Swavey S. Anaerobic photocleavage of supercoiled DNA by a ruthenium(II) substituted fluorinated porphyrin. Inorg Chem Commun, 2010, 13: 537–539.
10 Craver E, McCrate A, Nielsen M, Swavey S. Tris-ruthenium(II)/copper(II) multimetallic porphyrin: synthesis, characterization, DNA binding and supercoiled DNA photocleavage studies. Inorg Chim Acta, 2010, 363: 453–456.
11 Gao F, Chao H, Wei YF, Yuan YX, Peng B, Chen X, Zheng KC, Ji LN. Synthesis, DNA-binding and photocleavage studies of the ruthenium(II) complexes [Ru(phen)2(ppd)]2+and [Ru(phen)(ppd)2]2+(ppd = pteridino[6,7-f][1,10]phenanthroline-11,13(10H,12H)-dione,phen = 1,10-phenanthroline). Helv Chim Acta, 2008, 91: 395–410.
12 Ryan GJ, Quinn S, Gunnlaugsson T. Highly effective DNA photocleavage by novel “rigid” Ru(bpy)3-4-nitro- and -4-amino-1,8-naphthalimide conjugates. Inorg Chem, 2008, 47: 401–403.
13 Shi HJ, Chen Y, Gao F, Yu HJ, Li GY, Chao H, Shi XF, Ji LN. Synthesis, DNA-binding and DNA-photocleavage properties of ruthenium(II)mixed-polypyridyl complex [Ru(tbz)2(dppz)]2+. J Mol Struct, 2008, 892: 485–489.
14 Yu HJ, Chao H, Jiang L, Li LY, Huang SM, Ji LN. Single oxygen-mediated DNA photocleavage of a di-bithiazolyl ruthenium(II) complex[Ru(btz)2(dppz)]2+. Inorg Chem Commun, 2008, 11: 553–556.
15 Yu HJ, Huang SM, Li LY, Jia HN, Chao H, Mao ZW, Liu JZ, Ji LN. Synthesis, DNA-binding and photocleavage studies of ruthenium complexes [Ru(bpy)2(mitatp)]2+and [Ru(bpy)2(nitatp)]2+. J Inorg Biochem, 2009, 103: 881–890.
16 Yu HJ, Huang SM, Kou JF, Li LY, Jia HN, Chao H, Ji LN. Synthesis, DNA-binding and photocleavage studies of ruthenium(II) complexes[Ru(btz)3]2+and [Ru(btz)(dppz)2]2+. Sci China Ser B-Chem, 2009, 52: 1504–1511.
17 Liu J, Huang JW, Zhao P, Fu B, Yu HC, Ji LN, Li H. A novel porphyrin-polypyridyl ruthenium(II) hybrid. Synthesis, characterization and photoinduced DNA cleavage activity. Transition Met Chem, 2006, 31: 1040–1044.
18 Malina J, Hannon MJ, Brabec V. Interaction of dinuclear ruthenium(II) supramolecular cylinders with DNA: sequence-specific binding,unwinding, and photocleavage. Chem Eur J, 2008, 14: 10408–10414.





