摘 要: 为生物传感分析选择合适的目标识别分子是提高检测灵敏度和准确度的关键。为此,人们开发了一系列诸如小分子、抗体、多肽和适配体等亲和配体。基于噬菌体展示技术筛选出数千种特异性配体,可以噬菌体为组合元件构建生物传感探针。该方法具有优异的靶向能力,并具有较强的环境耐受性。常见的M13噬菌体表面由多达2 700个拷贝的主要衣壳蛋白pVIII通过螺旋形式包裹内部的单链环状DNA而成,两端分别还有3~5个拷贝的次要衣壳蛋白pVII、pIX和pIII、pVI。通过噬菌体展示技术和化学修饰可对噬菌体进行功能化改造,M13噬菌体目前已成功应用于生物、化学、医学、材料和能源等领域。该文探讨了M13噬菌体在传感分析领域的应用,并展望了基于M13噬菌体传感探针的发展趋势。
关键词 : M13噬菌体;噬菌体展示;分析;生物传感;
Abstract: The key factor to improve the sensitivity and accuracy of biosensing is to select suitable target recognition molecules.Currently, antibodies, aptamers, peptides and antibiotics are regarded as the most frequently used target recognition molecules.However, the molecules mentioned above have a certain limitations.For instance, antibodies and aptamers suffer from high production cost and difficulties for long-term storage, whereas peptides, antibiotics have a relatively low specificity towards the analyte.Therefore, it is necessary to find more superior substitutes.M13 phage is a type of flexible filamentous bacteriophage which could specifically infect E.coli with F factor.Due to its simple component and clear genetic background, M13 phage becomes one of the bacteriophages with earliest research history.M13 phage is the bacteriophage used by the 2018-Nobel Prize winner-George Smith to develop the phage display technology.By using phage display technology, the foreign peptide, protein or antibodies could be fused and coexpressed on the capsid protein surface of M13 phage, while by constructing phage display peptide library with phages that display various types of peptide and using biopanning technique, peptides with high specificity towards target analyte could be obtained.Up till now, thousands of highly specific peptides have been selected by biopanning from various phage display peptide libraries, and their affinities towards the target analytes are comparable to those of antibodies.Under this circumstance, M13 phage with targeting peptide has attracted the researchers' interest in the field of analytical chemistry, and has become a novel platform for the construction of biosensing analysis.M13 phage consists of up to 2 700 copies of primary capsid protein pVIII wrapped in a helical form around the inner ssDNA and 3-5 copies of minor capsid proteins pVII,pIX,and pIII,pVI at both ends.This structure not only endows it good chemical stability, but also enables it to be functionalized by phage display technology or chemical modification.By coupling with appropriate signal output, M13 phages could be used for biosensing.In fact, M13 phages are an ideal platform to conduct signal simplification: by displaying/modifying the 3-5 copies of minor capsid proteins pIII with target recognition peptide and modifying the 2 700 copies of primary capsid protein pVIII with signal probes, one target-binding event can trigger a(3-5):2 700-fold signal amplification in theory.M13 phages with target recognition peptide on their pIII protein could be obtained by biopanning from phage display peptide library or by phage display techniques, whereas the signal probes reported so far include AuNPs, AgNPs, fluorescent dyes, SERS probes, etc.The detection methods coupled with M13 phages-based sensing platform include colorimetric method, fluorescent method, SPR detection, electrochemical sensing and quartz crystal microbalance method, etc.M13 phages could be applied not only for the sensing for microbes, metal ions, biomarkers and cells, but also used for the bioimaging of tumor cells and bacteria.Although great achievements have been obtained based on M13 phages, the M13 phages based biosensing still has some limitations, for example, due to the technique limitation, large proteins still cannot be displayed on the M13 phages surfaces, the mechanism for the interaction between target analyte and M13 phages needs further exploration.Nevertheless, the application prospect of M13 phages in the field of analytical chemistry is still promising.In this review, the structures of M13 phages, phage display technology and their application in the fields of optical sensing, electrochemical sensing, quartz crystal microbalance sensing and imaging analysis have been summarized.The development trend for the application of M13 phages in analysis is also prospected.
Keyword: M13 phage; phage display; analysis; biosensing;
生物传感分析在环境监测、食品安全、临床诊断以及生物反恐等领域发挥着重要作用,其中,作为生物传感探针的核心元件,目标识别分子的选择至关重要,直接决定了检测的灵敏度和准确度。为此,人们不断寻找各种与目标物具有亲和性和特异性的识别分子,如抗体、抗生素、多肽及适配体等[1]。噬菌体展示技术是一种强大的分子进化手段,可在短时间内高效获取亲和力媲美抗体的目标识别多肽[2]。将表面展示有目标识别多肽的噬菌体作为目标识别元件构建传感分析体系,具有抗体、多肽和适配体不可比拟的优势[3,4,5,6,7]。M13噬菌体是噬菌体展示技术中应用最广泛和最成熟的噬菌体[8]。M13噬菌体展示技术的初期研究主要集中在抗原表位鉴定、抗体识别以及蛋白-蛋白间的相互作用等[9,10]。随着研究深入,M13噬菌体精确的结构特征、较强的环境适应能力以及低的生产成本等优势逐渐凸显,其应用也越加广泛。本文综述了近年来M13噬菌体在光学传感、电化学传感、石英晶体微天平传感以及成像分析等领域的应用,并对其在分析传感领域的应用进行了展望。
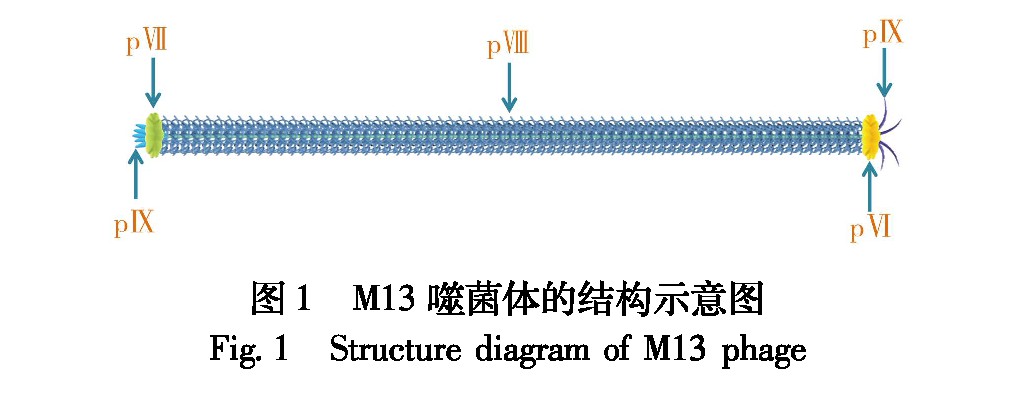
1、 M13噬菌体的结构特征
M13噬菌体是一种专门感染细菌的柔性丝状病毒,具有严格的宿主选择性,对人体无害。M13噬菌体的结构简单,整体呈圆柱形,长880 nm, 直径6.6 nm[11](图1),其表面由多达2 700个拷贝的主要衣壳蛋白pⅧ通过螺旋形式包裹而成,内部为单链环状DNA[12];野生型M13噬菌体pⅧ亚基的前8个氨基酸中有2个氨基和3个羧基暴露在外,因此可以对其进行化学修饰而不影响病毒粒子的完整性和感染性[13]。同时,M13噬菌体pⅧ蛋白中间部分的非极性氨基酸提高了噬菌体的化学稳定性,使得M13噬菌体具有耐极端酸度和离子强度的能力。此外,在噬菌体的两端分别还有管鞘状的4种次要衣壳蛋白pⅦ、pⅨ、pⅢ和pⅥ[14]。M13噬菌体的5种衣壳蛋白均由其内部的单链环状DNA编码而成,因此,通过基因工程手段可以将外源多肽或蛋白与衣壳蛋白融合表达,从而实现M13噬菌体的表面功能化[15],噬菌体展示技术也应运而生。
2 、噬菌体展示技术
1985年,Smith[16]发现将外源基因插入丝状噬菌体f1的基因Ⅲ中时,该外源基因编码的多肽会以融合蛋白的形式表达在噬菌体衣壳蛋白pⅢ中,从而创建了噬菌体展示技术。简单来讲,噬菌体展示技术是通过基因重组的方式,将外源蛋白或多肽的基因序列插入噬菌体衣壳蛋白的基因序列中,进而在噬菌体衣壳蛋白的相应位置表达出对应的外源蛋白或多肽而不影响噬菌体正常生理功能的技术。该技术巧妙地实现了蛋白质基因型与表型的统一。利用噬菌体展示技术可构建噬菌体展示文库,包括噬菌体肽库、噬菌体蛋白库以及噬菌体抗体库等。结合生物淘选[4],即可从噬菌体展示文库中获得对特定目标如糖类、毒素、蛋白、小分子或完整细胞等具有高特异性亲和力的噬菌体单克隆[17]。基于此,该技术能在短时间内将与靶标结合的克隆进行反复筛选和扩增,最终实现多肽或蛋白的定向进化。噬菌体展示技术因此被认为是一种强大的分子选择进化技术[18]。目前,噬菌体展示技术已被应用于抗原表位分析[19]、蛋白相互作用[20]、疫苗研制[21,22]、药物研发[23,24,25]以及靶向多肽的筛选[26]等领域,利用该技术可进化出抵抗自身免疫性疾病以及治愈转移性癌症的抗体,对保障人类健康意义重大,噬菌体展示技术也因此获得了2018年的诺贝尔化学奖[27]。此后,该技术在生物传感[28]、生物医学[29]以及功能材料制备[30]等领域中得到了进一步应用。随着该技术在生物领域中应用的日益深入,噬菌体制剂对人体的安全性也将逐渐引起人们的关注。目前,噬菌体展示技术依然需要更深层次的探索,例如,噬菌体展示技术多用于表达分子量较小的多肽或蛋白,而对于分子量较大的蛋白还存在着无法表达或表达数量极少的困境,这或许可以通过将多种噬菌体共同参与蛋白表达来加以改进;同时,目前噬菌体展示技术的应用多停留于功能性噬菌体的构建或筛选而忽略了噬菌体和靶标作用机理的深入研究,若能明确两者之间的相互作用并适当地对所表达的多肽进行修饰,或可进一步增强噬菌体对靶标的结合能力。
3 、M13噬菌体的分析传感应用
对于分析传感而言,能够快速识别目标物并能产生可读信号的探针是其核心元件。检测探针的选取往往取决于其特异性、选择性、检测性能、存储条件、可操作性及环境稳定性等[17]。M13噬菌体是噬菌体展示技术应用最广泛和成熟的噬菌体,其本身具有良好的水溶性、化学稳定性以及较强的环境耐受能力;而得益于噬菌体展示技术的发展,M13噬菌体还可表达与目标物有特异性结合能力的多肽或蛋白,因而在分析传感领域表现出明显的优势:与抗体和适配体相比,M13噬菌体性能更稳定,在恶劣环境下不易失活且生产成本低[31];与杂交瘤技术相比,M13噬菌体展示技术的可筛选范围更广,并且可通过基因和分子进化方法调控探针的特异性和选择性,以增强探针的亲和力和稳定性;同时M13噬菌体的存储方便,在37 ℃下可至少保存6个月[32]。因此M13噬菌体是用于构建传感探针的良好选择。
3.1、 光学传感
3.1.1、 免疫荧光法
M13噬菌体用于传感分析的最常用方法是将信号分子偶联到筛选所得的噬菌体衣壳蛋白表面,从而实现目标物的识别与检测。如从噬菌体随机十二肽库中筛选得到与葡萄球菌毒素SEB有亲和力的M13噬菌体,并将荧光染料Cy5标记在该M13噬菌体上,可实现SEB的免疫荧光检测,这也证明了噬菌体展示肽用于构建生物传感探针的可行性[33]。用Cy5标记的M13噬菌体作为传感探针还可检测海水中的2,4,6-三硝基甲苯(TNT),这也是首例在非生理环境下进行噬菌体筛选并检测小分子的报道[34]。此外,M13噬菌体pⅢ蛋白通常为3~5个拷贝,而体侧的pⅧ蛋白高达2 700个拷贝,因此,通过利用3~5个拷贝的pⅢ蛋白表达目标识别多肽,并在2 700个拷贝的pⅧ蛋白外偶联报告分子,即可实现有效的信号放大。如Goldman等[35]在M13噬菌体的pⅢ蛋白上表达了蓖麻毒素的单域抗体(sdAb),然后采用DyLight 549对M13噬菌体的pⅧ蛋白进行荧光标记,和单独使用sdAb进行荧光免疫检测相比,前者的检测灵敏度提高了5~10倍,检出限从1 ng/mL降低至64 pg/mL。
3.1.2、 表面等离子体共振分析
20世纪90年代,人们发现了表面等离子体共振(Surface plasmon resonance, SPR)现象[36],将SPR效应与高特异性和高亲和力的抗体相结合可直接用于分析检测,无需进行额外信号标记或样品预处理[37]。利用这一特性,人们发展了多种基于SPR效应的免标记光学检测方法[38]。近年来,大量实验证明噬菌体可以有效替代抗体与SPR技术相结合,且噬菌体的生产成本低、耗时短。Karoonuthaisiri等[39]从商品化的Ph.D.-12噬菌体随机展示多肽文库中筛选得到与沙门氏菌有特异性结合能力的M13噬菌体MSal020417,并将该噬菌体固定到CM5 SPR芯片上,从而构建了基于M13噬菌体的SPR检测沙门氏菌的方法。Kim等[40]采用基因工程手段在M13噬菌体pⅧ蛋白上融合表达了链霉亲和素结合短肽HPQ,并将噬菌体定向排列构建SPR传感器用于捕获和检测链霉亲和素,噬菌体的各向异性有效提高了SPR的灵敏度,灵敏度可低至fmol(图2A)。
3.1.3 、比色法
贵金属纳米粒子独特的SPR效应使其在比色传感中得到了广泛应用。M13噬菌体的纳米尺寸与贵金属纳米粒子具有较好的兼容性,通过将贵金属纳米粒子偶联到M13噬菌体的衣壳蛋白表面,可构建基于M13噬菌体-贵金属纳米粒子的比色传感体系。由于每个噬菌体表面可偶联多个纳米粒子,因此检测信号明显增强。如Cha课题组[41]首先从噬菌体文库中筛选得到能识别抗原模型IgG的噬菌体,然后将pⅧ蛋白巯基化修饰用于结合纳米金,最终通过测量纳米金的吸光度值对IgG进行定量,检出限可达100 fmol。在此基础上,该小组改进了纳米金的偶联方法,首先在噬菌体pⅧ蛋白上修饰DNA,之后通过与互补链修饰的纳米金杂交的方式有效提高了pⅧ蛋白上偶联纳米金的量,进而提高了方法的灵敏度,检出限低至25 fmol(图2B)[42]。M13噬菌体表面衣壳蛋白含有还原性氨基酸残基可同时作为还原剂和保护剂,从而实现纳米金在其表面的原位生长[43,44,45]。Wang等[46]从噬菌体肽库中筛选出对Hg(Ⅱ)具有良好亲和力的M13噬菌体,并在其表面原位生长纳米金,Hg(Ⅱ)经亲汞噬菌体表面汞结合肽捕获后,被噬菌体表面还原性氨基酸残基还原为汞单质进而沉积于纳米金表面,由此产生纳米金的SPR吸收光谱改变,从而建立了简便可靠的目视法Hg(Ⅱ)传感体系。亲汞噬菌体对汞离子的高选择性捕获和金汞天然高亲和力共同赋予该方法强的抗干扰能力,使其对干扰离子的耐受倍数远高于其他基于纳米金比色传感Hg(Ⅱ)的方法。M13噬菌体对目标物的识别能力除了可通过噬菌体文库筛选技术获取之外,还可通过融合表达目标物结合肽来实现。M13噬菌体对含F性菌毛的大肠杆菌具有侵染性,是因为其pⅢ蛋白具有对应的宿主菌识别肽。Peng等[3]通过将原M13噬菌体宿主菌识别肽替换为可识别其他宿主菌的多肽,并通过偶联纳米金作为信号输出,实现了嵌合M13噬菌体-纳米金复合物对多种微生物的高选择性检测。
3.1.4 、荧光共振能量转移法
荧光共振能量转移(Fluorescence resonance energy transfer, FRET)的基本原理是激发能通过偶极-偶极耦合从供体转移至受体同时引发受体产生荧光,其中,能量转移过程是通过空间的相互作用完成,基本不受溶剂或大分子的影响,而对供体和受体间距离的要求十分苛刻,也是实现FRET的关键。有机染料、共轭聚合物、半导体纳米晶、量子点等已被广泛开发并应用于FRET分析检测[47]。虽然这些材料具有高量子效率和电子亲和能,但分子接触引起的猝灭过程使得其无法获得最优能量转移效率,因此,对分子间距进行可控设计可大大提高FRET效率[48]。M13噬菌体明确的结构(pⅧ蛋白N末端的距离约为3.2 nm和2.4 nm)及特异性结合特性使得其在构建FRET体系中具有独特优势。Chen等[49]报道了一种基于M13噬菌体构建的FRET荧光探针,实现了对胞内pH的传感检测。该法首先通过化学方法将β-环糊精(β-CD)修饰在噬菌体pⅧ蛋白上,而后将对pH敏感的异硫氰酸荧光素(FITC)与不敏感的罗丹明B(RhB)通过金刚烷基与β-CD的主客体识别进行连接,从而实现荧光能量从FITC(供体)到RhB(受体)的转移(图2C)。
3.1.5 、表面增强拉曼散射分析
1974年,Fleischmann等[50]在表面粗糙的银电极上观察到了吡啶的拉曼光谱,随后,Jeanmaire和Duyne[51]在1977年通过系统的实验和计算阐述了其机理,并指出这是一种表面增强拉曼散射(Surface enhanced Raman scattering, SERS)光谱效应。从理论上讲,附着在金属纳米材料表面的分子可显着增强拉曼信号,其增强因子达1011~1012,SERS因此可以作为强大的高灵敏度检测光谱技术,并已被广泛应用于各种生物或化学传感中,如单分子检测、生物标记、环境监测以及法医检测等[52]。M13噬菌体由于具有独特的特异性结合能力,因此被作为识别分子与SERS联用进行生物分析,而其高拷贝的pⅧ蛋白也可通过偶联SERS信号分子进一步提高检测灵敏度。如Lee等[53]将DNA修饰Au@Ag核壳纳米颗粒与互补链修饰的M13噬菌体相结合,建立了新型的生物传感体系,得益于M13噬菌体的高比表面积,相比于DNA-抗体体系,DNA-M13噬菌体体系的检测信号增大了75倍。此外,M13噬菌体-SERS体系还可用于农药残留物的检测(图2D)[54]和疾病诊断,Ngugen等[55]将富含半胱氨酸的M13噬菌体与介孔SERS基底相结合,实现了对脓毒症标志物的检测;Lentini等[56]制备了噬菌体-纳米银体系用于淋巴瘤细胞U937的鉴别。
图2 M13噬菌体在表面等离子体共振(A)[40]、比色(B)[42]、荧光共振能量转移(C)[49]以及表面增强拉曼散射(D)[54]中的应用
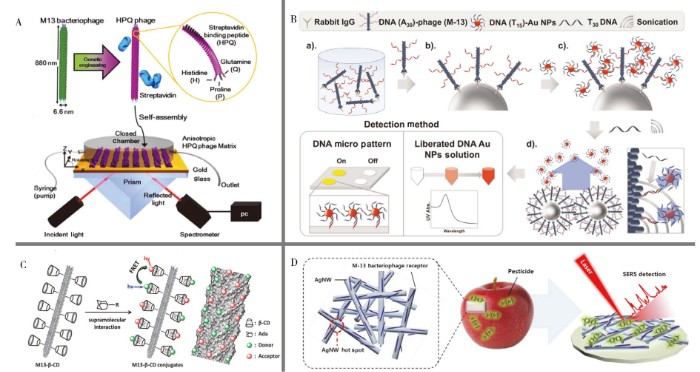
Fig.2 Application of M13 phage in optical analysis, including SPR(A)[40],colorimetric method(B)[42],FRET(C)[49] and SERS(D)[54]
可以看出,M13噬菌体在高灵敏光学传感应用中具有显着优势,但同样会受到光学检测固有属性的限制,比如比色传感无法检测有颜色干扰的样品;此外,相对抗体、适配体等配体,M13噬菌体保存更方便,非常适合用于构建便携式光学传感器,但目前该领域的研究很少。
3.2 、电化学传感
噬菌体应用于电化学传感领域同样具有较好的分析性能。2005年,Neufeld等[57]以M13噬菌体以及大肠杆菌TG-1为模型,建立了检测细菌的电化学分析方法。将碱性磷酸酶基因pFLAG-ATS-BAP插入M13KO7噬菌体中,当噬菌体进入宿主菌TG-1后,便会产生大量碱性磷酸酶,酶与细菌内的底物对氨基苯基磷酸盐的反应活性可转化为电化学信号。该方法灵敏度好,检出限低至1 cfu/mL。利用噬菌体构建电极,不仅稳定性强且灵敏度高[58,59,60]。M13噬菌体近2 700拷贝的pⅧI蛋白,每个蛋白均可连接酶或者报告分子,因此将表达有亲和多肽的M13噬菌体用于检测,其灵敏度会比仅使用抗体高出几百倍[61](图3)。Sedki团队[62]通过EDC/NHS法将M13噬菌体固定到表面沉积有纳米金的玻碳电极上,利用M13噬菌体与含F性菌毛的大肠杆菌之间特有的亲和性,首次建立了一种高灵敏的阻抗法(EIS)电化学传感器用于大肠杆菌菌群的早期检测,选择性较高,检出限仅为14 cfu/mL,并且该方法在实际样品中具有优越的抗干扰能力。虽然将噬菌体用于电化学检测具有优异的灵敏度和高选择性,但直接用噬菌体修饰电极进行检测,其制备过程复杂,且电极在经过反复数次使用后,检测性能会不可避免地下降,因此有必要进一步开发和制备便捷且检测性能稳定的噬菌体修饰电极。
3.3 、石英晶体微天平传感
石英晶体微天平(Quartz crystal microbalance, QCM)用于免疫传感时,主要依赖于抗体的选择性和亲和力。然而,使用抗体存在许多固有缺陷,比如成本高、可重复利用性差、固定困难以及易损坏等。相反,噬菌体展示多肽具有良好的耐久性、可重复使用性、稳定性好以及成本生产低等优势,同时还具有与抗体同等的特异性和灵敏度。Petrenko和Olsen等[2,63]先后提出并用实验证明了噬菌体用于QCM的概念,同时还发现,噬菌体可以很容易地通过物理吸附固定在QCM的金电极上,这是优于抗体的另一大优势。此外,由于噬菌体具有良好的耐受性,Yang等[64]将M13噬菌体固定在QCM的金电极上用于检测抗体,并建立了可再生传感电极表面,仅用0.5 mol/L的盐酸溶液处理电极即可将与噬菌体结合的抗体去除而不影响噬菌体对抗体的再次结合能力。目前,基于噬菌体的QCM传感主要利用噬菌体对宿主菌的天然选择性进行检测,这使得其适用范围有所局限;另外,虽然利用噬菌体修饰的电极重复使用率高于抗体,但使用次数依然有限,因此也限制了基于噬菌体QCM传感的应用。
图3 M13噬菌体在电化学免疫传感中的应用[61]
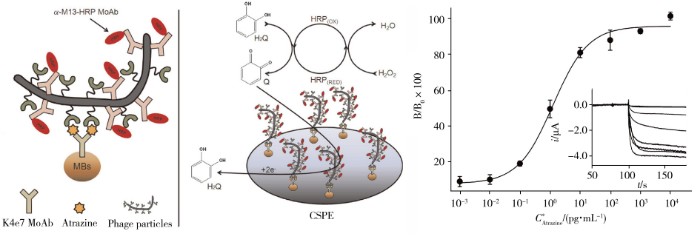
Fig.3 Application of M13 phage in electrochemical immune sensing[61]
3.4、 成像分析
成像和无损检测一直是医学界不断探索和发展的领域,对疾病的早期发现和治疗具有十分重要的意义。通过基因工程或化学修饰,可在M13噬菌体的衣壳蛋白表面同时连接靶向配体和成像分子,从而将靶向性和成像功能巧妙地结合起来以实现靶向成像分析。例如通过生物素连接酶将不同的量子点分别修饰到筛选所得两种靶向噬菌体表面,可实现对细胞不同蛋白的双色成像[65]。分别在M13噬菌体pⅢ和pⅧ蛋白上同时表达对肿瘤标志物SPARC和磁性氧化铁纳米颗粒有亲和力的多肽,可用于小鼠体内癌细胞和肿瘤的靶向磁共振成像[66];此外,与其他近红外荧光染料相比,利用M13噬菌体制备近红外荧光纳米材料(SBP-M13-SWNT)用于体内靶向弥散性肿瘤的信噪比更好,对肿瘤的检测和指导切除能力也明显提高[67](图4)。除了能够对肿瘤细胞进行成像分析,M13噬菌体还可用于构建体内感染性疾病的靶向成像。2013年,Belcher课题组[32]将M13噬菌体与荧光染料结合,不仅实现了对有无F菌毛的细菌感染的成像区分,还可进一步在M13噬菌体pⅢ蛋白上连接某种细菌抗体,从而对特定细菌感染进行靶向成像。由于M13噬菌体pⅧ蛋白的高拷贝数,利用M13噬菌体构建的体内靶向成像探针的信噪比更高,且与近红外材料相结合,穿透力更强,非常适合用于机体深层次的组织和细胞成像分析,但目前相关研究并不多,并且其在体内的代谢机制和对人体的安全性也尚不明确。
图4 SBP-M13-SWNT 指导手术切除肿瘤[67]
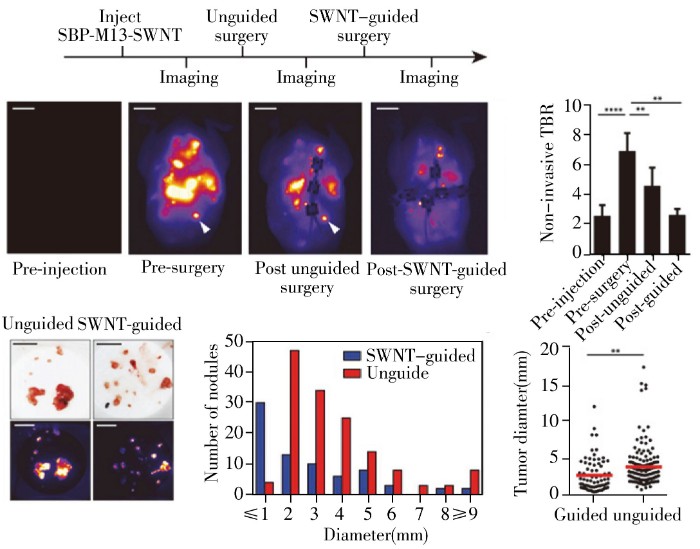
Fig.4 Surgical removal of tumors with SBP-M13-SWNT guidance [67]
4 、结论与展望
对于M13噬菌体,无论是其内部基因还是外层衣壳蛋白结构,都非常简单和易于修饰。同时,大量的研究报告证实,噬菌体用作识别探针或生物模板,不仅具有良好的特异性,还具有优越的环境耐受性。通过噬菌体展示文库可获得大量靶向多肽,因此,进一步开发噬菌体多功能化的修饰方法以及探索高亲和性和特异性噬菌体的筛选方法,也将推动基于噬菌体的多模式和多靶标检测的发展,M13噬菌体在分析传感领域的应用也将会更加广泛;其次,深入研究噬菌体与靶标分子间的相互作用,有助于更好地选择信号分子和分析方法,从而实现目标分子的高灵敏检测;最后,基于噬菌体构建的传感探针,往往能适应更宽的温度及pH值变化范围,稳定性较好,因而可发展基于噬菌体的便携式检测试剂盒用于更为复杂的实际样品分析。
参考文献
[1] Tan Y Y,Tian T,Liu W L,Zhu Z,Yang C Y. Biotechnol.J,2016.11(6):732-745.
[2] Petrenko V A,Vodyanoy V JJ.Microbiol.Meth. 2003,53(2)-.253-262.
[3] Peng H,Chen IA.ACS Nano,2019,13(2): 1244-1252.
[4] Sunderland K S,Yang M.Mao C. Angew. Chem.Int. Ed. ,2017,56(8):1964-1992.
[5] Merzlyak A,Lee S W.Curr. Opin. Chem. Biol,2006, 10(3):.246-252.
[6] Smartt A E,Ripp S. Anal. Bioanal. Chem. ,2011,400(4):991-1007.
[7] Farooq U,Yang Q,Ullah M W,Wang S. Biosens .Bioelectron. ,2018,118:204-216.
[8] Smith G P,Scott J K Method Enzymol,1993,15:228-257.
[9] Mullaney B P,Pallavicini M G Exp.Hematol. 2001,29:1136-1146.
[10] Presta L G.J Allergy Clin. Immunol.,2005, 116(4):731-737.
[11] Li K,Chen Y,LiS Q,Nguyen H G.Niu Z W,You S J,Mello C M,Lu X B,Wang Q Bioconjugate Chem. ,2010.21(7): 1369-1377.
[12] Muzard J,Platt M,Lee G U.Small,2012,8(15):2403-2411.
[13] Petrenko V A.Microelectron.J. ,2008 39(2):202-207.
[14] Smith G P,Petrenko V A.Chem.Rev., 1997 ,97:391-410.
[15] Liu A,Abbineni G,Mao C Adv.Mater.,2009,21(9): 1001-1005.
[16] Smith G P.Science, 1985,228:1315-1317.
[17] Petrenko V. Exp Opin.Drug Deliv. 2008, 5(8):825-836.
[18] Petrenko V A,Sorokulova I B J.Microbiol.Meth. ,2004, 58(2)-147- 168.
[19] Luzar J,Strukelj B,Lunder M.llergy,2016,71(11): 1526-1532.
[20] Huang W,Soeung V,Boragine D M,Palzkill T.ACS Synth Biol. ,2020,9(7)-1882- 1896.
[21] Aghebati-Maleki L, Bakhshinejad B, Baradaran B, Motllebnezhad M.Aghebati-Maleki A. Nickho H,Yousefi M,Majidi J.J .Biomed .Sci .2016,23():66-83.
[2] Lopes R S,Queiroz M A F,Gomes S T M.WVllinoto A C R,Goulart L R,Ishak R Biotechnol.Adv. 2018.36(7):1847-1854.
[23] Martins | M,Reis R L,Azevedo H S.ACS Chem .Biol. 2016.11(11):2962-2980.
[24] Wu C H,Liu I J,Lu R M,Wu H C.J.Biomed. Sci. ,2016,23(1):8-21.
[25] Staquicini F 1,Sidman R L,Arap W,Pasqualini R Adv. Drug Deliver Rev. ,2010,62(12):1213-1216.
[26] Yang M Y,Li Y,Huai Y Y,Wang C Y,Yi W F,Mao C B.Chem. Commun. ,2018,54(13)-1631-1634.
[27] Smith G P.Angew.Chem.Int. Ed.2019,58.14428-14437.
[28] Xu P,Ghosh S,Gul A R,Bhamore J R,Park J P,Park T J.TrAC Trends Anal. Chem. ,2021,137:116229-116246.
[29] Nagano K,Tsutsumi YViruses,2021.13(2):178-193.
[30] Davidson T A,McGoldrick S J,Kohn D H.Int. J.Mol.Sci. ,2020,21(17):5994-6010.
[31] Warner C M,Barker N,Lee S W,Perkins E J Bioprocess Biosyst. Eng..2014,37(10):2067-2072.
[32] Bardhan N M, Ghosh D Belcher A M.J .Biophoton.,2014,7(8):617-623.
[33] Goldman E R,Pazirandeh M P,Mauro J M,King K D,Frey J C,Anderson G P.J.Mol.Recognit. ,2000,13:382-387.
[34] Goldman E R,Pazirandehb M P,Charlesb P T,Balighianb E D,Andersonb G P.Anal.Chim Acta,2002 457:13-19.
[35] Goldman E,Liu J,Bernstein R,Swain M,Mitchell S,Anderson G Sensors 2009.91):542-555.
[36] Link S,El-Sayed M A.J.Phys Chem B, 1999,103(21):4212-4217.
[37] Marusov G Sweatt A,Pietrosimone K Benson D,Geary S J,Silbart L K,Challa S,Lagoy J,Lawrence D A,Lynes M A. Environ. Sci. Technol. ,2012,46(1):348-359.
[38] Homola J,Yee S S, Gauglitz G Sens Actuator B.1999,54:3-15.
[39] Karoonuthaisiri N,Charlermroj R,Morton M J,Oplatowska- Stachowiak M,Grant 1 R,lliott C T.Sens Actuator B,2014,190:214-220.
[40] Kim W G, Song H,Kim C,Moon J S,Kim K,Lee S W,Oh J W. Biosens .Bioelectron. ,2016 85:853-859.
[41] Lee J H,Cha J N.Anal Chem. ,2011,83(9);:3516-3519.
[42] Lee J H,Domaille D,Cha J N.ACS Nano,2012,6(6):5621-5626.
[43] Setyawati M 1,Xie J,Leong D T.ACS Appl.Mater.Interfaces ,2014.6(2):910-917.
[44] Wang X Y,Yang T.Wang S Y,Du K D,Chen M L,Wang J H.Anal Chim Acta,2019,1073:72-78.
[45] Yang T,Li N.Wang X Y.Zhai J.Hu B,Chen M L,Wang J H. Chin. Chem.Lett. ,2020,31(1):145-149.
[46] Wang X Y,Yang T,Zhang X X,Chen M L,Wang J H.Nanoscale,2017 ,9(43):16728-16734.
[47] Kim 1,Moon J S,Oh J W.Nano Converg. .2016,3:27-43.
[48] Woo H Y,Vak D,Korystov D,Mikhailovsky A,Bazan G C,Kim D Y.Adv.Funct.Mater. ,2007,17(2):290-295.
[49] Chen L M,Wu Y H,Lin Y,Wang Q. Chem. Commun.2015, 51(50): 10190-10193.
[50] Fleischmann M.,Hendra P J,Mcqillan A J.Chem. Phys. Ltt,1974,.26(2): 163-166.
[51] Jeanmaire D L,Duyne R P V.J .Electroanal Chem.,1977,84:1-20.
[52] Sharma B,Frontiera R R,Henry A I,Ringe E, Van Duyne R P.Mater. Today,2012, 15(1/2): 16-25.
[53] Lee J H,Xu P F,Domille D W,Choi C,Jin S,Cha J N.Adv.Funct.Mater. ,2014,24:2079-2084.
[54] Koh E H,Mun C,Kim C,Park s G,Choi E J,Kim S H,Dang J,Choo J,Oh J W,Kim D H,Jung H S ACS Appl. Mater Interfaces,2018, 10(12):10388-10397.
[55] Nguyen A H,Shin Y,Sim s J .Biosens Bioelectron.,2016,85.522-528.
[56] Lentini G,Fazio E,Calabrese F,De Plano L M,Puliafico M,Franco D,Nicolo M S ,Carnazza S,Trusso S Allegra A.Neri F,Musolino C Guglielmino S P P Biosens Bioelectron,2015,74: 398-405.
[57] Neufeld T,Mittelman A s, Buchner V,Rishpon J.Anal.Chem. ,2005,77(2):652-657.
[58] Yang L M C.Tam P Y,Murray B J,McIntire T M,Overstreet C M.Weiss G A,Penner R M.Anal. Chem. ,2006,78:3265-3270.
[59] Jaworski J W,Raorane D,Huh J H,Majumdar A,Lee S W.Langmuir,2008,24.4938-4943.
[60] Kim T H,Lee B Y,Jaworski J,Yokoyama K,Chung W J,Wang E,Hong S,Majumdar A,Lee S W.ACS Nano,2011 5(4)-2824-2830.
[61] Gonzalez -Techera A,Zon M A,Molina P G,Fernandez H,Gonzalez-Sapienza G, Arevalo F J Biosens. Bioelectron. 2015,64:650-656.
[62] Sedki M,Chen X,Chen C,Ge X,Mulchandani A. Biosens .Bioelectron. ,2020, 148:111794.
[63] OIsen E V,Sorokulova 1 B,Petrenko V A,Chen I H,Barbaree J M,Vodyanoy V J Biosens. Bioelectron. ,2006,21(8):1434-1442.
[64] Yang L M C,Diaz J E,McIntire T M,Weiss G A,Penner R M.Anal. Chem. ,2008 80:933-943.
[65] Chen 1,Choi Y A,Ting A Y.J Am Chem.Soc ,2007,129:6619-6625.
[66] Ghosh D,Lee Y,Thomas S,Kohli A G,Yun D s, Belcher A M,Kelly K A.Nat Nanotechnol. ,2012,7(10):677-682.
[67] Ghosh D,Bagley A F,Na Y J.Birrer M J,Bhatia S N,Belcher A M. Proc Natl. Acad .SciUSA,2014.111(38): 13948- 13953.





