摘要:数字PCR(Digital PCR,dPCR)是核酸绝对定量的新方法,该技术通过分液,将含有核酸模板的PCR反应体系分配到上万个反应器中进行PCR扩增,根据荧光信号的有或无,进行结果计数,通过泊松分布的统计处理,直接得出核酸的拷贝数。相比于实时荧光定量PCR(Quantitative PCR,qPCR),dPCR不需要建立标准曲线,应用前景更广。本文对dPCR的发展历史、原理及其应用进行了综述。
关键词:数字PCR;绝对定量;拷贝数;实时荧光定量PCR.
自1985年Kary Mullis发明PCR技术以来,PCR技术一直是生物医学领域中重要的实验方法。随着分子生物学技术的发展,目前核酸定量的主要方法 是 实 时 荧 光 定 量PCR(Quantitative PCR,qPCR)。数字PCR(Digital PCR,dPCR)是近年来发展起来的新技术,是对传统PCR方法的技术革新,两者最主要的区别在于计算核酸拷贝数方法不同,dPCR方法采用了新的定量策略和实验思路,可以对核酸的拷贝数进行绝对定量,相比于qPCR不需要建立标准曲线,具有更广阔的应用前景。目前,已有很多基于微滴或芯片的商业化dPCR平台应用于分子生物学、医学等各个领域,并发挥了重要作用。因此,本文主要从dPCR方法的发展历史、原理及其应用方面进行了阐述。
1 dPCR的发展历史。
1992年,Sykes等[1]从非淋巴细胞和正常体细胞背景中鉴定突变的白血病细胞,检测了复杂背景下低丰度的IgH重链突变基因。该研究中提出了三个重要的原则:有限稀释、终点信号的有或无及对数据泊松分布的统计处理,为以后dPCR的发展奠定了基础。
1997年,有研究利用玻璃毛细管作为载体进行PCR反应,可以对模板分子进行定量,验证了Taq-Man探针可以检测模板单分子,尤其在微小的反应体系中,发展了单分子定量技术[2],为dPCR单模板扩增提供了技术支持。
1999年,Bert Vogelstein和Kenneth W.Kin-zler[3]正式提出了dPCR的概念,可以将指数型函数转化成线性函数,对模板进行有限稀释,根据荧光信号的有或无进行精确定量。实验利用384孔板对样品进行稀释、扩增,来检测结、直肠癌粪便样品中c-Ki-Ras基因突变,对数据进行泊松分布的处理。研究还提出了数字PCR的另外一个优势,由于粪便样本中含有大量的PCR反应抑制剂,通过对样品进行稀释,提高了对反应抑制剂的耐受程度。
2003年,Devin等[4]提出了BEAMing技术,包括小珠(Bead)、乳浊液(Emulsion)、扩增(Amplifi-cation)、磁性(Magnetic)。利用包被链霉亲和素的磁性珠子和生物素标记的寡核苷酸,形成微乳液,进行PCR扩增,通过流式细胞仪检测荧光标记来进行计数,这个技术为以后微滴式dPCR的产生提供了技术依据。
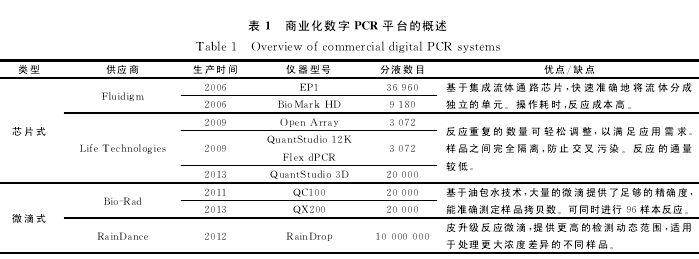
2006年,Fluidigm公司第一个生产商业化的基于芯片的dPCR仪,主要包括EP1系统和BioMarkHD系统。2009年,Life Technologies推出了OpenArray和QuantStudio 12K Flex dPCR系统,2013年,Life Technologies又 推 出 了QuantStudio 3DdPCR系统,采用高密度的纳升流控芯片技术,将样本均匀的分配至20 000个单独的反应孔中。
2011年,Bio-Rad公 司 推 出 了 基 于 微 滴 的QX100dPCR仪,利用油包水技术,将样品平均分配到20 000个微滴油包水中,利用微滴分析仪对微滴进行分析;2013年,Bio-Rad公司推出在QX100基础上的升级QX200dPCR仪。2012年RainDance公司推出了RainDrop dPCR仪,在高压气体驱动下,将每个标准反应体系分割成包含100万至1 000万个皮升级别微滴的反应乳液,提高了dPCR仪的检测范围,适于检测浓度差异较大的样品(表1)。
到目前为止,dPCR的扩增载体从多孔板、毛细管发展到目前的芯片和微滴,降低了反应成本,提高了PCR反应的分液数目和实验的灵敏度。
2 dPCR的原理。
dPCR的原理是将含有核酸模板的标准PCR反应体系,平均分配成上万个和数百万个PCR反应,分配到芯片或微滴中,使每个反应中尽可能含有一个模板分子,进行单分子模板PCR反应,通过读取荧光信号的有或无进行计数,经过统计学泊松分布的校准进行绝对定量。