摘 要: 本研究旨在探讨利用模拟微重力效应研究微重力对果蝇运动及睡眠影响的可行性.通过研制能够在模拟微重力环境下实时监测果蝇行为的随机定位仪,监测短时间(3 d)模拟微重力处理过程中,及长时间(10 d、20 d、30 d)处理后雄蝇运动和睡眠的变化;选取受影响较显着的短时间处理组,研究模拟微重力效应对生物钟核心基因(period (per)、timeless(tim)、clock (clk)、cycle (cyc)、cryptochrome (cry))、神经递质多巴胺(dopamine,DA)和5-羟色胺(5-hydroxytryptamine,5-HT)关键合成酶(多巴脱羧酶、酪氨酸羟化酶、色氨酸羟化酶)的编码基因ddc、pale和trh表达水平及DA和5-HT含量的影响.结果显示:短时间暴露下,雄蝇夜晚的运动量增加、单位时间运动次数增加、睡眠时间和次数减少、生物钟基因tim、clk、cyc、cry及神经递质合成相关编码基因ddc、pale和trh的表达水平均显着上升;长时间处理后对雄蝇运动和睡眠的影响较小.本研究认为利用模拟微重力效应研究微重力对果蝇运动及睡眠的影响是可行的,相关研究结果对航天医学研究具有借鉴意义.
关键词: 模拟微重力; 随机定位仪; 果蝇; 运动; 睡眠;
Abstract: This study was aimed to investigate the feasibility of using simulated microgravity to study the effects of microgravity on activity and sleep of Drosophila melanogaster. Simulated microgravity experiments performed using the random positioning machine(RPM) and male Drosophila melanogaster, and the activity and sleep of the flies were monitored using the DAM system(Trikinetics, USA). First, flies were exposed to simulated microgravity for a short time(3 days) with DAM system monitoring. Next, after being exposed to simulated microgravity for a long time(10, 20, and 30 days), flies were removed to be monitored for 3 consecutive days under control conditions. Then, the flies after short-term treatment(3 days) with greater impact were sampled to study the effects of simulated microgravity on the major circadian clock genes period(per), timeless(tim), clock(clk), cycle(cyc), cryptochrome(cry), and ddc, pale, trh genes encoding dopa decarboxylase, tyrosine hydroxylase, tryptophan hydroxylase, that involved in synthesis of neurotransmitter dopamine(DA) and 5-hydroxy-tryptamine(5-HT), and the contents of DA and 5-HT. The results showed that during short-term treatment, total activity accounts and activity accounts in wake period both increased, and total sleep and number of sleep episode both decreased at night; after short-term treatment, the relative expression levels of tim, clk, cyc and cry increased, and the relative expression levels of ddc, pale and trh increased; after long-term treatment,overall effect on activity and sleep was slight. This study suggests that it is feasible to study the effects of microgravity on activity and sleep of Drosophila melanogaster by simulated microgravity, and valuable reference can be provided for aerospace medical research.
Keyword: imulated microgravity; random positioning machine; Drosophila melanogaster; activity; sleep;
随着中国载人航天事业的不断发展,未来中国空间站的建成并投入使用,将有更多的航天员或航天工程师被送入太空,并长期在轨工作.相关研究表明,航天员在轨期间普遍存在睡眠时间短、睡眠质量差等睡眠问题.良好的睡眠对人体健康的重要性不言而喻[1,2,3],如何保障航天员的在轨高质量睡眠成为亟待解决的重要科学问题.空间环境下微重力、光、噪声、昼夜节律及作息制度[4,5]等被认为是造成航天员睡眠障碍的主要诱因,为此科学家们从航天器的设计、配置及睡眠环境的设置到航天员的训练都开展了大量的工作.但实际调查结果显示,这些并不能完全解决航天员的在轨睡眠问题[4,5,6,7,8].这与我们目前对空间环境,特别是微重力对睡眠的影响及作用机制的了解较少,无法针对性地对航天员进行训练、调整及实现生物节律干预等密切相关.
目前,微重力对睡眠的影响研究主要基于天基实验和地基模拟实验,前者主要来自国外航天员的飞行报告及相关在轨监测结果,而国内的研究工作鲜见报道.根据来自美国国家航天与航空局的多批次航天员的自我报告或活动记录仪监测结果显示,许多航天员在太空中,睡眠时间明显减少,甚至不足6 h,且每个夜晚的波动较大,同时睡眠结构也发生了改变,睡眠质量变差,并且航天员还普遍存在促睡眠用药的记录.虽然服用后主观入睡时间缩短且睡眠质量提高,但体动记录仪显示睡眠效率并没有提高,睡眠时长也并没有增加,而且此类药物的副作用也非常值得警惕[4,9,10].

鉴于航天飞行任务的特殊性和航天搭载空间资源的稀缺性,利用航天员或实验动物开展在轨研究都存在较大的困难,难以进行较为系统深入的作用机制研究.模拟微重力效应的地基实验成为重要的辅助研究手段,如头低位卧床法[11,12]、尾悬吊[13]或后肢卸载[14]法、随机定位仪[15,16,17,18,19,20,21,22,23,24,25,26,27,28]等.其中,随机定位仪凭借其易于操作、可连续工作、性能稳定可靠、可在短期内进行多次重复等优势,运用越来越广泛.但目前地基模拟实验研究中缺乏关于模拟微重力效应对睡眠影响的相关报道,其重要原因之一是缺乏相应的研究设备、研究模型和评价方法.
果蝇凭借体积小、繁殖快及成熟期短等特点和优势成为了航天搭载的“常客”,多项研究表明果蝇对空间环境较为敏感,航天飞行会令其产生一定的生理和遗传反应[27,28,29,30,31,32];虽然地基的实验结果表明,果蝇能够对随机定位仪模拟的微重力效应做出响应[19,20],经随机定位仪暴露的果蝇能够发生部分与真实的微重力相似的基因表达[27,28].但利用随机定位仪研究果蝇行为,特别是睡眠行为变化的研究几乎未见报道.近年来,果蝇作为研究睡眠行为的模式生物被广泛应用[33,34,35,36,37,38],本研究研制一套适用于果蝇睡眠研究的随机定位仪,并从果蝇活动规律和生物钟调控机制的变化两方面出发,一方面探讨利用随机定位仪研究果蝇睡眠行为的可行性,另一方面,初步探索模拟微重力效应对果蝇睡眠的影响及作用机制,从而为研究微重力效应对生物体睡眠的影响提供新的思路.
1、 材料与方法
1.1 、果蝇培养
野生型黑腹果蝇(Drosophila melanogaster)Canton-S(CS)品系,购自中国科学院上海生命科学研究院生化细胞所果蝇资源与技术平台.果蝇培养采用玉米粉-糖-酵母,培养于人工气候箱中,光照周期12 L∶12 D(6∶00 am开灯,6∶00 pm关灯),温度(25±1)℃,相对湿度(60±2)%.本研究所用果蝇均为CS雄性果蝇.
1.2 、微重力效应模拟系统
本研究所用的微重力效应模拟系统由中国科学院城市环境研究所和上海技术物理研究所针对果蝇的特点联合研制,主要由随机定位仪(图1a)及系统控制(图1b、c)两部分组成.随机定位仪主要由机座、垂直支撑架、外转动机构、内转动机构、驱动系统、样品安装单元和光源组成.其中样品安装单元针对果蝇行为监测设备DAM2监测器和DPM监测器(TriKinetics,美国)的特点,设计有相应的样品台,相关电源和信号传输采用定制导电传输组件设计,能够避免导线在旋转过程中造成扭伤,保证设备稳定工作同时,实现监测数据的实时传输.光源由LED灯条组成,可以对光照时间及强度进行稳定精确的控制.系统控制由电控箱(图1b)和控制软件(图1c)组成,控制微重力模拟单元伺服电机及照明系统,同时根据果蝇的特点及相关文献报道,设计适于果蝇研究的回转参数,模拟结果显示微重力模拟效果大约为10-4g.
Fig.1 Microgravity simulation system

(a)Random positioning machine.(b)Electric cabinet.(c)Control software.
1.3、 运动及睡眠行为监测
1.3.1 、短时间模拟微重力效应
将新生雄蝇装入果蝇行为监测系统DAM2监测器(美国TriKinetics)中,具体操作如下:在监测玻璃管(内径为3.5 mm,长度为65 mm)一侧装入培养基(5%蔗糖+2%琼脂)供雄蝇食用;另一侧利用棉花塞住管口,每只玻璃管装入一只雄蝇,每个监测器放32根监测管,每5 min记录一次雄蝇的运动情况.设置处理组(G组)以及对照组(C组),将G组的监测器放置于随机定位仪中,静置至少24 h以上使雄蝇适应,于第3天6∶00 am开启设备连续处理3 d,之后关闭设备,摆正监测器继续监测24 h用以观察雄蝇的恢复情况;C组的监测器放置于随机定位仪旁,确保两组所处的光照、温度、湿度等环境相同.
1.3.2 、长时间模拟微重力效应
在短时间模拟微重力效应对雄蝇运动及睡眠的影响研究中,设备关闭后雄蝇的运动和睡眠行为很快恢复至对照状态(详见2.1.1).因此,开展了较长时间的处理,具体如下:将新生雄蝇装入试管中,设置处理组(G组)以及对照组(C组),将G组的试管放置于随机定位仪中,静置至少24 h以上使雄蝇适应其环境,之后开启设备连续处理,C组的试管放置于随机定位仪旁.期间G组与C组均每3 d更换新鲜的培养基.于处理的第10、20、30 d分别从C组和G组随机取出部分雄蝇,在对照条件下用DAM2对两组雄蝇的行为进行监测,具体操作方法参照1.3.1,统计分析3 d内雄蝇的运动和睡眠情况.
以上实验中,雄蝇的运动和睡眠情况统计均来自各组每只雄蝇的均值.考虑到CS果蝇睡眠昼夜间的差异,对白天、夜晚及一个昼夜周期(24 h)的数据分别进行统计,运动能力主要通过统计目标时间段内的总运动量和单位时间运动量(总运动量/清醒的时间)进行评价,睡眠情况主要通过统计目标时间段内的睡眠时间、睡眠次数及每次睡眠时长(睡眠时间/睡眠次数)进行评价,果蝇静止不动的时间大于5 min时,判断果蝇处于睡眠状态[31].
1.4 、生物钟相关基因表达水平的检测
针对对模拟微重力效应有显着响应的短时间处理组,本研究利用荧光定量PCR进一步检测模拟微重力效应对period(per)、timeless(tim)、clock(clk)、cycle(cyc)和cryptochrome(cry)五个核心生物钟相关基因表达的影响,具体方法如下:取新生雄蝇装入试管中,设置处理组(G组)以及对照组(C组),G组置于随机定位仪中暴露处理3 d,C组置于仪器边上;由于CS果蝇为双活动模型的晨昏性昆虫[39],在开灯和熄灯时会出现活动高峰[40],本研究于6∶00 pm即熄灯时进行取样;每管10只雄蝇,放入EP管中,液氮速冻,保存于-80℃冰箱中备用.利用TRIzol法提取待测样品的总RNA,利用超微量紫外分光光度计检测RNA的浓度,根据PrimeScript?RT Master Mix(Perfect Real Time)试剂盒的步骤和反应条件将RNA反转录成cDNA,所得cDNA用超纯水稀释15倍后作为RT-PCR的模板,根据SYBR?Premix Ex Taq?II(Tli RNaseH Plus)的步骤和反应条件进行相对定量检测,RT-PCR的扩增程序中TM值为55℃,40个循环.RT-PCR反应均以rp49作为内参基因,结果采用2-△△Ct方法进行计算分析[41].以上实验重复3次以上.检测所用引物序列见表1.
Table 1 Primer sequences

1.5、 神经递质相关基因表达水平及含量的检测
本研究进一步检测了模拟微重力效应对多巴脱羧酶、酪氨酸羟化酶和色氨酸羟化酶的编码基因ddc、pale和trh的表达情况.其中基因表达水平的检测方法与生物钟基因检测方法一样(详见1.4),检测所用引物序列见表1.
此外,进一步检测模拟微重力效应对多巴胺(dopamine,DA)和5-羟色胺(5-hydroxytryptamine,5-HT)两种神经递质含量的影响,具体方法如下:取新生雄蝇装入试管中,设置处理组(G组)以及对照组(C组),G组置于随机定位仪中暴露处理3 d,C组置于仪器边上.于6∶00 pm即熄灯时进行取样,每管25只雄蝇,放入EP管中,液氮速冻,保存于-80℃冰箱中备用,利用上海酶联的昆虫多巴胺试剂盒以及昆虫5-羟色胺试剂盒测定雄蝇体内DA和5-HT两种神经递质的含量.
1.6 、数据统计及分析
本研究的数据采用Microsoft Excel和SPSS 25软件进行统计分析.组间差异采用独立样本t检验分析.统计结果均用Mean±SEM表示,“*”表示P<0.05,对照组(C组)和处理组(G组)之间的差异达到显着水平;“**”表示P<0.01,对照组(C组)和处理组(G组)之间的差异达到极显着水平.
2 、结果
2.1 、模拟微重力效应对运动及睡眠行为的影响
2.1.1 、短时间模拟微重力效应的影响
选取处理前静置1 d、处理3 d及处理结束后1 d共5 d连续监测的数据进行雄蝇运动情况的统计分析.雄蝇的运动变化规律表明,C组和G组的雄蝇均表现出一定的昼夜变化规律,在6∶00 am和6∶00 pm左右各有一个运动高峰期(图2a),与果蝇自身的昼夜节律以及实验所设置的光照周期相同,主要受光周期变化的影响,但处理期间振幅有所差异.通过分析模拟微重力效应处理3 d时间内雄蝇的运动情况.结果显示:G组雄蝇24 h总运动次数(P<0.01)和单位时间运动次数(P<0.05)均增加;独立分析白天和夜晚的运动情况显示,G组雄蝇白天总运动次数和单位时间运动次数与C组相比虽然略有增加,但均未达显着水平,而夜晚的总运动次数和单位时间运动次数均增加(P<0.01)(图2b、c).模拟微重力效应增强了雄蝇夜晚的运动量和单位时间运动量.
Fig.2 Effects of simulated microgravity on the activity of Drosophila melanogaster

(a)Activity rhythm,grey bars stand for nighttime,green bars stand for the time of simulated microgravity.(b)Activity counts in different periods.(c)Activity counts per minute in different periods.White and black boxes represent data of control and simulated microgravity flies,respectively.*P<0.05,**P<0.01.
进一步分析雄蝇的睡眠情况,结果显示:C组和G组的雄蝇睡眠均表现出一定的昼夜变化规律,在6∶00 am和6∶00 pm左右各有一个睡眠低谷期(图3a),与果蝇的运动变化规律刚好相反,可能主要与外界光周期的变化相关,但在振幅方面表现出了差异.同样分析统计了模拟微重力效应处理3 d时间内雄蝇的睡眠情况,结果显示:G组雄蝇24 h总睡眠时间减少(P<0.01)、睡眠次数减少(P<0.01)、每次睡眠长度增加(P<0.05);独立分析白天和夜晚的睡眠情况显示,G组雄蝇白天睡眠的时间虽然与C组的差异未达显着水平,但其睡眠次数减少(P<0.01)、每次睡眠长度增加(P<0.01),显示雄蝇长时睡眠增多,睡眠质量较高;夜晚睡眠时间减少(P<0.01),睡眠次数减少(P<0.01),但每段睡眠长度与C组的差异未达显着水平(图3b、c、d).结果显示:雄蝇总睡眠时间的减少主要是由于夜晚睡眠次数减少,导致睡眠时间的减少造成的.因此,短时间模拟微重力效应下雄蝇夜晚的睡眠次数减少、睡眠时间缩短、单位时间运动次数增加、运动量增加.
Fig.3 Effects of simulated microgravity on the sleep of Drosophila melanogaster

(a)Sleep rhythm,grey bars stand for nighttime,green bars stand for the time of simulated microgravity.(b)Sleep time in different periods.(c)Sleep episode number in different periods.(d)Length of sleep episode in different periods.White and black boxes represent data of control and simulated microgravity flies,respectively.*P<0.05,**P<0.01
2.1.2、 长时间模拟微重力效应的影响
在短时间模拟微重力效应对雄蝇运动及睡眠的影响研究中,设备关闭后,雄蝇的运动和睡眠行为很快恢复到对照的水平.因此,本研究进一步分析较长时间模拟微重力效应对雄蝇运动及睡眠的影响,分别在处理10 d、20 d及30 d后,随机取部分C组和G组的雄蝇,在对照条件下进行连续3 d的行为监测.雄蝇的运动变化规律表明,不管是处理10 d、20 d还是30 d,C组和G组的雄蝇均表现出一定的昼夜变化规律,在6∶00 am和6∶00 pm左右各有一个运动高峰期(图4a),这与短时间处理一致,主要受光周期的影响.进一步分析雄蝇运动情况显示:处理10 d后虽然雄蝇24 h总运动次数与C组的差异未达显着水平,但是其白天的运动量增加(P<0.05),夜晚单位时间运动次数减少(P<0.05);处理20 d后运动情况与C组的差异未达显着水平;处理30 d后夜晚的运动次数(P<0.05)和单位时间运动次数(P<0.01)均减少,白天的与C组的差异未达显着水平(图4b、c).
Fig.4 Effects of different duration of simulated microgravity on the activity of Drosophila melanogaster

(a)Activity rhythm after experiment,grey bars stand for nighttime.(b)Activity counts in different periods after experiment.(c)Activity counts per minute in different periods after experiment.White and black boxes represent data of control and simulated microgravity flies,respectively.*P<0.05,**P<0.01.
睡眠的分析结果显示:睡眠变化规律同样不受暴露时间的影响,呈现出一定的昼夜变化规律,在6∶00 am和6∶00 pm左右各有一个睡眠低谷期(图5a),与短时间处理一致,主要受光周期的影响.进一步分析睡眠情况,结果显示:处理10 d后雄蝇白天的睡眠时间减少(P<0.05);处理20 d和30 d后各睡眠参数与C组的差异均未达显着水平(图5b、c、d).
2.2 、生物钟相关基因的表达水平
果蝇的睡眠-觉醒状态与生物钟调控密切相关,本研究选取模拟微重力效应暴露处理3 d的雄蝇,进一步检测了核心生物钟基因per、tim、clk、cyc和cry的表达水平,结果显示:per基因的相对表达水平与C组的差异未达显着水平,tim、clk、cyc和cry的相对表达水平均增加(P<0.01),其中clk基因约为C组的2.5倍(图6)[42].
Fig.5 Effects of different duration of simulated microgravity on the sleep of Drosophila melanogaster

(a)Sleep rhythm after experiment,grey bars stand for nighttime.(b)Sleep time in different periods after experiment.(c)Sleep episode number in different periods after experiment.(d)Length of sleep episode in different periods after experiment.White and black boxes represent data of control and simulated microgravity flies,respectively.*P<0.05,**P<0.01.
Fig.6 Effect of simulated microgravity on the relative mRNA level of selected circadian clock genes of Drosophila melanogaster
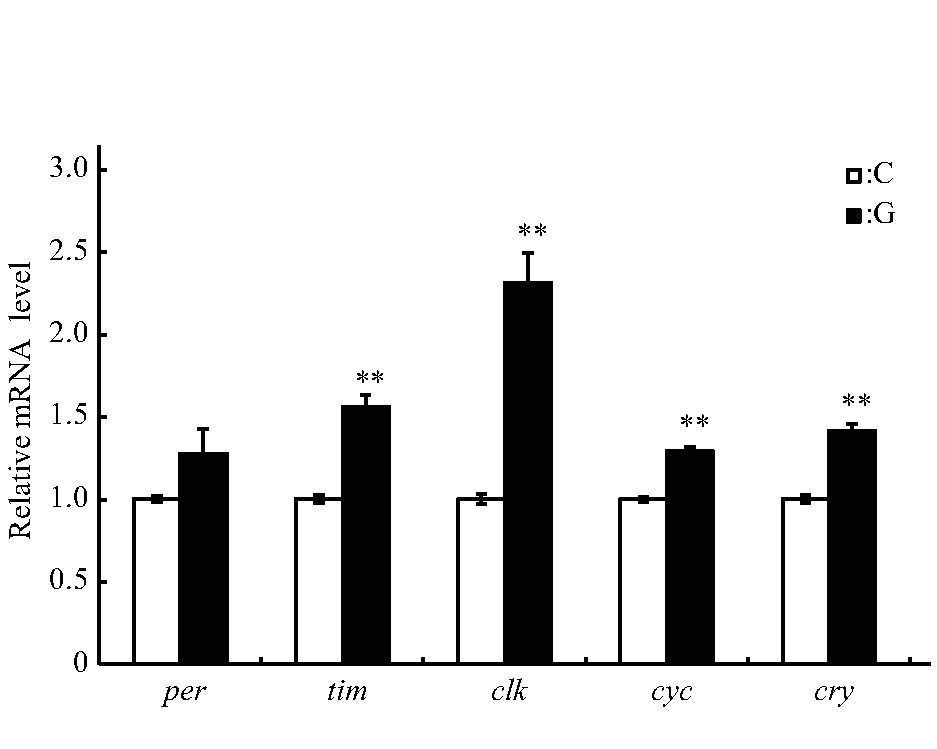
White and black boxes represent data of control and simulated microgravity flies,respectively.*P<0.05,**P<0.01.
2.3、 神经递质相关基因的表达水平及含量
果蝇的睡眠-觉醒状态也受到神经系统的调节,本研究检测模拟微重力效应对DA和5-HT合成中多巴脱羧酶的编码基因ddc、DA合成中酪氨酸羟化酶的编码基因pale和5-HT合成中色氨酸羟化酶的编码基因trh表达水平的影响,结果显示:ddc、pale和trh基因的相对表达水平均增加(分别为P<0.01,P<0.01,P<0.05)(图7a).进一步检测了雄蝇体内DA和5-HT的含量,结果显示模拟微重力效应处理下雄蝇DA和5-HT的含量与C组的差异均未达显着水平(图7b、c).
Fig.7 Effects of simulated microgravity on the selected neurotransmitter of Drosophila melanogaster
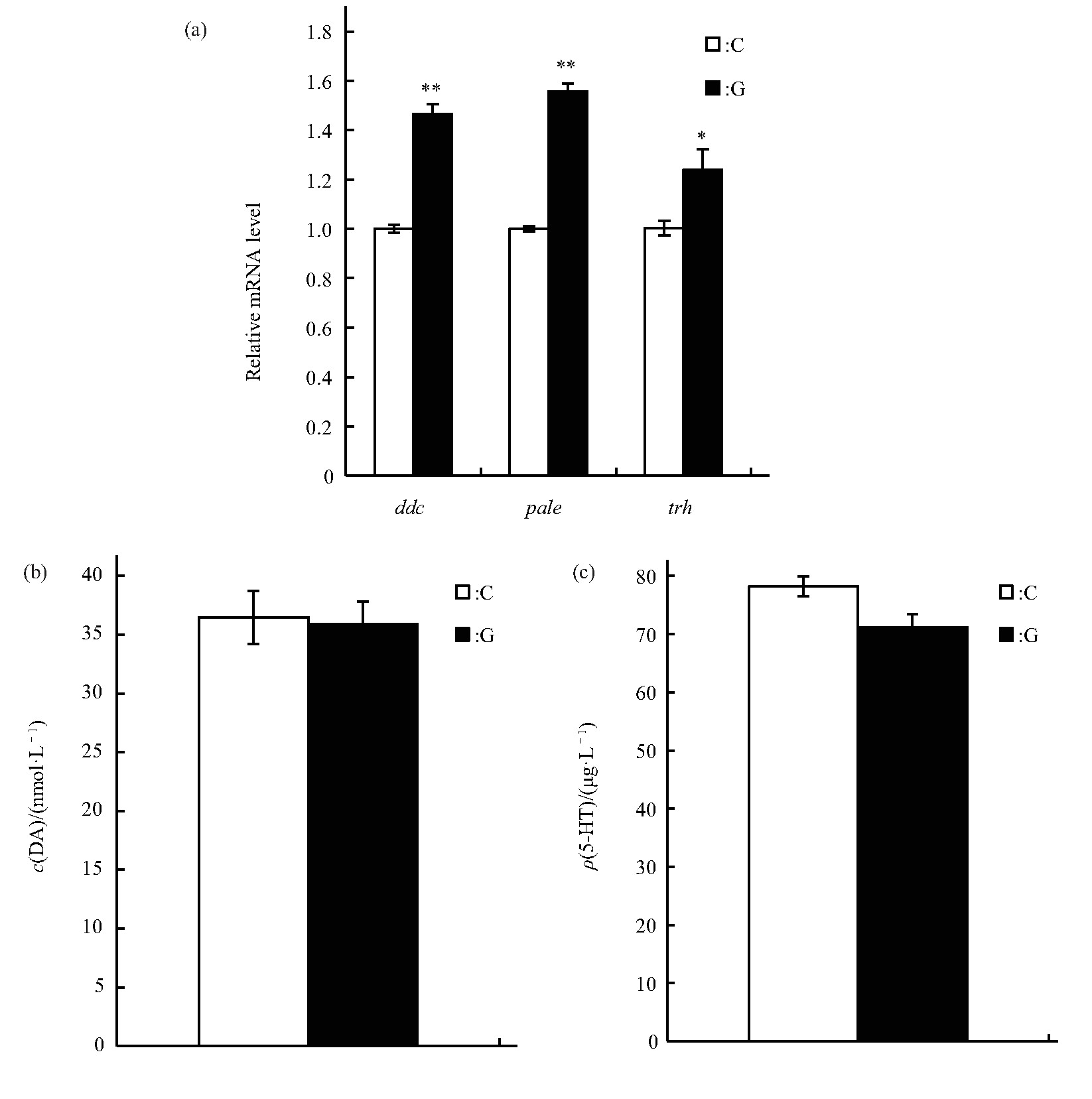
(a)Relative mRNA level.(b)Content of DA.(c)Content of 5-HT.White and black boxes represent data of control and simulated microgravity flies,respectively.*P<0.05,**P<0.01.
3 、讨论
随着我国航天员或航天工程师未来在轨工作时间的延长,如何保障航天员在轨期间的高质量睡眠乃至在轨健康稳态的维护已经成为影响我航天事业长远发展亟待解决的重要关键问题之一.而目前关于空间环境对睡眠的影响及作用机制了解甚少.我们研究了利用自研的随机定位仪开展模拟微重力效应对果蝇睡眠行为研究的可行性,并初步探讨模拟微重力效应对果蝇运动及睡眠的影响.
短时间模拟微重力效应处理结果表明,雄蝇运动和睡眠节律的变化与培养环境中光周期的变化一致.一方面,可能是模拟微重力效应对运动和睡眠节律没有影响;另一方面,考虑到光是强授时因子,模拟微重力效应的影响可能较微弱,以至于在一定程度上其影响会被光周期所掩盖[31].该结果也从侧面说明随机定位仪自身的转动并不会影响果蝇的固有节律.从短时间的模拟微重力效应处理下雄蝇运动和睡眠的分析结果可以看出:模拟微重力效应增强了夜晚雄蝇的运动能力,这主要反映在雄蝇夜晚睡眠时间和睡眠次数的减少;白天平均每段睡眠时长增加,可能与雄蝇夜晚的运动增加且睡眠时间减少而产生的睡眠补偿机制相关[43,44,45,46];白天及夜晚的睡眠次数都减少,可能表明雄蝇在实验处理下更难入睡,尤其是夜晚.Nike-Orion探空火箭上搭载的果蝇在微重力飞行期间,也观察到了其运动测量值大幅增加的情况[32];另外,在IML-2国际太空任务中,微重力暴露期间,果蝇的运动增加[47],在抛物线飞行中也有相似的发现[48],与本研究的结果一致.前述航天员的飞行报告和检测结果[4]也表明,航天员在轨期间睡眠时间减少、睡眠质量变差,这与本研究中雄蝇睡眠时间减少的结果一致.在本研究中,雄蝇睡眠时间的减少主要是睡眠次数减少导致的,且主要影响的是夜晚睡眠.
长时间模拟微重力效应处理结果表明,处理30 d后,雄蝇夜晚的运动减弱,推测与肌肉损伤[49,50,51,52]或者加快衰老[20,47,53]等相关,如IML-2国际太空任务中,在为期14.5 d的航天飞行之后,雄蝇在取下恢复后表现出加速老化反应[47].我们也对模拟微重力效应下雄蝇的寿命进行了研究,并没有发现有显着影响(附录S1中图S2),考虑到空间环境的复杂性,其他因素是否会造成协同作用,使得航天飞机暴露的变化更为明显,还需进一步研究.除此以外,对雄蝇运动和睡眠的总体影响较小,这主要有两方面原因.一方面,随着处理时间的延长,雄蝇出现了适应性,Nike-Orion探空火箭上搭载的果蝇对微重力有瞬态响应的现象,运动水平在微重力的第2 min达到顶峰,之后便略有下降,但其微重力时长只有3.8 min,无法得出长时的影响[32],且有研究表明,在三次抛物线飞行中,年轻果蝇在第一次的0 g阶段运动增加,但后两次该效应减弱[48],而长时间飞行的航天员睡眠情况的调查结果也发现同样的情况,部分航天员在飞行过程中的前30 d睡眠时间显着减少,而后期会有一定的好转[54].另一方面,由于长时间处理后,雄蝇是放置于对照环境中进行监测,因此该结果也与模拟微重力效应解除后雄蝇恢复相关,从短时间的处理中也发现了相似的情况,即设备关闭后,雄蝇的运动和睡眠都恢复到与对照无异.因此,我们认为生物体对微重力有很强的适应能力,且产生的部分危害是可恢复的,从航天员回到地面后的睡眠情况研究也发现类似的情况[4].
为了进一步分析模拟微重力效应影响果蝇睡眠的机制,本研究从果蝇睡眠调控的生物钟和神经递质进行分析.生物钟调控机制在物种间高度保守[55,56,57,58],依赖于转录-翻译的负反馈回路机制,clk和cyc转录翻译后形成的异二聚体蛋白CLK-CYC促进per和tim基因的表达,而per和tim转录翻译后形成异二聚体蛋白PER-TIM反过来抑制CLK-CYC[33,57,59,60,61],且CLK可作为自身的抑制剂[62,63].而这种节律的起始点或相位可以被光照暴露重新设置,功能蛋白为cry编码的CRY,其作为光受体,与TIM发生光依赖性结合,使PER不稳定,从而减少对CLK-CYC的抑制[64].本研究发现,短时间的模拟微重力效应处理后tim、clk、cyc和cry基因的相对表达水平均增加,这说明生物钟能够对模拟微重力效应做出响应.但有报道对在轨飞行后回收的果蝇进行转录组分析,发现核心生物钟(per、tim和cry)并没有明显变化[31],这可能与其实验是在飞行结束48 h后进行的相关,由本研究前述结果可见果蝇有很强的恢复能力,因此微重力对果蝇的影响可能已经恢复.而在神经系统方面,本研究对短时间处理后的神经递质相关编码基因的表达水平,以及神经递质含量进行了测定,选择了神经递质DA和5-HT,DA能够促进觉醒,而5-HT根据受体亚型的不同促进觉醒或睡眠[65,66,67,68].结果表明模拟微重力效应处理后,ddc、pale和trh的相对表达水平均增加,说明模拟微重力效应可能增强了相关神经递质的合成,但是进一步的检测结果却表明DA和5-TH的含量并没有出现变化,这可能与本研究检测方式相关.本研究检测了雄蝇整体的DA和5-TH含量,而对睡眠调控主要是脑部分泌至细胞外的神经递质,而生物体总的神经递质含量则相对稳定.同时,神经系统的调节并非是靠单一的神经递质或激素,而是整个神经系统复杂的共同作用[65].
虽然随机定位仪并不能提供真正的微重力环境,但从果蝇运动和睡眠节律及相关参数的变化情况,我们认为利用随机定位仪模拟微重力效应暴露处理下,在静置阶段,果蝇处理组和对照组的运动曲线和睡眠曲线高度重合,而在微重力效应模拟阶段,果蝇仍然表现出其固有的节律行为.通过肉眼观察也发现在设备转动过程中,果蝇活动自如,并无诸如甩动、翻转、飞行等行为出现(附录S1中图S1).同时,我们也对雄蝇氧化应激相关酶活性和基因进行了检测,也未发现有显着影响(附录S1中图S4、S5).本研究发现,模拟微重力效应下,短时间内雄蝇夜晚的运动能力增强且睡眠减少,但白天会出现睡眠补偿,而随着模拟微重力效应的解除或延长,这些影响都能得到恢复,这些与果蝇生物钟和神经递质的调控相关,但相关机制待进一步研究.
因此,本研究认为利用模拟微重力效应研究微重力对果蝇运动及睡眠的影响具有一定的可行性,相关研究结果能够为航天医学研究,尤其是航天环境对航天员睡眠的影响研究提供一定的参考依据需要注意的是,利用随机定位仪模拟微重力效应确实存在一定的不足,特别是在行为研究方面应用极少,我们希望做一些尝试性研究,同时也在积极探索更好的方法,并努力开展一些在轨的测试,通过天-地对比实验的检验,能够更好地验证地基实验的相关结果,为评价该方法的可行性和科学性提供更多的参考依据.
参考文献
[1] Itani O, Jike M, Watanabe N, et al. Short sleep duration and health outcomes:a systematic review, meta-analysis, and metaregression. Sleep Med, 2017, 32:246-256
[2] Afolalu E F, Ramlee F, Tang N K Y. Effects of sleep changes on pain-related health outcomes in the general population:a systematic review of longitudinal studies with exploratory metaanalysis. Sleep Med Rev, 2018, 39:82-97
[3] Khan S, Duan P F, Yao L G, et al. Shiftwork-mediated disruptions of circadian rhythms and sleep homeostasis cause serious health problems. Int J Genomics, 2018,2018:8576890
[4] Barger L K, Flynn-Evans E E, Kubey A, et al. Prevalence of sleep deficiency and use of hypnotic drugs in astronauts before, during,and after spaceflight:an observational study. Lancet Neurology,2014, 13(9):904-912
[5]景晓路,刘学勇,秦海波,等.载人航天睡眠问题及其干预措施.空军医学杂志,2014,30(01):57-60Jing X L, Liu X Y, Qing H B, et al. Medical Journal of Air Force,2014, 30(01):57-60
[6] Brainard G C, Barger L K, Soler R R, et al. The development of lighting countermeasures for sleep disruption and circadian misalignment during spaceflight. Curr Opin Pulm Med, 2016,22(6):535-544
[7] Caddick Z A, Gregory K, Flynn-Evans E E. Sleep environment recommendations for future spaceflight vehicles[M]//STANTON N A, LANDRY S, DIBUCCHIANICO G, et al. Advances in Human Aspects of Transportation. Cham; Springer International PublishingAg. 2017:923-933
[8]江一帆,乔兵,赵颖.航天员低重力运动模拟训练方法与研究综述.载人航天,2018,24(02):227-237Jiang Y F, Qiao B, Zhao Y. Manned Spaceflight, 2018, 24(02):227-237
[9] Frey D J, Ortega J D, Wiseman C, et al. Influence of zolpidem and sleep inertia on balance and cognition during nighttime awakening:a randomized placebo-controlled trial. J Am Geriatr Soc, 2011, 59(1):73-81
[10] Hoque R, Chesson A L, Jr. Zolpidem-induced sleepwalking, sleep related eating disorder, and sleep-driving:fluorine-18-flourodeoxyglucose positron emission tomograph analysis, and a literature review of other unexpected clinical effects zolpidem.Journal of Clinical Sleep Medicine, 2009, 5(5):471-476
[11] Van Oosterhout W P J, Terwindt G M, Vein A A, et al. Space headache on Earth:head-down-tilted bed rest studies simulating outer-space microgravity. Cephalalgia, 2015, 35(4):335-343
[12] Watenpaugh D E. Analogs of microgravity:head-down tilt and water immersion. Journal of Applied Physiology, 2016, 120(8):904-914
[13] Wang C Y, Wu J H, Cui Y, et al. Simulated weightlessness by tailsuspension affects follicle development and reproductive capacity in rats. Int J Clin Exp Pathol, 2016, 9(12):12208-12218
[14] Sung M, Li J, Spieker A J, et al. Spaceflight and hind limb unloading induce similar changes in electrical impedance characteristics of mouse gastrocnemius muscle. J Musculoskelet Neuronal Interact, 2013, 13(4):405-411
[15] Van Loon J J W A. Some history and use of the random positioning machine, RPM, in gravity related research. Advances in Space Research, 2007, 39(7):1161-1165
[16] BorstAG, Van Loon J J WA. Technology and developments for the random positioning machine, RPM. Microgravity Science and Technology, 2008, 21(4):287-292
[17] Wuest S L, Richard S, Kopp S, et al. Simulated microgravity:critical review on the use of random positioning machines for mammalian cell culture. Biomed Research International, 2015,2015:971474
[18] Brungs S, Egli M, Wuest S L, et al. Facilities for simulation of microgravity in the ESA ground-based facility programme.Microgravity Science and Technology, 2016, 28(3):191-203
[19]武芸.不同重力对果蝇胚后发育速度及相关基因的影响[D].大连:大连海事大学,2012Wu Y. The Effects of Drosophila Development Rate After Embryo and Related Genes by Different Gravities[D]. Dalian:Dalian Maritime University, 2012
[20]翁宜敬.模拟微重力效应对果蝇发育及相关基因的影响[D].大连:大连海事大学,2010Weng Y J. Simulated Microgravity Effects on Drosophila Development and Related Genes[D]. Dalian:Dalian Maritime University, 2010
[21]蒋远大,李维宁,王鲁峰,等.几种新型回转器.航天医学与医学工程,2008,4:368-371Jiang Y D, Li W N, Wang L F, et al. Space Medicine&Medical Engineering, 2008, 4:368-371
[22]梁小弟,刘志臻,陈现云,等.生命中不能承受之轻——微重力条件下生物昼夜节律的变化研究.生命科学, 2015, 27(11):1433-1440Liang X D, Liu Z Z, Chen X Y, et al. Chinese Bulletin of Life Sciences, 2015, 27(11):1433-1440
[23] Schwarzenberg M, Pippia P, Meloni M A, et al. Signal transduction in T lymphocytes-A comparison of the data from space, the free fall machine and the random positioning machine[M]//HASENSTEIN K H, SATO A, COGOLI A, et al. Life Sciences:Microgravity Research Ii. 1999:793-800
[24] Briegleb W. Some qualitative and quantitative aspects of the fastrotating clinostat as a research tool. ASGSB bulletin:publication of the American Society for Gravitational and Space Biology,1992, 5(2):23-30
[25] Hoson T, Kamisaka S, Masuda Y, et al. Evaluation of the threedimensional clinostat as a simulator of weightlessness. Planta,1997, 203 Suppl:S187-S197
[26]龙勉.如何在地球表面模拟空间微重力环境或效应:从空间细胞生长对微重力响应谈起.科学通报,2014,59(20):2004-2015Long M. Chin Sci Bull(Chin Ver), 2014, 59(20):2004-2015
[27] Herranz R, Benguria A, Lavan D A, et al. Spaceflight-related suboptimal conditions can accentuate the altered gravity response of Drosophila transcriptome. Mol Ecol, 2010, 19(19):4255-4264
[28] Herranz R, Lavan D A, Medina F, et al. Drosophila GENE experiment in the Spanish soyuz mission to the ISS:II. Effects of the containment constraints. Microgravity Science and Technology, 2009, 21(4):299-304
[29] Marcu O, Lera M P, Sanchez M E, et al. Innate immune responses of Drosophila melanogaster are altered by spaceflight. Plos One,2011, 6(1):e15361
[30] Taylor K, Kleinhesselink K, George M D, et al. Toll mediated infection response is altered by gravity and spaceflight in Drosophila. Plos One, 2014, 9(1):e86485
[31] Ma L L, Ma J, Xu K Y. Effect of spaceflight on the circadian rhythm, lifespan and gene expression of Drosophila melanogaster.Plos One, 2015, 10(3):e0121600
[32] Miller M S, Keller T S. Drosophila melanogaster(fruit fly)locomotion during a sounding rocket flight. Acta Astronautica,2008, 62(10-11):605-616
[33] Vosshall L B, Price J L, Sehgal A, et al. Block in nuclearlocalization of period of protein by a 2nd clock mutation, timeless.Science, 1994, 263(5153):1606-1609
[34] Smith R F, Konopka R J. Effects of dosage alterations at the per locus on the period of the circadian clock of Drosophila. Molecular&General Genetics, 1982, 185(1):30-36
[35]刘思琦.基于果蝇模式生物的睡眠与基因相关性的研究[D];黑龙江中医药大学,2014Liu S Q. Research of sleep and genetic correlation based on drosophila's biological model; Heilongjiang University Of Chinese Medicine, 2014
[36]李禹正,张婷,王晓民.生物钟的秘密——2017年诺贝尔生理学或医学奖简介.首都医科大学学报,2017,38(05):765-769Li Y Z, Zhang T, Wang X M. Journal of Capital Medical University, 2017, 38(05):765-769
[37] Guo F, Holla M, Diaz M M, et al. A circadian output circuit controls sleep-wake arousal in Drosophila. Neuron, 2018, 100(3):624-635
[38] Harbison S T, Kumar S, Huang W, et al. Genome-wide association study of circadian behavior in Drosophila melanogaster. Behav Genet, 2019, 49(1):60-82
[39]秦玉川.昆虫行为学导论[M]. 1 ed.北京:科学出版社, 2009Qing Y C. Introduction to insect behavior. Beijing:Science Press,2009
[40] Dubowy C, Sehgal A. Circadian rhythms and sleep in Drosophila melanogaster. Genetics, 2017, 205(4):1373-1397
[41] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C)method. Methods, 2001, 25(4):402-408
[42] Zhang H, Liao Y, Zhang Z, et al. Effect of simulated microgravity on the circadian rhythm of Drosophila melanogaster. New Biotechnology, 2018, 44(Suppl):S83
[43] Hendricks J C, Finn S M, Panckeri K A, et al. Rest in Drosophila is a sleep-like state. Neuron, 2000, 25(1):129-138
[44] Huber R, Hill S L, Holladay C, et al. Sleep homeostasis in Drosophila melanogaster. Sleep, 2004, 27(4):628-639
[45] Sitaraman D, Aso Y, Jin X, et al. Propagation of homeostatic sleep signals by segregated synaptic microcircuits of the Drosophila mushroom body. Curr Biol, 2015, 25(22):2915-2927
[46] Akerstedt T, Kecklund G, Ingre M, et al. Sleep homeostasis during repeated sleep restriction and recovery:support from EEG dynamics. Sleep, 2009, 32(2):217-222
[47] Benguria A, Grande E, Dejuan E, et al. Microgravity effects on Drosophila melanogaster behavior and aging. Implications of the IML-2 experiment. Journal of Biotechnology, 1996, 47(2-3):191-201
[48] Lebourg E, Grimal A, Fresquet N, et al. Spontaneous locomotoractivity of Drosophila melanogaster flies at various gravity levels(0 G, 1 G, 1.8 G)during parabolic flights. Behavioural Processes,1995, 34(2):175-184
[49] Guo N, Fan X Y, Wu Y T, et al. Effect of constraint loading on the lower limb muscle forces in weightless treadmill exercise. J Healthc Eng, 2018, 2018:8487308
[50] Nikawa T, Ishidoh K, Hirasaka K, et al. Skeletal muscle gene expression in space-flown rats. Faseb J, 2004, 18(3):522-524
[51]韩忠宇,贾懿劼,田京.失重状态造成肌萎缩的研究与进展.中国组织工程研究,2013,17(28):5249-5254Han Z Y, Jia Y J, Tian J. Chinese Journal of Tissue Engineering Research, 2013, 17(28):5249-5254
[52]孙永彦,张紫燕,黄晓梅,等.微重力环境人体健康效应研究进展.军事医学,2018,42(04):317-321Sun Y Y, Zhang Z Y, Huang X M, et al. Mil Med Sci, 2018, 42(04):317-321
[53] Vernikos J, Schneider V S. Space, gravity and the physiology of aging:parallel or convergent disciplines? A mini-review.Gerontology, 2010, 56(2):157-166
[54] Gundel A, Drescher J, Polyakov V V J H F, et al. Quantity and quality of sleep during the record manned space flight of 438 days.Human Factors andAerospace Safety, 2001, 1(1):87-98
[55] Hardin P E. Transcription regulation within the circadian clock:the E-box and beyond. J Biol Rhythms, 2004, 19(5):348-360
[56] Hardin P E. Molecular Genetic analysis of circadian timekeeping in Drosophila[M]//BRODY S. Genetics of Circadian Rhythms.San Diego; ElsevierAcademic Press Inc. 2011:141-173
[57] Allada R. Circadian clocks:a tale of two feedback loops. Cell,2003, 112(3):284-286
[58] Brown S A, Kowalska E, Dalmann R.(Re)inventing the circadian feedback loop. Developmental Cell, 2012, 22(3):477-487
[59] Hardin P E, Hall J C, Rosbash M. Feedback of the Drosophila period gene-product on circadian cycling of its messenger-RNA levels. Nature, 1990, 343(6258):536-540
[60]杨丽婷,刘森.生物钟翻译后核心振荡机制.生命的化学,2016, 36(03):390-396Yang LT, Liu S. Chemistry of Life, 2016, 36(03):390-396
[61]李经才,于多,王芳,等.生物钟基因研究新进展.遗传, 2004,26(01):89-96Li J C, Yu D, Wang F, et al. Hereditas(Beijing), 2004, 26(01):89-96
[62]俞强.生物钟:基因和环境决定的行为——2017年诺贝尔生理学或医学奖简介.自然杂志,2017,39(06):411-416Yu Q. Chinese Journal of Nature, 2017, 39(06):411-416
[63] Darlington T K, Wager-Smith K, Ceriani M F, et al. Closing the circadian loop:CLOCK-induced transcription of its own inhibitors per and tim. Science, 1998, 280(5369):1599-1603
[64] Myers M P, Wagersmith K, Rothenfluhhilfiker A, et al. Lightinduced degradation of TIMELESS and entrainment of the Drosophila circadian clock. Science, 1996, 271(5256):1736-1740
[65] Holst S C, Landolt H-P. Sleep-wake neurochemistry. Sleep Medicine Clinics, 2018, 13(2):137-146
[66]杨岑,冉明梓,欧阳鹏荣,等.五羟色胺在睡眠-觉醒中作用.现代生物医学进展,2015,15(11):2191-2194Yang C, Ran M Z, Ouyang P R, et al. Progress in Modern Biomedicine, 2015, 15(11):2191-2194
[67] Monti J M, Jantos H. The role of serotonin 5-HT7 receptor in regulating sleep and wakefulness. Rev Neurosci, 2014, 25(3):429-437
[68] Qian Y, Cao Y, Deng B, et al. Sleep homeostasis regulated by5HT2b receptor in a small subset of neurons in the dorsal fanshaped body of drosophila. Elife, 2017, 6:e26519





