摘要背景:间充质干细胞移植在慢性伤口治疗领域中已被证明是一项有前景的新疗法。在增强其应用疗效方面,关于间充质干细胞不同输送途径及优劣比较的研究鲜见报道,优化输送途径对于提高间充质干细胞在创面修复中的应用效果尤为重要。
目的:探讨间充质干细胞促进创面修复的相关机制,并就不同移植方式在慢性创面修复中的应用效果展开综述。
方法:由第一作者检索中国知网、万方及PubMed数据库中收录的相关文献,中文检索词为“间充质干细胞、机制、移植、途径、慢性创面、伤口、再生、组织工程、皮肤、溃疡”,英文检索词为“stem cell/stromal cells/progenitor cell/mesenchymal stem cells,mechanism/therapeutic application,transplantation route/delivery/engraftment/injection/infusion/drug administration routes,wound healing/chronicwound/regeneration/tissue engineering/tissue repair/skin ulcer”。文献检索时间限定在2000年1月至2021年7月,通过阅读文章摘要对文献进行初步筛选,排除与文章主题不相关的文献,纳入的文献数为85篇。
结果与结论:①旁分泌功能是间充质干细胞发挥创面修复作用的主要机制,间充质干细胞通过分泌可溶性因子和释放胞外囊泡促进血管生成,减轻局部炎症反应,调节细胞外基质重塑,重建利于组织修复的再生微环境。②综合来看,生物材料支架是目前间充质干细胞给药途径中最有前景的移植方式之一,与传统全身给药(动脉、静脉给药)和传统局部给药(如皮下、肌内注射)相比,优良的可塑性、生物活性、生物降解性和生物相容性是其占据优势的4个关键特性,以生物材料支架为代表的新型给药方式一定程度上克服了传统给药途径的安全性差、效率低等诸多问题,提高了间充质干细胞在慢性伤口中的应用效果,有待进一步开发其优势。③间充质干细胞移植途径的选择一定程度上取决于其治疗目的及应用何种作用机制。④关于间充质干细胞的作用机制与给药途径的关系,以间充质干细胞向受损组织归巢为例,当移植方式为局部给药(如肌内注射),除了受损组织内间充质干细胞的基本间质迁移外,间充质干细胞则不需要必须向受损组织归巢和迁移;假如间充质干细胞的输送是全身性的(如如动脉和静脉途径注射),间充质干细胞的归巢机制是达到其修复目标所必需的。因此,为提高应用质量,应将给药途径与间充质干细胞参与创面修复的相关机制综合考虑。
关键词:间充质干细胞;慢性创面;皮肤;机制;输注途径;移植;组织工程;再生医学
慢性伤口是指皮肤组织长达 6-8 周以上未能正常愈合,且无法通过正常、有序、及时的修复过程以达到解剖和功能上完整状态的伤口[1]。按照发病原因分类,慢性伤口通常分为血管性溃疡 ( 静脉或动脉溃疡 )、糖尿病溃疡和压力性溃疡,其中年龄、免疫状况、营养不良、疾病和药物等是导致慢性伤口形成的主要危险因素。有研究表明,与正常愈合的伤口相比,慢性伤口表现出促炎细胞因子、蛋白酶和活性氧等水平的增加,细胞衰老速度加快及干细胞数量减少[2]。有数据显示,中国每年需要行创面治疗的患者约 1 亿人次,严重患者约 3 000 万人次,未来随着中国人口老龄化趋势加快,与之相关的慢性难愈性创面的发生率还会进一步增加[3]。与此同时,慢性伤口的发生也给医疗保健系统和患者带来了沉重的财政负担,仅在美国每年治疗难愈性伤口方面的费用就接近 300亿美元[4]。创面损伤种类多而复杂,人们对创面治疗的质量要求也越来越高,因此如何快速、安全、完美修复慢性创面是临床亟待解决的问题。
目前临床上已有多种治疗创面损伤的方法,如传统药物治疗、负压封闭引流、生物敷料和自体皮瓣移植技术等,传统的创面治疗方法已不能完全满足临床治疗和患者自身的需要;传统的慢性伤口护理方案通常是针对感染或坏死组织行清创术,随后应用伤口敷料和局部药剂来保护伤口免受感染并加速愈合,目前伤口护理有限的治疗方案很少能有效地逆转慢性伤口的演变,慢性伤口护理只取得了中等程度的成功;对于老年人群,其皮肤中的胶原蛋白总量和表皮更新速度在随年龄递减,加之老年患者常因为不能忍受外科干预治疗,因此其伤口治疗选择也越来越有限。面临慢性伤口风险的患者群体正在迅速增长,迫切需要开发更有效的伤口护理策略。
同传统治疗方法相比,干细胞治疗创面损伤被认为是一种有前途的新疗法。间充质干细胞作为一类具有高度自我更新、多向分化潜能和低免疫原性的多能干细胞,广泛存在于骨髓、脂肪、胎盘、脐带、脐血、羊膜和牙髓等多种组织中[5-6]。间充质干细胞在不同诱导条件下可以定向分化为骨细胞、脂肪细胞和肌肉细胞等[7],其分化不仅局限于中胚层,还可跨胚层分化为外胚层的神经元、神经胶质细胞和内胚层的肝细胞等细胞类型,具有良好的可塑性。间充质干细胞已被证明通过多种机制促进皮肤伤口愈合,其中旁分泌特性、免疫调节功能、迁移与归巢和定向分化能力是其发挥治疗效果的主要机制。间充质干细胞通过刺激血管生成,调节细胞外基质重塑,减轻局部炎症反应,再生皮肤结构和恢复功能,提高伤口愈合率。
研究表明,优化靶向给药途径能够改善移植的效果,延长有效治疗时间,减少治疗剂量[8]。然而确定最佳间充质干细胞输送方式仍是再生医学的一大难题。目前有研究探讨间充质干细胞递送方式的应用及特点,但不同领域干细胞给药途径差异很大,例如在心血管系统领域,经静脉、冠状动脉、直接心肌内注射及使用导管经心内膜注射等给药途径已被广泛应用[9];在脑血管系统领域,GAO 等[10]探讨了干细胞经血管、脑室、鼻内、蛛网膜下腔和腹腔内等给药途径在脑出血患者中的应用及疗效;在皮肤组织工程领域,中国谢江帆等[11]重点探讨了局部给药途径 ( 局部注射及局部喷雾等 ) 在慢性伤口中的应用进展;国外 LEE 等[12]综述了部分局部给药的特点及增加间充质干细胞的输送或存活的替代方法等,但目前间充质干细胞在慢性创面中的输送途径及其优缺点比较仍缺乏系统阐述。不同给药途径常引起治疗效果和安全性等差异,了解间充质干细胞促进创面修复的机制有利于更科学地选择给药途径。
因此在阅读国内外大量研究结果基础上,该文探讨间充质干细胞促进创面修复的可能机制,并就不同给药途径 ( 全身给药途径、局部给药途径及新型给药途径 ) 及其优缺点进行比较,为后续提高干细胞应用方式的科学性和安全性,改善伤口愈合质量提供参考依据。
1、资料和方法 Data and methods
1.1、资料来源
1.1.1、检索人及检索时间 由第一作者在 2020 年 12 月进行检索。
1.1.2、检索文献时限 检索时间限定为 2000 年 1 月至 2021 年 7月。
1.1.3、检索数据库 分别检索中国知网、万方等中文数据库以及PubMed 数据库。
1.1.4、检索词 以“间充质干细胞、机制、移植、途径、慢性创面 / 伤口 / 再生 / 组织工程 / 皮肤 / 溃疡”为中文检索词,以“stem cell/stromal cells/progenitor cell/mesenchymal stem cells,mechanism/therapeutic application,transplantation route/delivery/engraftment/injection/infusion/drug administration routes,woundhealing/chronic wound/regeneration/tissue engineering/tissue repair/skin ulcer”为英文检索词进行检索。
1.1.5、检索文献类型 包括研究原着、综述及病例报告。
1.1.6、检索策略 以 PubMed 数据库为例,检索策略详见图 1。
此外,文章还通过手动检索上述检索策略未纳入、但其内容与文章主题契合的文献和书籍。

图 1 | PubMed 数据库检索策略图
1.1.7、检索文献量 文章分 2 部分检索,即:①间充质干细胞促进慢性创面修复机制的中文初检文献量 1 051 篇,最后纳入中文文献2篇;英文初检文献量约22 243篇,最后纳入文献量为45篇;②间充质干细胞修复创面移植途径的中文初检文献量 3 980 篇,最后纳入文献量 1 篇;英文初检文献量 15 059 篇,最后纳入文献量为 40 篇。文献检索流程见图 2。
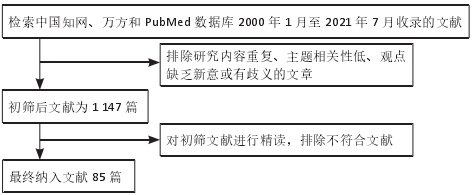
图 2 |文献检索流程
1.2、入组标准
1.2.1、纳入标准 ①内容与检索词、写作主题相近的文章;②论点、论据真实可靠的文章。
1.2.2、排除标准 ①研究内容与主题相关性低或不相关的文章;②研究内容重复、观点缺乏新意或有歧义的文章。
1.3、文献质量评估和数据提取 由第一作者广泛阅读文章标题和摘要,结合文章纳入与排除标准筛选,进行初步筛选,对初步筛选出的文章的内容、研究方法与结果结论进行精读,最终纳入文献 85 篇进行分析探讨。
2、结果 Results
2.1、间充质干细胞促进创面修复的主要机制。
慢性伤口愈合涉及细胞迁移、增殖、细胞外基质沉积和组织重塑等复杂生物分子的良好整合[13]。间充质干细胞作为再生医学中细胞治疗的重要来源,其在创面治疗中已有悠久历史,已被广泛应用于组织修复等再生医学领域,详细了解间充质干细胞修复创面的历史演变与进展有助于继续探索间充质干细胞的治疗潜力,间充质干细胞在创面治疗中的部分研究脉络[14-21],见表 1。
表 1 |间充质干细胞促进创面修复的部分研究脉络

间充质干细胞主要通过直接或间接方式促进创面组织愈合,包括靶向迁移并归巢到受损组织、分泌慢性伤口愈合所需的重要细胞因子 ( 如表皮生长因子、肝细胞生长因子和血管内皮生长因子 α 等 )、直接分化为皮肤结构 ( 如上皮细胞和皮肤附件结构 )。另外,间充质干细胞发挥作用的重要原因在于其能抑制慢性伤口的炎症持续状态,优化伤口床,这是伤口愈合的重要前提。通过一种或多种机制的协同作用,削弱慢性伤口相关诱发和持续因素,促进皮肤再生与修复。目前国内外关于间充质干细胞在慢性伤口中的作用机制各有不同,见图 3。
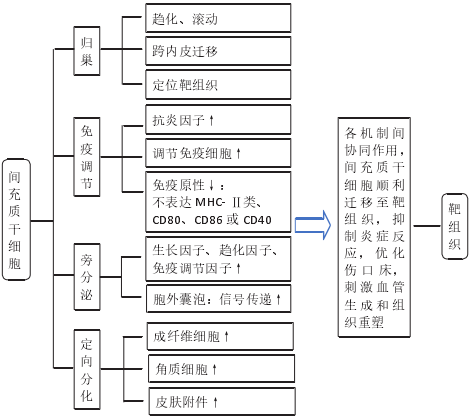
图 3 |间充质干细胞修复慢性创面的机制
2.1.1、间充质干细胞的归巢能力与创面修复 间充质干细胞经全身给药后,能否成功归巢至靶组织是实现其治疗效果的关键因素。干细胞归巢是指体内循环干细胞或外源性干细胞定位并进入特定环境生态位的能力[22],作为一个多步骤的生理环节,其迁移过程主要包括滚动、趋化、跨内皮迁移以及定植入靶组织。
目前间充质干细胞的归巢能力已经在伤口愈合中得到证明,其趋化性的实现主要通过间充质干细胞上表达的趋化因子受体和受损组织分泌的趋化因子相互介导,间充质干细胞向炎症微环境的迁移主要依赖于促炎刺激诱导的趋化因子 12 与在间充质干细胞表面表达的相应受体 4 的相互作用[23]。间充质干细胞拥有一个或多个功能性 p- 选择素配体,在迁移的下一阶段,间充质干细胞以 P- 选择素依赖的方式与内皮细胞相互作用,从而促进间充质干细胞募集[24]。然而间充质干细胞与内皮细胞的结合需要黏附分子,间充质干细胞的不同表面蛋白 ( 如来自整合素家族的血管细胞黏附分子 1) 是跨内皮迁移阶段所必需的。迁移的最后阶段,当间充质干细胞锚定在内皮细胞上时,它们通过表达蛋白水解酶(如基质金属蛋白酶)穿过基底膜并进入靶组织[25]。
间充质干细胞归巢机制受到其他多种因素调控。有研究表明,局部和全身炎症信号影响间充质干细胞归巢至损伤部位[26]。
组织损伤和炎症过程中释放的炎性细胞因子如肿瘤坏死因子α、白细胞介素 1 和干扰素 γ 等诱导细胞表面表达黏附分子,介导间充质干细胞向细胞外基质滚动和迁移[23],通过这些信号间的协同作用,将间充质干细胞导向损伤部位。这说明间充质干细胞的动员及其随后向损伤组织的归巢可能取决于全身和局部的炎症状态。另外有研究提到生长因子、骨桥蛋白也在间充质干细胞的迁移中起着重要作用[27]。有研究者在动物实验中验证了间充质干细胞在伤口中的归巢能力,SASAKI 等[28]在小鼠皮内注射趋化因子 (SLC/CCL21),证实了该趋化因子可以将循环的间充质干细胞募集到伤口部位,进而促进血管生成参与伤口修复。
LIAO 等[29]在动物伤口模型中经皮内注射间充质干细胞可使施用的细胞归巢至伤口,显着提高伤口愈合的速度和质量。综上,归巢机制能使间充质干细胞靶向迁移至炎症损伤部位,在间充质干细胞促进慢性创面修复过程中发挥重要作用,需进一步考虑影响间充质干细胞归巢的因素,提高归巢能力。
2.1.2、间充质干细胞的免疫调节与创面修复 炎症是机体对有害刺激的自我防御机制,适度的炎症反应有利于伤口愈合。然而在慢性伤口中,炎症反应常是过度、失调的,这常导致皮肤瘢痕形成及抑制创面再上皮化,降低伤口愈合质量[30]。间充质干细胞具有强大的免疫调节特性,但其免疫特性并非先天固有,炎症微环境是诱导其启动免疫功能的先决条件,炎症部位中的特定促炎因子如干扰素 γ 可激活间充质干细 胞[31],激活后的间充质干细胞通过分泌抗炎因子 ( 如吲哚胺 2,3- 双加氧酶、一氧化氮及白细胞介素 10) 实现其免疫调节功能,减轻组织炎症反应,促进间充质干细胞和其他常驻细胞功能再生,参与重建组织微环境[32]。
间充质干细胞表达中度水平的组织相容性复合体 MHC- Ⅰ类,但不表达 MHC- Ⅱ类或参与体液及细胞介导免疫反应的共刺激分子 CD80,CD86 或 CD40,这使间充质干细胞具有低免疫原性的特点[33],在自体和异体移植治疗方面成为最有吸引力的候选种子细胞之一。间充质干细胞和免疫细胞之间的直接接触也是其发挥免疫调节的重要原因,间充质干细胞分泌的可溶性因子可抑制宿主先天和适应性免疫细胞 (B 细胞、T 细胞、自然杀伤细胞、树突状细胞和 M1 型巨噬细胞 ) 的激活、成熟和增殖[34]。在炎症条件下,间充质干细胞还可以影响树突状细胞、幼稚 T 细胞和效应T 细胞以及自然杀伤细胞的细胞因子分泌模式,从而诱导更抗炎或耐受性的细胞表型[35]。当然,间充质干细胞发挥免疫调节的过程是动态平衡的,有研究发现,间充质干细胞可通过不同的受体(如Toll 样受体 ) 识别危险信号[36],间充质干细胞根据炎症信号类型或强度分泌细胞因子以促进或抑制免疫应答,维持免疫平衡,这说明间充质干细胞可在特定条件下向促炎和抗炎表型之间转换。
由此可见间充质干细胞与免疫抑制因子和免疫细胞之间相互作用对伤口愈合至关重要。对于特殊老年人群,随着年龄的增加和身体功能的下降,其伤口与正常人慢性伤口相比更容易迁延不愈。
有研究发现,老年患者的慢性伤口即使没有感染,炎症细胞因子水平也比年轻人群高约 4 倍,而间充质干细胞在老年人伤口愈合的炎症期可抑制 T 细胞、肿瘤坏死因子 α、干扰素 γ 的增殖,调节细胞因子的分泌,抑制过度炎症反应[37]。有研究在临床前动物皮肤损伤模型和临床烧伤患者中证实了间充质干细胞在创面修复中的免疫调节作用[38-39]。总而言之,间充质干细胞主要通过分泌特定因子来影响先天和适应性免疫系统,加之与免疫细胞直接接触这两者协同作用实现其免疫调节功能。
2.1.3、间充质干细胞旁分泌特性与创面修复 早期研究将间充质干细胞的治疗效果归因于其移植和分化能力。然而,有研究发现移植的间充质干细胞与宿主损伤部位的现有细胞混合比例很小,而且植入时间太短,在全身给药后仅不足 1% 的间充质干细胞存活超过 1 周[40],这表明间充质干细胞的治疗潜力并非是细胞本身发挥作用,可能是由其旁分泌机制介导[41]。后续研究证实了间充质干细胞的旁分泌作用是其发挥创面修复和再生功能的主要机制,其旁分泌功能是通过分泌可溶性因子和释放胞外囊泡 ( 如外泌体和微泡 ) 来实现的。间充质干细胞能够分泌多种自分泌和旁分泌因子,包括细胞因子、趋化因子、生长因子细胞外基质蛋白,以上这些是无细胞治疗的主要来源[42]。该类因子能促进受损组织血管生成,减少细胞凋亡和降低组织纤维化程度,增强神经元存活和分化,刺激细胞外基质重塑,减轻局部炎症,加速组织修复[43],具有血管生成、营养、神经调节、免疫调节和抗炎活性。慢性伤口由于长期迁延不愈,损伤部位缺乏功能性血管网络,细胞代谢废物清除不良,受损组织常伴随缺氧以及炎性浸润。
新生血管的形成是组织修复的关键步骤,体内的缺氧诱导因子 1α 被认为是间充质干细胞在缺氧条件下增强血管调节功能的主调节因子[44],该因子通过诱导血管内皮细胞生长因子促进血管生成[45]。还有研究发现当间充质干细胞在高浓度炎症细胞因子的条件下培养并被移植到炎症微环境中时,间充质干细胞开始产生抗血管生成分子,以阻止炎症组织中循环白细胞的迁移[41]。目前已知的细胞外囊泡主要包括凋亡小体、微泡和外泌体[46],它们是许多过程 ( 如免疫反应、血管生成、增殖和分化 )中细胞间通讯的重要介质之一。
间充质干细胞分泌的囊泡将其内容物 ( 遗传物质、生长和免疫调节因子 ) 传递到靶细胞,进而激活抗凋亡和促存活通路,促进受损组织修复和再生。有研究试图引入间充质干细胞衍生的外泌体作为治疗创面修复的一种更安全的选择[47-48],例如在糖尿病皮肤缺损动物模型中,不同来源间充质干细胞衍生的外泌体能有效促进血管再生和创面再上皮化,缩小创面受损面积。
另外研究发现间充质干细胞与皮肤成纤维细胞相比,间充质干细胞条件培养基中具有更高水平促血管生成细胞因子 ( 如血管内皮生长因子和胰岛素样生长因子 1 等 ),可增强伤口内皮细胞的增殖和新生血管形成[3]。利用间充质干细胞衍生的条件培养基治疗组织炎症作为无细胞治疗范畴,具有易于制备、储存和运输,易于给药等优点[49],在一定程度上克服了基于间充质干细胞治疗的许多限制,包括不必要的分化和同种异体免疫反应的潜在激活等。总之,间充质干细胞可以通过分泌生物活性可溶性因子并与不同类型的宿主细胞相互作用,从而建立有利于组织修复和体内平衡的再生微环境。
2.1.4、间充质干细胞的定向分化与创面修复 间充质干细胞的分化潜能早已受到广泛关注,其因具有分化为中胚层、外胚层和内胚层谱系的潜力而具有良好的可塑性。众多研究表明,在体外和体内扩增的间充质干细胞可以分化为驻留组织的细胞,修复受损组织并部分恢复其正常功能[50]。有研究发现,骨髓间充质干细胞可以直接分化和替代受损组织丢失成分[51],如成纤维细胞、角质细胞及皮肤附件。此外,有研究通过将骨髓间充质干细胞和脂肪间充质干细胞植入到大鼠组织扩张模型和皮肤损伤模型中,发现间充质干细胞能够直接分化为血管内皮细胞参与伤口愈合中的血管生成[52-53]。这一系列的研究证实,间充质干细胞通过分化为不同谱系在皮肤再生中起着关键作用。但由于自体间充质干细胞数量有限,在临床应用前必须通过体外扩增进行分离,这会严重降低间充质干细胞的增殖和分化潜能,甚至在培养扩增过程中迅速老化。因此,改善目前的培养条件以更好地保留间充质干细胞的原始特性已成为未来在实验室研究和临床治疗中的关键问题。
2.2、间充质干细胞在创面修复中的途径
目前间充质干细胞在创面修复中的移植途径按输注部位大致分为 2 类,即全身给药和局部给药,局部给药又细分为传统局部给药和新型局部给药,见图 4。
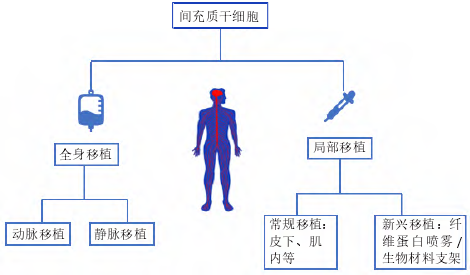
图 4 |间充质干细胞修复慢性创面的移植途径
2.2.1、全身给药
间充质干细胞成功治疗慢性伤口的先决条件之一是明确最优输送方式。目前间充质干细胞治疗缺乏最佳给药途径,为最大限度地发挥间充质干细胞的愈合潜力,提高间充质干细胞修复创面的效率、质量及安全性,提高细胞植入率,探索最佳细胞输送途径显得尤为重要。全身给药是常用的输送方式之一,其主要通过血管途径实现,即静脉途径或动脉途径。
静脉输注间充质干细胞治疗慢性创面是最常用的方法,其易于操作,侵袭性小,细胞迁移到目标组织后将保持靠近氧和营养中心的脉管系统[54],适用于创面部位无法直接接触或需要全身治疗的情况,利用间充质干细胞的迁移能力随血液循环到体内特定的炎症组织。但间充质干细胞能否通过静脉输注到达靶组织仍存在争议,有研究发现伤口处的间充质干细胞的植入效率较低,大多数间充质干细胞在全身输注后立即被截留在肺毛细血管中,很少向靶组织迁移,即肺首过效应,其中大量滞留于肺的间充质干细胞甚至会引起肺部血栓[55-56]。GAO 等[57]分析了肺首过效应的可能原因,即细胞直径以及黏附因素,该研究观察到间充质干细胞在肺滞留的数量会随着血管扩张剂的给药而减少。上述研究说明,为提高细胞植入率和修复效果,在应用静脉途径输注间充质干细胞时应充分考虑细胞大小对修复效果的影响,必要时给予血管扩张剂的应用。相反,最近的其他研究发现,单核细胞通过吞噬作用从肺部清除间充质干细胞,清除后的间充质干细胞随血流迁移到其他部位并仍然提供治疗作用[58]。因此,关于静脉输注中的细胞植入率及归巢优化的相关问题有待进一步验证和探讨。
动脉输注给药是全身输送的另外一种常用方式,理论上动脉输送允许细胞至少绕过肺部一次,从而避免肺部首过效应。
有研究推测动脉内注射有助于更高水平的间充质干细胞移植到靶器官,增强细胞的归巢性和治疗效果[59-60]。虽然动脉输注途径在创面修复中取得一定效果[61],但关于动脉输注的安全性问题仍有争议,已经发现动脉内注射间充质干细胞引起血管阻塞的发生率和严重程度与细胞大小密切相 关[62]。无论静脉还是动脉注射,对间充质干细胞适当处理有助于提高注射的安全性,包括在移植前用高渗缓冲液处理间充质干细胞,优化细胞直径,减少注射细胞的数量和抗凝治疗等[63]。
2.2.2、局部给药
传统局部给药:相较于全身给药的高细胞损耗率和安全问题,局部给药作为伤口治疗的给药方式之一已逐渐被接受,其优点是细胞植入率相对较高,缩短到达受伤皮肤的时间,可直接到达目标组织[64]。DASH 等[65]进行了一项随机对照研究,对实验组下肢慢性伤口患者采用肌肉和皮下途径注射间充质干细胞,结果显示注射间充质干细胞组患者的下肢伤口面积显着缩小、疼痛程度减轻、行走能力改善。后续研究进一步对比了不同局部给药途径在大鼠糖尿病溃疡模型中的应用效果,发现肌内移植与皮下移植相比,其组织中的血管内皮生长因子表达更高[66]。众多研究显示了间充质干细胞局部应用的有效性,但缺氧、炎症等内部因素以及注射操作等外部因素会影响间充质干细胞应用效果。据报道,在临床前模型中,伤口局部注射第 11 天后的细胞植入率低至 0%,其归因于注射过程中的剪切损伤[67]。此外有研究发现局部注射时,细胞流过注射器针头,机械力可诱发间充质干细胞细胞膜变形,导致活细胞计数降低[68],这提示研究者们在治疗过程中为减少间充质干细胞不必要的损坏,提高细胞植入率,控制注射的速度尤为重要。
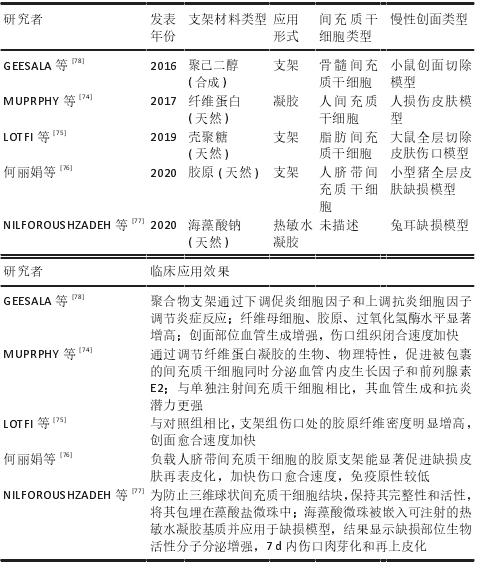
新型局部给药:传统移植途径致使间充质干细胞在创面保留时间短、存活率低,限制了间充质干细胞的治疗效果。为提高间充质干细胞利用率,改善慢性伤口愈合质量,已经开发了许多替代的递送方式,主要包括应用局部喷雾和生物材料支架。有研究表明使用纤维蛋白喷雾局部递送自体间充质干细胞是可行的,其能加速伤口愈合[69]。局部喷雾易于给药,但由于间充质干细胞缺乏封装保护,细胞易在给药部位流失,应用率低。天然细胞外基质能为细胞附着和生长提供三维环境,生物材料支架的设计就模拟了细胞外基质的结构和功能。与大多数创面敷料不同,生物材料支架成功应用的最重要特性是具有优良的生物活性、生物降解性和生物相容性,利于细胞附着于细胞表面受体[70],这也是优于其他输注途径的关键,此外还具有用于运输营养物质和废物的合适孔隙率和机械强度[71],是慢性创伤治疗中间充质干细胞传递的理想载体。生物支架材料按其材料成分不同主要分为天然支架(如透明质酸、壳聚糖、海藻酸盐、胶原蛋白和弹性蛋白等)、合成支架 ( 如聚酸酐和聚乙二醇等 ) 和复合支架[72-73],支架为细胞输送提供了良好的微环境,有助于细胞黏附、增殖和分化,与远距离静脉注射相比,在一定程度上增强了间充质干细胞归巢到损伤部位的能力。当然,生物材料支架的类型不同,其为干细胞提供的生存、功能与治疗效果也不同,以下是间充质干细胞介导的部分生物材料支架在伤口愈合中的应用情况[74-78],见表 2。
表 2 |间充质干细胞介导的部分生物材料支架在创面修复中的临床应用
在以往研究中常采用胶原海绵、脱细胞真皮基质等片状生物支架运输间充质干细胞[79-80],但研究发现此类支架需要额外的细胞接种程序,且不能完美贴合慢性伤口不规则的几何形状。因此不同类型生物材料以水凝胶支架形式的应用成为优于片状支架的又一选择,其易于包埋间充质干细胞和填充不规则伤口,是能够吸收和维持大量水或生物液体的三维不溶性聚合物网络[81]。
与标准条件下生长的间充质干细胞相比,水凝胶还能诱导间充质干细胞分泌血管生成细胞因子和表达与维持多能性和自我更新相关的转录因子[82]。除此之外,复合支架的应用也给间充质干细胞提供了有效载体,其因较高的稳定性和较强的力学性能而具有良好的可塑性和应用前景[83]。
关于支架的设计,支架的结构特征 ( 支架的孔径、几何形状、分支以及通道 ) 是物质运输的重要条件,在一定程度上影响了间充质干细胞的治疗效果。例如,与水凝胶和组织培养瓶的塑料表面相比,藻酸盐溶液的多孔支架允许间充质干细胞产生高浓度的细胞因子和生长因子[84]。还有新研究发现,间充质干细胞的代谢活性影响植入后细胞的存活、功能和命运,缺血环境中间充质干细胞存活的首要条件归因于葡萄糖而并非氧气[85]。
考虑到代谢活性对细胞发挥功能的重要性,新一代含细胞支架的设计应考虑细胞代谢机制和影响因素,以期提高间充质干细胞的存活率。综上所述,与传统的移植方式相比,生物支架的应用增强了间充质干细胞的生存力,具有更强的可塑性,为慢性难愈性伤口治疗提供了新的治疗选择。
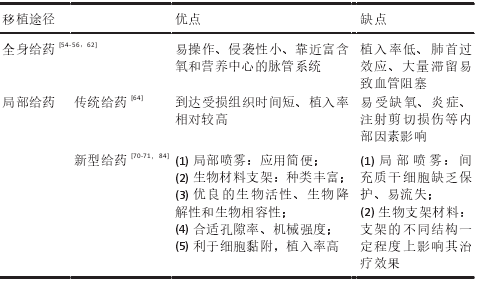
2.2.3、不同输注途径优缺点比较
不同给药途径的药物动力学和药效学大不相同,均会影响间充质干细胞在受者组织中的植入、保留和存活,进而限制其发挥创面修复作用。为探索合适的输注途径,提高间充质干细胞植入率和创面修复效果,现将不同给药途径优缺点加以总结,见表 3。
表 3 |间充质干细胞在慢性创面修复中不同输注途径优缺点比较
3、讨论 Discussion
3.1、既往他人在该领域研究的贡献和存在的问题 既往体内外研究表明,间充质干细胞在创面愈合中显示出巨大的潜力。间充质干细胞促进创面修复的机制尤为复杂,其中,向靶组织归巢、免疫调节、旁分泌功能及定向分化能力是目前研究公认的主要修复机制。为加快间充质干细胞在临床中的应用,研究者不断探索新的应用方式,包括对间充质干细胞预处理、改变间充质干细胞给药方式等。药物递送系统作为组织工程的关键挑战之一,在临床前研究中取得了一定进展,已有多种天然和合成生物材料支架被确立为干细胞递送载体,但间充质干细胞在临床治疗中仍未得到广泛应用,它们在促进创面愈合方面仍有各自的优点和缺点。给药途径的差异是间充质干细胞发挥治疗作用的重要限制因素,不同输注途径影响了间充质干细胞治疗的药代动力学和药效学,包括给药后间充质干细胞在体内的生物分布情况、注射细胞的存活率、注射引起的微血栓风险等,都会影响间充质干细胞治疗慢性伤口的效果。目前在创面修复中间充质干细胞尚无最优递送方案,优化间充质干细胞输送途径仍亟待解决。
3.2、作者综述区别于他人他篇的特点 文章系统综述了间充质干细胞在慢性创面领域的修复机制和移植途径,指出应用不同的间充质干细胞移植途径时,其发挥修复机制的侧重点也相应随之改变,强调在应用特定输送途径时应将间充质干细胞相关修复机制考虑在内,二者相辅相成,密不可分。此外详细探讨了间充质干细胞各移植途径的分类及其在创面中的应用效果,指出生物材料支架作为新兴局部递送方式展现出的良好前景。
3.3、综述的局限性 目前间充质干细胞相关研究多集中在临床前动物模型中,针对间充质干细胞修复创面的机制和移植途径相关研究结果与其应用于人类创面相比仍有一定差异,随着干细胞临床治疗时代的开启,有望取得突破。此外,在间充质干细胞移植途径方面,文章详细探讨了间充质干细胞在慢性创面中不同递送方式的优缺点,但在间充质干细胞种群中存在相当大的异质性,仍有待进一步明确不同类型间充质干细胞 ( 自体 / 异体间充质干细胞、人羊膜间充质干细胞 / 脐带间充质干细胞 / 脂肪间充质干细胞等 ) 在应用过程中的区别点和安全性等问题。
3.4、综述的重要意义 慢性伤口愈合是一个高度复杂的动态过程,即使在最佳愈合条件下,也常导致纤维化或瘢痕,目前仍然是现代再生医学的主要挑战。组织工程是将干细胞生物学与工程材料学相结合,以促进创面愈合的跨学科领域。间充质干细胞作为组织修复的细胞来源,其在慢性创面愈合中的治疗潜力主要归因于 3 个关键功能:免疫抑制、免疫调节及旁分泌作用,这对于减少应用排斥及创面炎症反应、调节受损组织微环境、增强血管生成和组织重塑至关重要。近年来关于增强间充质干细胞应用疗效的研究众多,间充质干细胞输送途径的靶向优化和标准化是提高其修复慢性创面安全性和有效性的关键方面。对于慢性创面患者,如何将间充质干细胞精准运送到病变部位促进组织再生被认为是未来发展的关键问题。明确间充质干细胞促进创面修复的可能机制,了解其不同输送途径的优缺点有助于提高间充质干细胞利用率,改善伤口愈合质量,促进再生医学发展。
3.5、课题专家组对未来研究的建议 鉴于间充质干细胞结合生物材料支架在慢性创面中的应用前景,最大限度地发挥新兴递送途径的优势,未来的研究应关注复合生物材料在修复慢性创面中的应用,生产个性化的组织工程结构物,以探索针对慢性创面愈合的最优细胞递送方法。间充质干细胞的理想输送方式应易于操作、创伤小、副反应低、干细胞存活率高等,生物支架材料作为一种优于其他输注途径的应用方式,既可以培养间充质干细胞用于移植,也可以输送间充质干细胞并支持其体内生存和长期功能。此外应考虑进一步开发和评估间充质干细胞相关提取、培养和保存技术,明确体内控制间充质干细胞命运的相关机制以及用于给药后监测间充质干细胞活性的相关生物标志物,并建立一种监测方法来评估和量化不同递送途径给药后间充质干细胞的动态分布和应用疗效。












