
1998 年,人用药物注册技术要求国际协调会 ( ICH) 出台的 E5指南《接受国外临床资料应考虑的种族问题》[1]中提出了桥接试验的概念。桥接试验是指在新地域进行的附加试验,以提供与新地域人群有关的药代动力学或有效性、安全性、适宜剂量以及给药方案的信息,允许将原地域的临床数据外推到新地域,这样的研究可能包括附加的药效学研究[2].桥接试验在一些国家和地区成功实施,已成为新药注册申请的重要形式,对于外推国外的临床试验数据、判断药品种族差异、减少重复试验、缩短新药审批时间有重要的意义。本研究检索国内外与桥接试验相关的文献资料,了解桥接试验的研究进展和现状。
资料和方法
1 资料来源
自建 库 到 2015 年 3 月,外 文 检 索 PubMed、Embase和 Web of Science 数据库,中文检索中国知网数字图书馆。英文以题目或摘要中含有“bridgingstudy”或“bridging strategy”为检索词进行检索; 中文以“桥接试验”或“桥接研究”为检索词进行检索。纳入全部有关桥接试验的文献,包括论着、综述、会议报道等,排除重复文献、媒体报道、信件以及不相符合的文献等。
2 评价内容
针对文献外部特征,包括文献总体情况、发表年代分布、发文量、第一作者所在研究机构、期刊载文量、文献被引频次、文献中记载的各桥接试验的具体样本量等进行计量分析,并对文献中论着的主要研究内容和热点进行阐述。
3 统计分析方法
将检索出的相关文献汇总,利用 EndNote X7 软件进行去重,按照纳入和排除标准处理文献,结合人工检查和纠错。在 Excel 表中建立数据库统计分析。
结 果
1 文献检索总体情况
共检索 839 篇,经软件去重、人工检查与纠错,剩余106 篇,其中英文有97 篇、中文8 篇、日文1 篇。其中论着 92 篇、综述 13 篇、会议报道 1 篇。
2 桥接试验相关文献发表年代分布
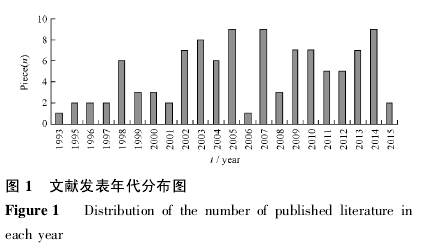
外文第一篇相关文献是 Haley[3]于 1993 年发表的; 中文第一篇于 1999 年由凌静萍发表[4].自 1998年 ICH 出台的 E5 指南的发布,关于桥接试验的文献波动增加。桥接试验相关文献发表年代分布,见图 1.【1】
3 桥接试验国家发文量
桥接试验以美国发文量最多,共 35 篇; 中国与日本并列第二,均为 22 篇; 而英国和新西兰位列第四、五位,分别为 7 篇和 5 篇。
4 桥接试验发文量 2 篇以上的第一作者及其研究机构
发文量排名第一,第二的 Sramek JJ 和 Cutler NR为同一研究小组成员,其研究方向主要是桥接试验的临床研究,如阿尔茨海默病患者的研究。并列第二的Hsiao CF 来自中国台湾地区的国家卫生研究机构,主要依据 ICH E5 指南来评价桥接试验,其中也应用了种族敏感性数据[5].其余发文量为 2 篇的第一作者,他们来自不同的研究机构。
5 桥接试验发文量排序前三位的研究机构
桥接试验发文量最多的是加利福尼亚临床试验中心( 9 篇,8. 49%) ,其次为美国国家卫生研究所( 6 篇,5. 66%) ,并列第三位分别为杜克大学医学院,国立成功大学,国立医院机构四国癌症中心,北里大学医学院,礼来公司( 均为 2 篇,1. 87%) .
6 桥接试验载文量前五位的期刊
载文量前五的期刊分别为生物药剂统计学杂志( 13 篇,IF = 0. 716) ,药物信息杂志( 8 篇,IF =0. 49 ) ,药物研发杂志 ( 4 篇,IF = 1. 707 ) ,抗菌药物和化疗杂志( 3 篇,IF = 4. 451) ,日本临床药理学和治疗学杂志( 3 篇,因未被 SCI 收录,无法查得其影响因子) .
7 桥接试验被引用频次前五位的文献
在 Web of Science 数据库中桥接试验相关文献中被引用频次前五位的文献,见表 1.
8 桥接试验各桥接试验的样本量
桥接试验相关文献中记载的各桥接试验的具体样本量,见表 2.9 桥接试验相关文献中论着的研究内容种族敏感性 评估一项药品能否在新地域上市,要根据所收集的桥接临床数据包中的内容,包括资料是否符合新地域法规的要求? 原地域资料到新地域的外推性是否合理? 需要附加做哪些试验就可以接受原地域的数据? ICH 在 E5 指南中,将种族上的差异分为内在的( 基于遗传学或生理学的差异) 和外在的( 基于文化或环境特征的差异) .按照药物代谢种族差异的特点,将药品分为种族敏感和种族不敏感两种类型。在 ICH E5 指南中推荐了具有药物代谢种族差异的药品包括 10 项参考因素。但最后仍要整体考虑这些因素所造成的差异对临床的影响程度,来决定外地域的数据能否被接受[6].桥接研究的类型 桥接研究的类型取决于新地域和原地域之间药品对种族的敏感性、药品的分类、外因性种族因素和种族差异。根据药品对种族的敏感性,判定是否有必要进行本地的临床试验,如果有必要,则须看是哪种类型。一项桥接试验可能是 I 期的药代动力学试验或药效学试验( PK/PD) ,也可能是Ⅱ/Ⅲ期的随机对照临床试验。
桥接策略的模式 原地域的临床试验资料能否外推到新地域,作为申请上市的依据,通常需要进行桥接试验,其实施和运用的过程称为桥接策略[7].桥接策略可分 4 种模式: 以健康受试者为对象的独立的药代动力学研究和剂量 - 反应的临床试验; 以健康受试者和患者为对象的独立的药代动力学研究和Ⅱ期剂量 - 反应的临床试验; 不进行独立的药代动力学研究,但在临床试验中包含药代动力学研究; 进行独立的药代动力学研究,并在临床试验中也包含药代动力学研究。
讨 论
桥接是为说明原地域上市的药品能否在新地域上市所进行的一系列试验,其目的在于利用外国数据,外推有效性和安全性数据,以缩短开发周期、降低开发成本、促进全球化,从而使新药在新地域迅速获得批准。除日本以外,亚洲的诸多国家和地区尚未加入 ICH 成员国之中。但 ICH E5 关于接受国外临床试验资料、减少重复试验的桥接理念,已经引起了广泛的关注。虽然实施和运用桥接试验的过程仍存在很多有待改进的地方,但毫无疑问桥接试验在未来将会成为新药研发过程中的重点之一。
参考文献:
[1] ICH. International Conference on Harmonization Tripatite GuidenceE5. Ethnic factors in the acceptability of foreign clinical data[C].The US Fed Reg,1998,83: 31790 - 31796.
[2] 桑国卫。 新药临床研究中的“桥接”试验 [J]. 中国处方药,2003,2: 50 - 53.
[3] Haley EC Jr,Brott TG,Sheppard GL,et al. Pilot randomized trial oftissue plasminogen activator in acute ischemic stroke. The TPABridging Study Group[J]. Stroke,1993,24: 1000 - 1004.
[4] 凌静萍。 ICH 资料: 接受国外临床资料时对人种因素的考虑[J].中国临床药理学与治疗学杂志,1999,4: 46 -51.
[5] Hsiao CL,Lin YL,Hsu LF,et al. Ten -year experience of the evalua-tion of ethnic sensitivity data [J]. Drug Inf J,2011,45: 717 -724.
[6] Naito,Chikayuki. Ethnic factors in the acceptability of foreign clini-cal data[J]. Drug Inf J,1998,32: 1283 - 1292.
[7] Uyama Y,Shibata T,Nagai N,et al . Successful bridging strategybased on ICH E5 guideline for drugs approved in Japan[J]. ClinPharmacol Ther,2005,78: 102 - 113.





