
引 言
兽用抗生素作为抗寄生虫、抗菌、促进动物生长制剂,在畜禽养殖业中得到广泛应用[1].大部分抗生素在动物体内很难被吸收利用,有 30% ~ 90% 的抗生素以原药或其他代谢物通过尿液和粪便的形式进入环境[2].
畜禽养殖业废水多采用厌氧消化处理[3-4],该方法对抗生素具有一定的去除效率[5],但其出水中某些抗生素浓度仍较高[6].不同地区和季节畜禽养殖业废水中抗生素的浓度和种类差别较大,孙建平检测出杭州某规模化养殖厂废水中金霉素浓度高达65 mg / L[7].畜禽废水经厌氧消化处理后,沼液中氨氮浓度增加、C/N 比失衡、可生化性差[8],需后续脱氮处理。
生物脱氮包括硝化和反硝化 2 个阶段,其中硝化阶段为限速步骤。关于硝化过程影响因素的研究较多集中在温度、碳氮比、溶解氧、碱度等方面,鲜有文献报道废水中的金霉素对硝化过程的影响。
硝化过程会释放H+,致使pH 值下降,硝化菌对pH值变化十分敏感,故碱度对生物脱氮影响较大。在某些条件下,畜禽废水厌氧消化液会出现碱度不足的情况[8].因此有必要研究碱度对畜禽废水脱氮的影响。
本研究以模拟畜禽废水厌氧消化液为处理对象,在 25,30 ℃条件下,探讨金霉素和碱度对硝化过程的影响。
1 试验部分
1. 1 试验材料
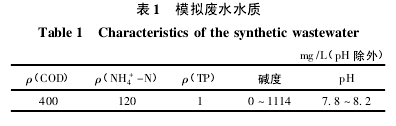
本试验进水为模拟畜禽养殖废水的厌氧消化出水,以葡萄糖为碳源,NH4Cl 为氮源。 外 加 CaCl20. 14 g / L、MgSO4·7H2O 0. 3 g / L、KH2PO40. 16 g / L、NaHCO31. 63 g / L 和 微量 元素。微量元素: ZnSO4·7H2O 0. 1 g / L,CoC12·6H2O 0. 2 g / L,FeCl3·6H2O0. 25 g / L,Na2MoO4·2H2O 0. 11 g / L,NiC12·6H2O0. 04 g / L.加入量为 1 mg / L.废水水质见表 1.【1】
金霉素为某生物科技有限公司销售的兽用试剂,用量按需投加。
接种污泥取自成都某污水处理厂回流污泥,经过10 d 驯化,氨氮转化率达 90% 以上,硝化污泥培养成熟。
1. 2 试验装置及运行方式
试验采用 6 个相同的小型 SBR 反应器( 如图 1所示) ,每个反应器总容积 2. 5 L,有效容积 2 L,起始MLVSS 值为( 2 500 ± 100) mg / L.采用振荡箱振荡充氧,使 ρ( DO) 维持在 0. 8 ~ 1. 5mg/L,泥水可充分混合。SBR 排水率为 50%.6 个反应器平均分为 2 组,分别在 25,30 ℃ 条件下运行。每组的 3 个反应器内金霉素浓度依次为 0,5,20 mg / L.通过添加 NaHCO3调节进水碱度/氨氮( ALK/N) 比值,使各反应器分 6 个阶段运行( 共运行166 个周期) : ALK / N 分别为 9. 28 ( 碱度过量 1 /3 ) 、7. 14( 碱度充足) 、4. 76( 碱度不足 1 /3) 、3. 57( 碱度不足1/2) 、2. 38( 碱度不足2/3) 、0( 碱度为0) .ALK/N为 9. 28 阶段运行 41 周期,其余阶段运行 25 个周期后,进入下一个 ALK/N 阶段。每 4 个周期测定 1 次,文中数据均是稳定运行后,24 个周期的平均值。SBR反应器运行周期为 12 h,其中25 ℃组进水10 min、曝气 360 min、沉淀 40 min、排水 10 min、闲置 300 min;30 ℃ 组进水 10 min、曝气 300 min、沉淀 40 min、排水10 min、闲置 360 min.
1. 3 分析项目及方法
VSS、SS 采用重量法测定; pH 值采用 WTW-pH /oxi340i 型便携式测量仪; COD 采用 5B-3 ( D) 型 COD快速测定仪; 氨氮根据纳氏试剂分光光度法测定; 亚硝态氮根据 N-( 1-萘基) - 乙二胺光度法测定; 硝态氮根据麝香草酚分光光度法测定; 碱度采用电位滴定法测定[9].
NAR 根据式( 1) 计算:【2】

比氧化速率,mg/( mg·h) ; θ 为温度修正系数,K- 1; T为温度,K.游离氨( free ammonia,FA) 和游离亚硝酸盐( freenitrous acid,FNA) 根据式( 4) 、式( 5) 计算。【3】

2 结果与讨论
2. 1 金霉素和碱度对氨氧化率 ( ammonia oxidationrate,AOR) 的影响
图 2 为不同温度下,金霉素和碱度对 AOR 的影响。从图 2 可以看出: 在碱度充足的条件下,25 ℃时金霉素质量浓度分别为 0,5,20 mg/L,AOR 依次为98% 、91% 和 79% .30 ℃ 时 AOR 依次为 98% 、97%和 91%.同样,碱度不足时 AOR 变化规律相同。说明金霉素对硝化细菌有抑制作用,导致 AOR 不断减小。金霉素属四环素类抗生素,该类抗生素能与细菌核糖体30S 亚基的 A 位置结合,干扰30S 小亚基与氨基酰 tRNA 结合,使得氨基酰 tRNA 不能进入 mRNA上的受位,导致细菌蛋白质合成受阻从而抑制细菌活性。
25 ℃ 、未添加金霉素时,碱度过量 1 /3 对 AOR影响不大,但当 ALK/N 从 7. 14 下降到 0 时,AOR 从98% 下降至约 25% .金霉素浓度分别为 5,20 mg / L时,当 ALK/N 从 9. 28 下降到 0 时,AOR 分别从 98%和 90% 下降到 29% 和 27%.即随着碱度的下降,AOR 下降。
比较图 2 可以发现: 两者的总体变化趋势相同,但略有差别。总体上 AOR 随着碱度的减小而降低。除碱度过量 1/3,30 ℃组 AOR 比 25 ℃组稍低外,其他碱度相同的条件下,30 ℃组 AOR 比 25 ℃组稍高。主要原因为在 10 ~30 ℃时,硝化细菌的活性随着温度升高而升高[10-11].另外,在相同的金霉素浓度梯度下,25 ℃ 时金霉素对氨氧化菌( ammonia oxidizingbacteria,AOB) 和亚硝酸盐氧化菌 ( nitrite oxidizingbacteria,NOB) 的抑制效果较 30 ℃ 时明显。其原因可能是温度对金霉素水解作用的影响,随着温度升高,金霉素水解率增大。当 pH =7,温度分别为7,2,35 ℃ 时,金霉素的半衰期分别为 429,16,< 6 h[12],即随着温度的增加,金霉素的半衰期减小。因此经过水解作用后,30 ℃ 组中的金霉素浓度梯度比 25 ℃ 组小,故对 AOR 影响差别较小。
2. 2 金 霉 素 和 碱 度 对 亚 硝 态 氮 积 累 率 ( nitriteaccumulation rate,NAR) 的影响
不同温度下金霉素和碱度对 NAR 的影响如图 3所示。
25 ℃ 、碱度充足条件下,未添加金霉素时,NAR几乎为 0; 金霉素浓度提高到 5 mg/L 时,NAR 为59% ; 继续提高金霉素浓度至 20 mg / L,NAR 为70% .同样,碱度不足时 NAR 变化规律相同,即随着金霉素浓度增加,NAR 逐渐上升。说明 25 ℃时金霉素对 NOB 的抑制作用大于 AOB,出现亚硝态氮累积。
Susan Schmidt 等[13]在研究抗生素对硝化过程的影响中发现,当混合抗生素浓度在20 ~30 mg/L 时,硝化过程的产物主要为亚硝态氮,只有少量的硝态氮生成。且有文献报道通过控制温度、pH、溶解氧、FA、FNA、抑制物、曝气时间等[14-16]可以实现短程硝化,而本研究发现通过控制金霉素的浓度也可以实现短程硝化。由于中温( 30 ℃ 以上) 有利于 AOB 生长,所以NAR 在 30 ℃ 时比在 25 ℃ 时更高。30 ℃ 时 AOB 比NOB 增殖快,当氨氮转化为亚硝态氮之后停止曝气,控制生化反应时间,可出现亚硝态氮的累积。从图 3可以看出: 同样条件下 30 ℃时 NAR 都高于25 ℃,而投加金霉素后,两者之间的差别更大。30 ℃时,即使ALK / N 降低到 2. 38 ( 碱度不足 2 /3) ,但是投加了金霉素的系统,NAR 仍可维持在 76% 以上。说明温度和金霉素的共同作用可致使亚硝态氮累积。但当碱度严重不足时,由于整个硝化系统均受到破坏性影响,AOR 变差,NAR 也随之降低。
2. 3 氨氮平均降解速率的变化
不同温度下金霉素和碱度对氨氮平均降解速率的影响如图 4 所示。
从图 4 可以看出: 金霉素对氨氮平均降解速率影响较大。25 ℃、碱度充足的条件下,金霉素浓度分别为 0,5,20 mg/L 时,氨氮平均降解速率分别为 7. 94,7. 38,6. 49 mg / ( g·h) .即随着金霉素浓度的增加,氨氮平均降解速率下降,且在不同碱度条件下,变化趋势相似。25 ℃ 、金霉素为 0 mg / L 的条件下,当 ALK / N 从9. 28 降至 0 时,氨氮平均降解速率从 8. 02 mg / ( g·h)减小到 2. 30 mg/( g·h) .即随着碱度的减少,氨氮平均降解速率下降,且在不同金霉素浓度下,变化趋势相似。
从图 4 还可以看出: 在不同金霉素浓度和碱度条件下,氨氮平均降解速率在30 ℃均高于25 ℃。这主要是因为温度会影响硝化细菌对底物的利用速率。
AOB 在 293 K 时最大比氧化速率为 0. 80 d- 1,温度修正系数为 0. 094 K- 1[17],将数据代入硝化细菌对底物的利用速率公式,可得 AOB 的比氧化速率在 25,30 ℃ 时分别为 1. 280,2. 048 mg / ( mg·h) .故 30 ℃时其氨氮平均降解速率较 25 ℃时高。
2. 4 FA 和 FNA 的变化
FA 和 FNA 对 AOB 和 NOB 均有抑制作用,但NOB 对 FA 和 FNA 更敏感。FA 对 AOB 和 NOB 的抑制浓度分别为 8 ~ 120 mg/L 和 0. 08 ~ 0. 82 mg/L,FNA 对 AOB 和 NOB 的 抑 制 浓 度 分 别 为 0. 2 ~2. 8 mg / L 和 0. 06 ~ 0. 83 mg / L[11].根据式 ( 4) 和式( 5) 可得: 在温度为 25,30 ℃下,金霉素为 0 mg/L时,FA 浓度变化如图 5 所示。
FA 浓度随碱度的降低而逐渐降低,且 30 ℃ 时较25 ℃ 高。30,25 ℃ 时,随着 ALK / N 从 9. 28 降至 0,ρ( FA) 分别从 3. 4,2. 5 mg / L 降至 0. 7,0. 5 mg / L.故FA 处于抑制 NOB 但不抑制 AOB 的范围内,对 NAR有一定的贡献。但从图 3 可以看出,25 ℃、金霉素为0 mg / L、ALK / N = 9. 28 时,NAR 约为 6% ,随着碱度继续下降,NAR 几乎为 0.故 FA 对 NAR 的贡献较小,不是抑制 NOB 的主要因素。
计算所得 FNA 最大值为 0. 003,远低于 FNA 对AOB 和 NOB 的抑制浓度,对 AOB 和 NOB 的抑制作用均可忽略。
3 结 论
1) 金霉素可抑制 AOB 和 NOB 的活性。碱度充足、金霉素分别为 0,5,20 mg/L 时,随着金霉素浓度增加,AOR 下降。在碱度不足时,AOR 变化规律相同。30 ℃ 时,金霉素浓度对 AOR 的影响比 25 ℃时小。
2) 25 ℃ 时,出现亚硝态氮的累积主要是由于金霉素对 NOB 的抑制作用大于 AOB,NAR 随着金霉素浓度增加而逐渐上升。在碱度不足时,表现出相同趋势。
3) 30 ℃ 时,不同碱度条件下,反应器出现亚硝态氮累积的原因不同。未投加金霉素的系统,出现亚硝态氮累积是由温度导致的。而投加金霉素的系统,出现亚硝态氮累积的原因是温度和金霉素共同作用的结果,且其亚硝态氮累积率较未投加金霉素的系统高。
4) 在相同的金霉素和碱度条件下,氨氮平均降解速率在 30 ℃时较 25 ℃时高。





