摘 要: 【背景】共生菌群可以影响宿主的生理、代谢以及神经行为,黑腹果蝇是研究宿主与共生菌作用机制的优秀遗传模型。【目的】分离和鉴定黑腹果蝇体内的共生菌,并研究其对果蝇生长和发育的影响。【方法】利用YG固体培养基分离果蝇肠道菌;革兰氏染色、生化鉴定和16S rRNA基因比对鉴定菌种;体内定殖和世代传递实验验证细菌与果蝇的共生关系;建立无菌和悉菌模型,通过发育历期和生长速率来验证其促生长作用;RT-PCR检测促生长分子基因表达;免疫荧光染色检测果蝇肠道细胞的增殖;葡萄糖氧化酶法检测葡萄糖浓度。【结果】分离到一株能够明显促进果蝇生长发育的细菌,经鉴定为霍氏肠杆菌(Enterobacter hormaechei),该菌可以稳定定殖于黑腹果蝇肠道以及培养基内,而且可以世代垂直传递。该菌可明显地促进果蝇的生长,并通过加速促胸腺激素的分泌来发挥促生长作用,同时可以促进果蝇肠道细胞的增殖。霍氏肠杆菌相较于无菌果蝇可以降低体内葡萄糖水平。【结论】霍氏肠杆菌是黑腹果蝇的有益共生菌,实验证实其可以促进果蝇的生长和发育。
关键词: 黑腹果蝇; 霍氏肠杆菌; 共生菌; 生长; 发育;
Abstract: [Background] Commensal bacteria can affect host’s physiology, metabolism and neural behavior. Drosophila melanogaster is an excellent genetic model to investigate the mechanism of interaction between host and commensal bacteria. [Object] This study aims to isolate and identify the commensal bacteria from D. melanogaster, and investigate their effects on the growth and development of D. melanogaster. [Methods] The YG agar medium was prepared to isolate bacteria from the intestinal tract of D. melanogaster. Gram-staining, biochemical identification and 16S rRNA gene blast were used to identify the bacteria strain. The commensalism between the bacteria and D. melanogaster was verified by colonization and generation transfer experiments. The sterile and gnotobiotic animal models were established to verify the growth promotion effect of E. hormaechei through the development timing and growth rate. RT-PCR was used to examine the molecular markers; immunofluorescence staining monitored proliferation of intestinal cells in fruit flies. [Results] A bacterial strain that could robustly promote the growth of the flies was isolated from the gut of D. melanogaster and identified as E. hormaechei. It stably colonized the gut of D. melanogaster and medium, and could be delivered to descendant. E. hormaechei promoted the growth of the flies obviously via increasing PTTH secretion and promoting the proliferation of intestinal cells in fruit flies. E. hormaechei decreased the level of glucose compared to germ-free flies. [Conclusion] E. hormaechei is a beneficial commensal bacterium of D. melanogaster to promote the growth and development of D. melanogaster.
Keyword: Drosophila melanogaster; Enterobacter hormaechei; Commensal bacteria; Growth; Development;
绝大多数动物被视为一个超级生态系统,因为宿主体表和体内拥有极为广泛的微生物。这些微生物可以寄居在环境暴露的皮肤表面,也可以寄居在口腔、肠道、阴道等内部结构中,其中消化道是微生物最高密度聚集的器官。例如,成人肠道中定殖着约1014个微生物,其数量是人体细胞总数的近10倍,所以共生微生物的研究前景不言而喻[1]。肠道菌群与宿主的健康状态密切相关,其对宿主既可产生有利影响,也可产生危害作用[2]。近年来,随着测序技术的发展以及人类微生物组项目的开展,对宿主消化道内的微生物群结构有了一定了解[3],但其结构和功能的复杂性和多样性阻碍了全面认知消化道微生物群的进程。因此,共生微生物的研究仍然需要传统的细菌分离技术,并在此之上,亟待无菌和悉生动物模型进行验证。果蝇由于容易建立无菌和悉菌模型[4],而且其肠道结构与人类具有极大的保守性,加之遗传可操作性强[5],作为研究微生物与宿主间相互作用关系的模型在共生微生物研究领域得到广泛应用[6]。

果蝇以腐烂的水果或植物为食[7]。这样的摄食习惯不可避免地会接触多种微生物菌群,从而构建属于其特殊的共生微生物群落[8],其主要以细菌为主,并且这些细菌可以在果蝇肠道内迅速繁殖,与宿主形成天然的共生关系。对于细菌来讲,果蝇的取食运动协助了菌群的繁殖扩散;对于果蝇来讲,天然菌群可以协助果蝇消化食物、抵抗病原菌侵袭等[9]。研究表明,实验室饲养的果蝇肠道内主要存在5种共生菌,其中以醋杆菌属和乳植杆菌属最为常见[5]。然而,高通量测序结果表明果蝇肠道细菌种类可达20多种,与多样且复杂的人类肠道共生菌群类似[8],所以仍存在大量未被发现的共生菌。霍氏肠杆菌(Enterobacter hormaechei)属于肠杆菌属[10],广泛分布于自然界,常发现于土壤和污水中,与多种动物的活动场所和食物来源有交叉,有机会与动物相互接触。研究发现,霍氏肠杆菌可作为人肠道共生菌群的一部分[11],但目前国内外针对霍氏肠杆菌的研究并不多,对其功能的研究也是少之又少,因此,研究霍氏肠杆菌的生理功能特性就显得极为重要。肠杆菌属也可作为昆虫肠道共生菌的重要组成成分[12],可以提供营养[13],保护昆虫免受病毒或病原体的毒害[14],提高昆虫热耐受性以提高昆虫适应性[15]。尽管在一些蝇类昆虫体内已得到一定的证实[16],然而在黑腹果蝇体内还未见报道,对其功能仍然未知。
本研究利用常规分菌技术从果蝇体内分离出一株需氧或兼性厌氧菌,研究该菌与果蝇之间的共生关系,探究其影响黑腹果蝇生长的内在机制。
1、 材料与方法
1.1、 材料
1.1.1、 菌株和果蝇品系
野生黑腹果蝇品系Oregon R由中国科学院遗传与发育生物学研究所张永清研究员惠赠。
1.1.2、 培养基
YG培养基(添加葡萄糖作为碳源的YCFA培养基,g/L):酪蛋白10.00,酵母浸粉2.50,半胱氨酸1.00,NaHCO3 4.00,K2HPO4 3.00 ,KH2PO4 3.00,NaCl 0.90,MgSO4·7H2O 1.00,CaCl2 1.00,葡萄糖2.50,叶酸10.00 μL,生物素10.00 μL,维生素B12 10.00 μL,P-对氨基苯甲酸钾(P-aminobenzoic) 10.00 μL,氯高铁血红素10.00 μL,维生素B6 10.00 μL,蒸馏水1.00 L,pH 5.8-6.1。
酵母-玉米粉琼脂培养基(g/L):玉米粉77.70,酵母粉24.00 ,琼脂18.00,葡萄糖63.20,CaCl2 0.83,蔗糖31.60,防腐剂(酒石酸钾钠、尼泊尔丁酯),水1.35 L。
食物培养基(g/L):玉米粉70.00,蔗糖96.00,按所需比例加入酵母,琼脂15.00,蒸馏水1.00 L。
1.1.3、 主要试剂和仪器
Walch消毒液,广州威莱公司;Triton X-100、次氯酸钠、Glucose Assay Kit,Sigma公司;反转录试剂盒、RT-PCR试剂盒,Takara公司;兔源一抗PH3,Millipore公司;抗兔二抗-568、4′,6-二脒基-2-苯基吲哚(DAPI)、TriZol,Invitrogen公司;多聚甲醛,Merck公司。
分光光度仪,岛津公司;冷冻离心机,上海力申公司;基因扩增仪,Thermo公司;实时定量PCR仪,ABI公司;显微镜,Leical公司。
1.2、 方法;
1.2.1、 果蝇的饲养
所有果蝇均饲养在温度25~30 °C、湿度50%~60%培养箱内,其光周期为12 L:12 D。保种食物为酵母-玉米粉琼脂培养基。
1.2.2、 无菌果蝇(Germ free,GF)和悉菌以及混合菌果蝇(Conventional reared,CR)模型的建立
收集育肥24 h、产卵8 h内的卵,依次用Walch消毒液、次氯酸钠、75%乙醇、PBST对其进行消毒处理,获得无菌卵,将其转移到无菌的食物培养基内,使用透气不透菌的塞子对其密封,建立无菌果蝇模型。在此基础上,于第二天加入 OD595 (细菌密度约为108 CFU)的单株菌,建立悉菌模型。另外,将普通饲养的果蝇用75%乙醇、无菌水各清洗2遍后研磨,将研磨液注入到前一天建立的无菌果蝇的培养体系中,即为混合菌果蝇模型。以上操作全部在无菌安全柜内进行,完成后置于干净清洁的恒温培养箱内培养。
1.2.3、 细菌的分离与分子生物学鉴定
取10只野生型成虫果蝇,CO2麻醉后,在磷酸盐缓冲液中解剖肠道,置于1.5 mL EP管内,75%乙醇、磷酸盐缓冲液各清洗2次后,加入100 μL磷酸盐缓冲液研磨后,按10倍倍比稀释该菌液,均匀地涂布于YG培养基(pH 6.1)上,置于37 °C培养箱内培养24-48 h,待长出单克隆菌株,挑取单株菌进行纯化并对菌株进行保存,并记录其为菌株FY。DNA的提取方法见参考文献[4],并且利用16S rRNA基因通用引物(上游引物:5′-AAAGATGGCATCATCATTCAAC-3′;下游引物:5′-TACCGTCATTATCTTCCCCAAA-3′),通过PCR技术扩增该细菌基因片段。PCR反应体系:ddH2O 34 μL,10×Buffer 5 μL,dNTPs (2.5 mmoL/μL) 3 μL,上游引物(100 μmoL/L) 1μL,下游引物(100 μmoL/L) 1 μL,Ex Taq (5 U/μL) 1 μL,模板5 μL,共计50μL。PCR反应条件:94 °C 5 min;94 °C 45 s,55 °C 45 s,72 °C 90 s,共32个循环;72 °C 5 min。扩增的PCR产物送生工生物工程上海股份有限公司测序,将测序结果经BLAST序列比对后,确定其菌种信息,用MEGA 7.0软件做进化树。
1.2.4、 细菌的体外培养特征
将以上分离出的菌株FY按3%比例注入到含已知碳源(葡萄糖、麦芽糖、D-甘露醇、可溶性淀粉、乙醇、乙酸钠)的YCFA培养基内,并添加了一个未加任何碳源的YCFA培养基作为空白对照,37 °C兼性厌氧条件下进行培养,检测其24 h内的OD595和pH值的变化。
1.2.5、 定殖实验以及世代传递实验
(1) 定殖实验:使用4%酵母浓度的食物培养基所饲养的果蝇建立菌株FY悉菌模型后,分别取2龄、3龄、蛹、成虫(羽化后1、4、14 d)果蝇各十二只,75%乙醇清洗2遍,磷酸盐缓冲液清洗2遍,研磨后对其进行倍比稀释,均匀涂布于各个YG培养基(pH 6.1)上,37 °C培养后计数不同比例稀释培养基中的菌落数;并同时取各虫期食物培养基0.1 g,按照上述方法进行涂板,计数稀释不同比例培养基中的菌落数。
(2) 世代传递实验:将菌株FY悉菌果蝇的蛹经75%乙醇、磷酸盐缓冲液各消毒2次后,转移至无菌的4%的酵母-玉米粉培养基内,待其羽化并产卵后,分别检测其子一代3龄幼虫、蛹以及成虫肠道载菌量,具体操作如定殖实验。
1.2.6、 发育历期和生长速率实验
(1) 发育历期:每日记录0.25%、0.5%、1.0%酵母浓度下常规饲养混合菌(CR)、菌株FY悉菌和无菌(GF)果蝇的成蛹以及羽化为成虫的数量,最后计算蛹形成和果蝇羽化为成虫的时间。
(2) 生长速率:分别取0.5%和1.0%酵母培养基中CR、GF、菌株FY悉生果蝇10只(1 d幼虫至蛹),置-20 °C冰箱1~2 h将其速冻致死,置于载玻片上,排列整齐,拍照,利用ImagJ软件计算每只幼虫的体表面积。取0.25%、0.5%、1.0%酵母浓度下3种成虫雌雄果蝇各40只,分别称量体重并取其均值获得单只果蝇体重值。
1.2.7、 免疫荧光染色[8]
挑取4%酵母浓度培养基中CR、GF、菌株FY悉生成虫果蝇(羽化4 d)各10只,磷酸盐缓冲液中解剖肠道,然后在低温避光条件下进行以下操作:4%多聚甲醛溶液固定肠道30 min,0.3% PBST洗涤3~5 min,含0.2%山羊血清和0.1%胎牛血清的0.3% PBST (Triton-X100)封闭30 min,在4 °C条件下1:1 000稀释的兔源一抗PH3孵育过夜,次日用1:1 000稀释的抗兔二抗室温孵育3 h,0.3% PBST洗涤3次后,1:1 000稀释的荧光染料DAPI染色10 min,0.3% PBST再次洗涤10 min,甘油封片,荧光显微镜采集图像并统计分析结果。
1.2.8、 实时定量PCR以及葡萄糖浓度测定
(1) 实时定量PCR:分别挑取1.0%酵母培养基中CR、GF、菌株FY果蝇10只(3 d幼虫到蛹形成)。利用TriZol法提取总的RNA,使用反转录试剂盒去除基因组DNA后,利用Oligo-dT引物反转录mRNA合成cDNA。之后以cDNA为模板、rp49 (上游引物:5′-GACGCTTCAAGGGACAGTATCTG-3′;下游引物:5′-AAACGCGGTTCAGCATGA-3′)作为参照基因;设计引物(上游引物:5′-CACTCCACATCCCACAGAGATGGCGATGG-3′;下游引物:5′-CCACGAGCTCATTCGTAACTTTGC-3′)检测样本中PTTH转录水平,计算公式为△Ct=Ct目的基因-Ct参照基因,相对表达量=2-△△Ct。RT-PCR反应体系:cDNA 10 μL,PrimeScript RT Enzyme Mix 1 μL,RT Primer Mix 1 μL,5×PrimeScript Buffer4 μL,RNase Free ddH2O 4 μL。RT-PCR反应条件:94 °C 2 min;94 °C 30 s,55 °C 30 s,72 °C 60s,共25个循环;72 °C 5 min。
(2) 葡萄糖浓度的测定:分别取4%酵母浓度培养基内CR、GF以及菌株FY悉生果蝇三龄幼虫10只,无菌水清洗2遍,研磨后取其血淋巴液1 μL,根据葡萄糖试剂盒内说明书设计对照组以及实验组,然后用分光光度计测定其在340 nm处的吸光度值,计算各组样本的葡萄糖浓度(mg/mL)。
1.2.9、 数据分析
实验重复3次以上,以每组数据的平均值作为最终数据进行统计学分析,利用t检验(Student t-test)对其进行差异分析。
2、 结果与分析
2.1、 细菌的分离与鉴定
图1 肠道分离菌株FY与果蝇常见肠道菌进化树
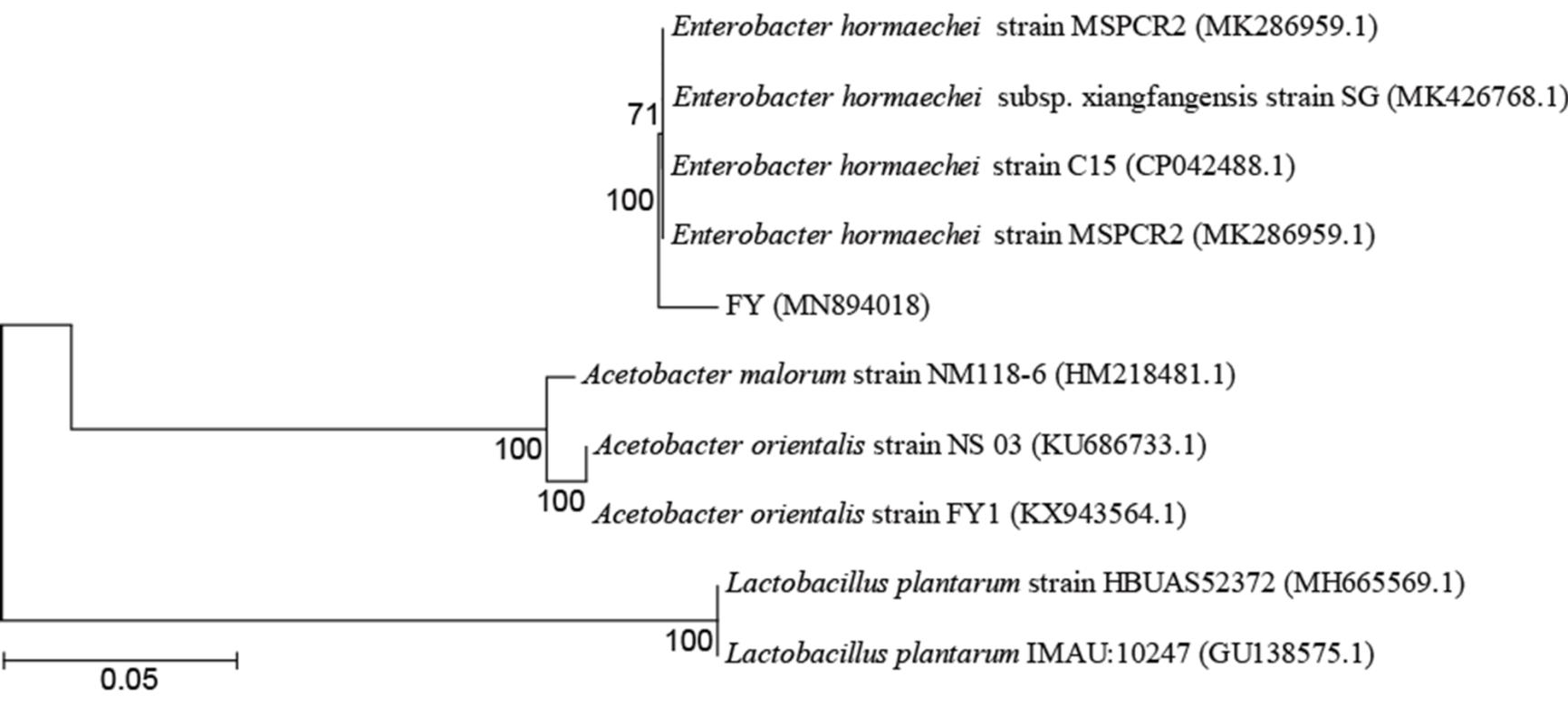
Figure 1 Phylogenetic tree of E. hormaechei and common intestinal bacteria in D. melanogaster.
注:肠道分离菌株FY与黑腹果蝇肠道共生菌的系统进化树;标尺:序列差异的分支长度;标记的数字代表百分比;括号内为GenBank获取的登录号。Note: Phylogenetic tree of strain FY and common intestinal bacteria in D. melanogaster. Bar: Nucleotide divergence; Number at notes present bootstrap percentages; Those number in parentheses are GenBank accession number.
利用YG培养基,从果蝇肠道分离到一株需氧或兼性厌氧菌,记录其为菌株FY,此菌株对营养要求不高,可在普通的营养琼脂上培养,菌落呈圆形,直径大小约1-2 mm,灰白色,中间微凸起,表面光滑;形态学鉴定为革兰氏阴性菌,呈球杆状,有周身鞭毛,16S rRNA基因测序显示其有效片段长度为1 451 bp,其序列被提交至GenBank获取登录号为MN894018。比对基因序列结果显示,该菌株与Enterobacter hormaechei亲缘关系最近(图1),相似性为100% (1 451/1 451 bp),因此将这个菌株命名为E. hormaechei FY。该菌株与相关菌株以及果蝇肠道内常见肠道菌绘制进化树如图1所示。该菌株属于肠杆菌属一个分支,与霍氏肠杆菌和阴沟肠杆菌最为接近,与醋酸杆菌和植物乳杆菌的距离较远。以上结果可进一步体现出果蝇肠道共生菌的多样性和复杂性。
2.2、 霍氏肠杆菌体外培养特征
图2 霍氏肠杆菌体外培养特征
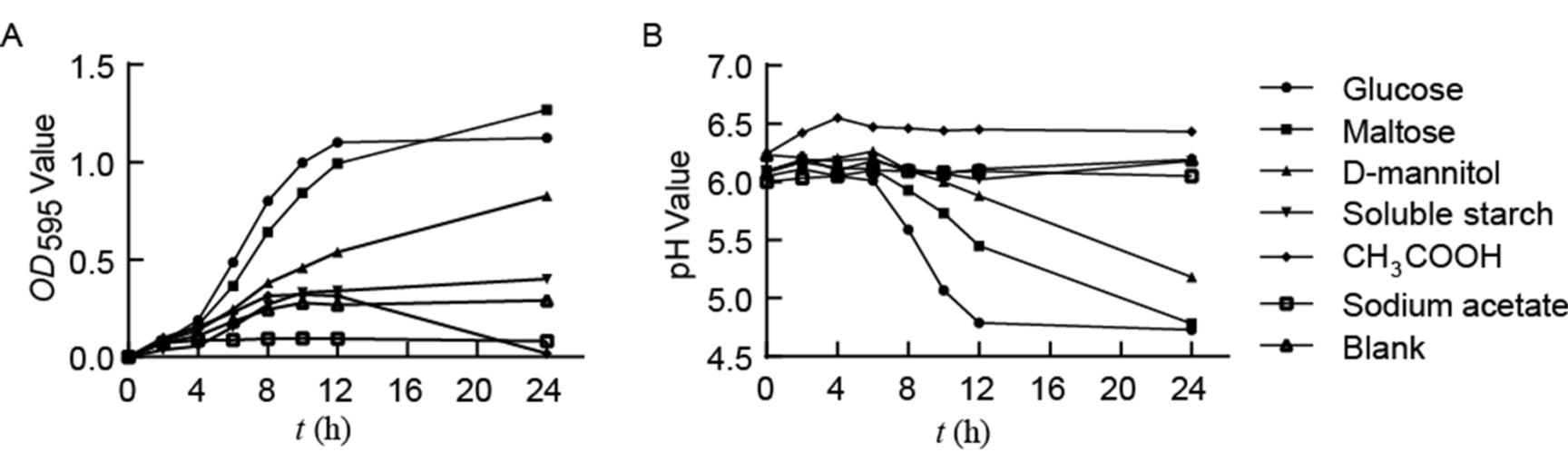
Figure 2 E. hormaechei’s features of culture in vitro
注:A:不同碳源培养基内霍氏肠杆菌生长情况;B:不同碳源培养基内霍氏肠杆菌的pH变化。数据代表3次重复实验的平均值。Note: A: Growth of E. hormaechei with seven different carbon source medium. B: The pH values of E. hormaechei growing in seven different carbon source medium. Values represent the mean of 3 biological replicates.
利用含有不同碳源(葡萄糖、麦芽糖、D-甘露醇、可溶性淀粉、乙醇、乙酸钠)的YCFA培养基以检测E. hormaechei FY碳源利用情况。OD595值在葡萄糖、麦芽糖以及D-甘露醇培养基内迅速增加,峰值可达1.2 (图2A),而在其他碳源上OD595值未显着增加。伴随着细菌OD595值的增加,pH值发生同步变化。发酵检测结束时,葡萄糖和麦芽糖培养基的pH值降低到4.7,甘露醇培养基降低到5.2,而其他碳源培养基pH值变化不明显(图2B)。以上结果说明,霍氏肠杆菌可以利用葡萄糖、麦芽糖、甘露醇等常见碳源,而不能或微弱利用其他碳源。
2.3、 霍氏肠杆菌在果蝇肠道的定殖
霍氏肠杆菌定殖实验结果显示:霍氏肠杆菌在果蝇的2龄、3龄、蛹期其肠道载菌量依次为7.2×104、5.1×104、2.2×105CFU,羽化为成虫1、4、14 d其肠道载菌量依次为1.24×106、1.4×104、8.8×106CFU(图3A)。这充分说明霍氏肠杆菌存在于各个生长阶段果蝇的肠道内,体现出共生菌稳定共存的特征。在果蝇2龄、3龄、蛹及成虫期食物培养基中的含菌量依次为7×105、5×105、2.3×106 、2.6×106CFU(图3B),说明该菌可在果蝇的食物培养基内定殖。在霍氏肠杆菌悉菌模型的子一代果蝇幼虫期、蛹期、成虫期肠道载菌量依次为7.1×103、4.5×103、1.7×103CFU (图3C)。这说明该菌可以在果蝇世代间垂直传递。综上所述,霍氏肠杆菌是黑腹果蝇的一种肠道共生菌,并可在世代间垂直传递。
图3 霍氏肠杆菌定殖于果蝇肠道且稳定存在于培养基中
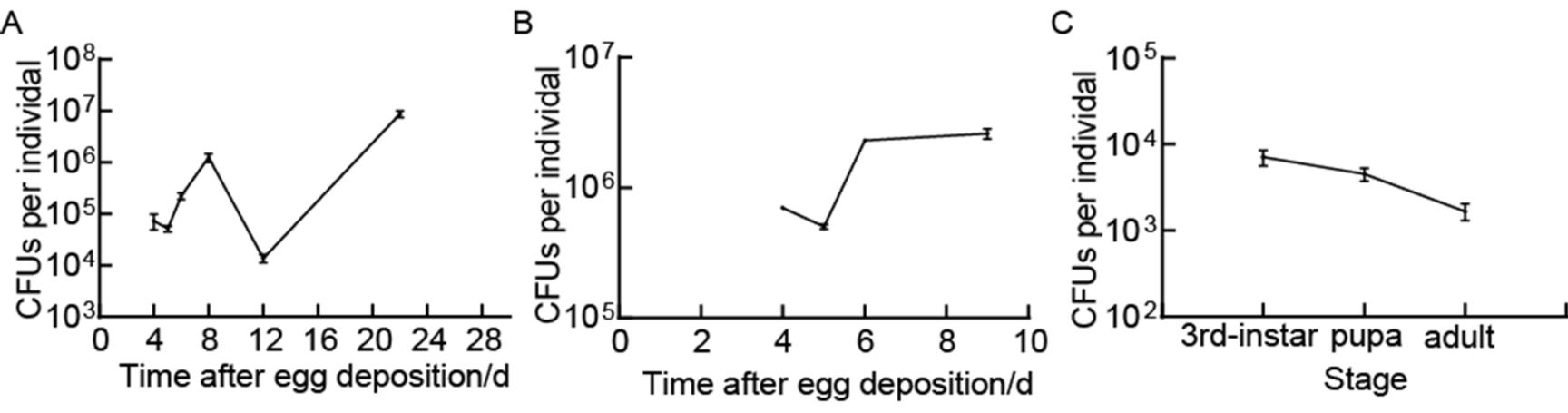
Figure 3 E. hormaechei colonized in intestinal tract of Drosophila and stability existed in the medium
注:A:霍氏肠杆菌在果蝇肠道内的定殖;B:霍氏肠杆菌在果蝇食物培养基内定殖;C:霍氏肠杆菌在果蝇子一代体内的定殖。数据代表12只个体3次重复性实验的平均值±标准误。Note: A: The colonization of E. hormaechei in the gut of Drosophila. B: The colonization of E. hormaechei in the culture medium. C: The colonization of E. hormaechei in the offspring of Drosophila. Values represent the mean of 3 biological replicates containing at least 12 individuals each ±SEM.
2.4、 霍氏肠杆菌促进果蝇发育
果蝇成蛹及羽化为成虫所需时间作为衡量环境或食物成分对果蝇促生长作用的可靠指标。结果如图4A显示:在0.25%、0.5%、1.0%酵母浓度条件下,GF果蝇成蛹时间分别为(16.4±0.4)、(14.1±0.5)、(11.3±0.2) d,CR果蝇成蛹时间分别为(8.2±0.3)、(6.9±0.2)、(6.6±0.2) d,GF果蝇相比于CR果蝇其蛹形成时间分别延迟了8、7、5 d(P<0.001)。同时,霍氏肠杆菌悉生果蝇在3种浓度下成蛹时间分别为(6.5±0.3)、(5.4±0.1)、(5.3±0.1) d,与GF果蝇相比分别提前了11、8、6 d (P<0.001),而且提前于CR果蝇,说明霍氏肠杆菌促进果蝇成蛹的作用甚至强于混合菌,并且随着酵母浓度的增加,CR、GF以及霍氏肠杆菌悉生果蝇成蛹时间明显缩短,说明食物培养基内营养成分可以影响果蝇的生长,高浓度酵母提供充足的营养以缩短其成蛹时间。图4B显示:在0.25%、0.5%、1.0%酵母浓度条件下,GF果蝇羽化为成虫时间分别为(19.1±0.5)、(17.0±0.5)、(15.1±0.2) d,CR果蝇羽化为成虫时间分别为(12.6±0.6)、(10.8±0.2)、(10.4±0.2) d,GF果蝇相对于CR果蝇分别延迟了7、6、5 d (P<0.001),而霍氏肠杆菌悉生果蝇羽化为成虫时间分别为(12.3±0.03)、(11.4±0.1)、(11.0±0.1) d,相比于GF果蝇,分别提前了7、6、4 d (P<0.001),与CR果蝇间差异性不明显。以上说明霍氏肠杆菌可以显着缩短果蝇的发育历期,在营养较匮乏条件下体现得更为明显。综上,霍氏肠杆菌是果蝇的一种有益共生菌,在一定范围内,其促生长作用甚至超过混合菌。
图4 霍氏肠杆菌促进果蝇发育
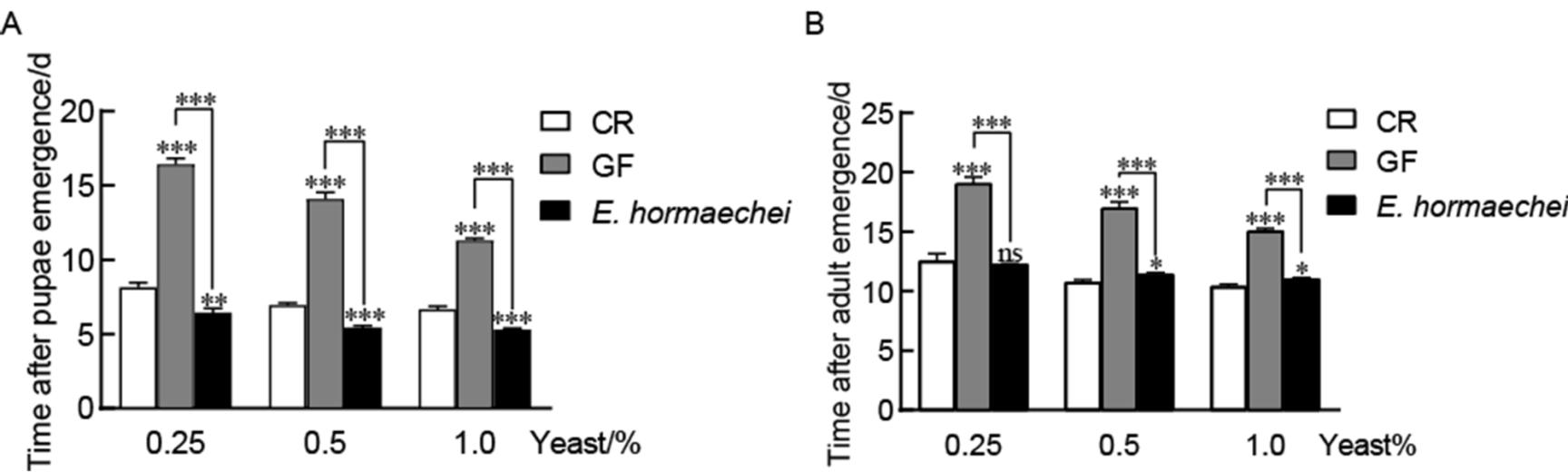
Figure 4 E. hormaechei promoted the growth and development of D. melanogaster
注:A:不同酵母浓度条件下,CR、GF以及霍氏肠杆菌悉生果蝇的蛹形成时间;B:不同酵母浓度下CR、GF以及霍氏肠杆菌悉生果蝇羽化为成虫的时间。数据代表20只个体3次重复实验的平均值±标准误;ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001.Note: A: The timing of pupa formation of CR, GF or E. hormaechei in the different yeast concentrations. B: The timing of emergence of adult of CR, GF or E. hormaechei in the different yeast concentrations. Values represent the mean of 3 biological replicates containing at least 20 individuals each ± SEM. ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001.
2.5、 霍氏肠杆菌提高果蝇生长速率
上面结果显示,霍氏肠杆菌可通过缩短果蝇的发育历期来促进其生长和发育。对羽化同样天数后的雌雄果蝇体重进行测量后发现,在营养丰富(1.0%酵母浓度)或者匮乏(0.25%酵母浓度)条件下,每只果蝇体重变化不明显。3个不同酵母浓度下雌性果蝇体重无差异,0.5%酵母浓度条件下E. hormaechei雄性果蝇相比于GF存在一定差异,其余两个浓度下均无差异(图5A、B)。所以推测该菌可能通过改变果蝇的体表面积提高果蝇生长速率。因此,利用果蝇的体表面积检测其生长速率。在营养丰富的条件下,E. hormaechei悉生果蝇与CR果蝇的体表面积相当(图5D)。但在营养相对匮乏的条件下,在前2天E. hormaechei悉生果蝇体表面积与CR果蝇存在一定差异(P<0.01),3 d则不再存在差异(图5C)。在两种营养条件下,CR和E. hormaechei悉生果蝇体表面积明显高于GF果蝇(图5C、D),再次证实E. hormaechei促生长作用可能强于CR,说明该菌可促进果蝇的生长。综上,霍氏肠杆菌可通过提高果蝇生长速率来促进其生长和发育。
图5 霍氏肠杆菌提高果蝇生长速率
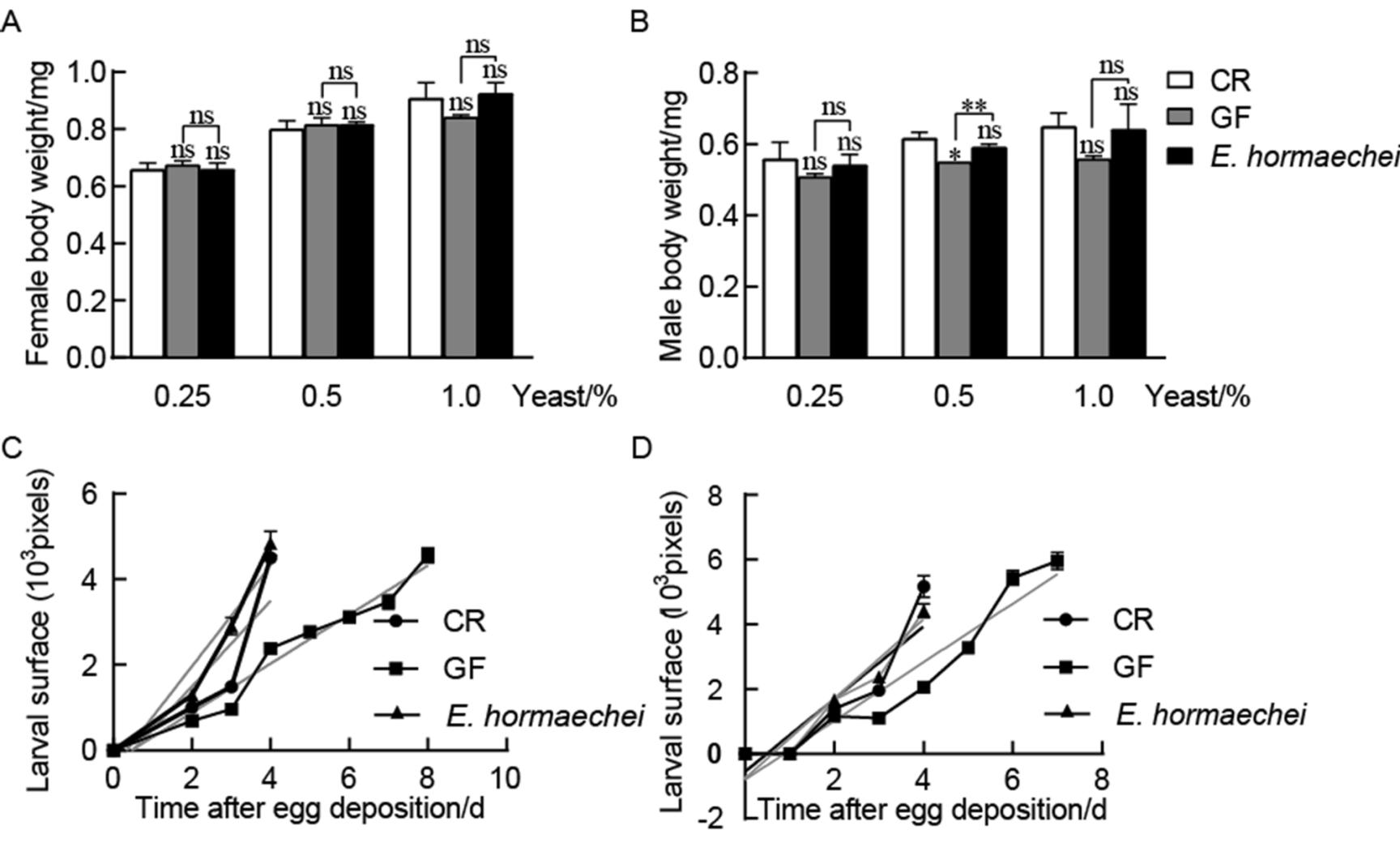
Figure 5 E. hormaechei enhanced the growth rate of Larval.
注:A:不同酵母浓度培养基内单只雌果蝇的体重;B:不同酵母浓度培养基内单只雄果蝇的体重;数据代表40只样本的3次重复实验的平均值±标准误;ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001。C:CR、GF以及霍氏肠杆菌悉生果蝇在0.5%酵母浓度培养基内幼虫的体表面积线性回归曲线。线性回归曲线包括(CR,Y=999.7X-500.1;GF,Y=572.6X-258.8;霍氏肠杆菌,Y=1181X-395.2);D:CR、GF以及霍氏肠杆菌悉生果蝇在1.0%酵母浓度培养基内幼虫的体表面积线性回归曲线。线性回归曲线包括CR:Y=1229X-755.9;GF:Y=906.8X-801.3;霍氏肠杆菌:Y=1121X-550.6。数据代表至少10只个体的3次重复性实验的平均值±标准误。Note: A: The weight of Female Drosophila on different yeast concentrations of medium. B: The weight of male Drosophila on different yeast concentrations of medium. Values represent the mean of 3 biological replicates containing at least 40 individuals each ± SEM. ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001. C: Larval surface area of CR, GF or E. hormaechei-associated larvae over time when grown on poor diet (0.5% yeast). Linear regression curves are included (CR, Y=999.7X-500.1; GF, Y=572.6X-258.8; E. hormaechei, Y=1181X-395.2); D: Larval surface area of CR, GF or E. hormaechei-associated larvae over time when grown on rich diet (1.0% yeast). Linear regression curves are included (CR, Y=1229X-755.9; GF, Y=906.8X-801.3; E. hormaechei, Y=1121X-550.6). Data represent the mean of 3 biological replicates containing at least 10 individuals each ± SEM.
2.6、 霍氏肠杆菌促进肠细胞增殖
果蝇肠道细胞更新速度很快,其中中肠是增殖分裂最活跃的部位之一。因此,将中肠肠细胞分裂数作为检测肠道细胞结构功能的重要指标之一。利用PH3 (标记肠道有丝分裂中期细胞的一种抗体)检测果蝇前、中以及后肠细胞分裂情况。荧光染色及数据统计结果显示,GF果蝇中肠肠分裂中期细胞数为6.3个,CR果蝇为14.5个,GF果蝇明显低于CR果蝇(P<0.001);而且E. hormaechei悉生果蝇肠道细胞数为15.7个,数目明显多于GF果蝇(P<0.001),与CR果蝇间无差异(图6D)。在果蝇的前肠和后肠也可以看到类似的趋势。以上结果说明,霍氏肠杆菌可以明显地促进果蝇肠道细胞的更新及稳态。
图6 霍氏肠杆菌促进果蝇肠细胞的增殖分裂
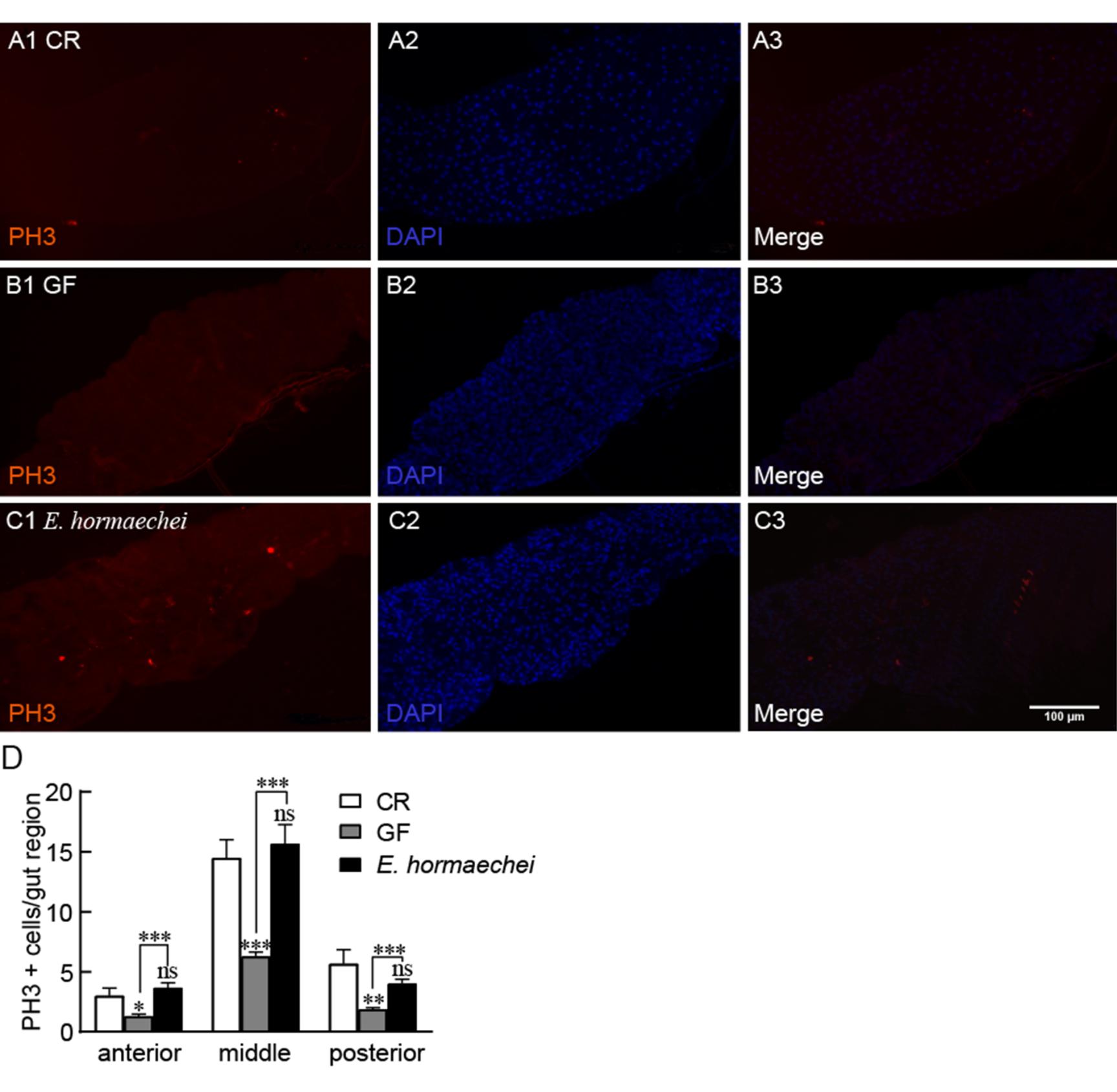
Figure 6 E. hormaechei promoted the proliferation of Drosophila gut cells.
注:A-C:CR、GF以及霍氏肠杆菌悉生果蝇中肠肠道细胞有丝分裂的代表性图像(红色为PH3标记;蓝色为DAPI标记;标尺为100 μm)。D:CR、GF以及霍氏肠杆菌悉生果蝇肠道细胞有丝分裂数定量,前、中、后肠为肠区,n=6,数据代表平均值±标准误;ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001.Note: A-C: The representative imaging of mid - mitotic metaplasia in the mid-intestinal of CR, GF or E. hormaechei flies (red as PH3 marker; blue as DAPI marker; Bar=100 μm). D: The quantification of mitosis in intestinal area of CR, GF and E. hormaechei flies. The anterior gut,mid-gut and posterior are parts of intestinal area, n=6. Values represent mean±SEM. ns: P>0.05, *: P<0.05, **: P<0.01, ***: P<0.001.
2.7、 霍氏肠杆菌促进脑促胸腺激素分泌
促胸腺激素(prothoracicotropic hormone,PTTH)是脑神经分泌细胞分泌的一种激素,可促进果蝇从三龄幼虫向蛹的转变。该基因表达具有时间依赖性,在果蝇三龄幼虫后期和蛹前期表达量达峰值。因此,用PTTH的转录量检测霍氏肠杆菌对果蝇生长发育的影响。结果如图7A所示:GF果蝇体内PTTH转录量达峰值时间迟于CR果蝇(GF:10 d;CR:8 d),霍氏肠杆菌悉生果蝇体内PTTH表达量在8 d达到峰值,提前于GF果蝇(图7A),说明霍氏肠杆菌促进脑促胸腺激素分泌,有效地挽救了无菌果蝇的生长发育迟缓。
2.8、 霍氏肠杆菌降低葡萄糖浓度
类胰岛素肽能降低黑腹果蝇血淋巴液葡萄糖水平,因此检测果蝇体内葡萄糖浓度以评估该菌对胰岛素信号通路的影响。结果显示:GF果蝇体内葡萄糖水平高于CR果蝇(GF:5.9 mg/mL;CR:2.7 mg/mL;P<0.05),这表明共生菌群促进类胰岛素的产生。更重要的是,霍氏肠杆菌悉生果蝇体内葡萄糖水平也低于GF果蝇(E. hormaechei:2.9 mg/mL;P<0.05),并且与CR果蝇间无差异(图7B)。综上,霍氏肠杆菌可以通过增强胰岛素信号通路以促进果蝇的生长和发育。
图7 霍氏肠杆菌促进促胸腺激素的分泌及降低葡萄糖水平
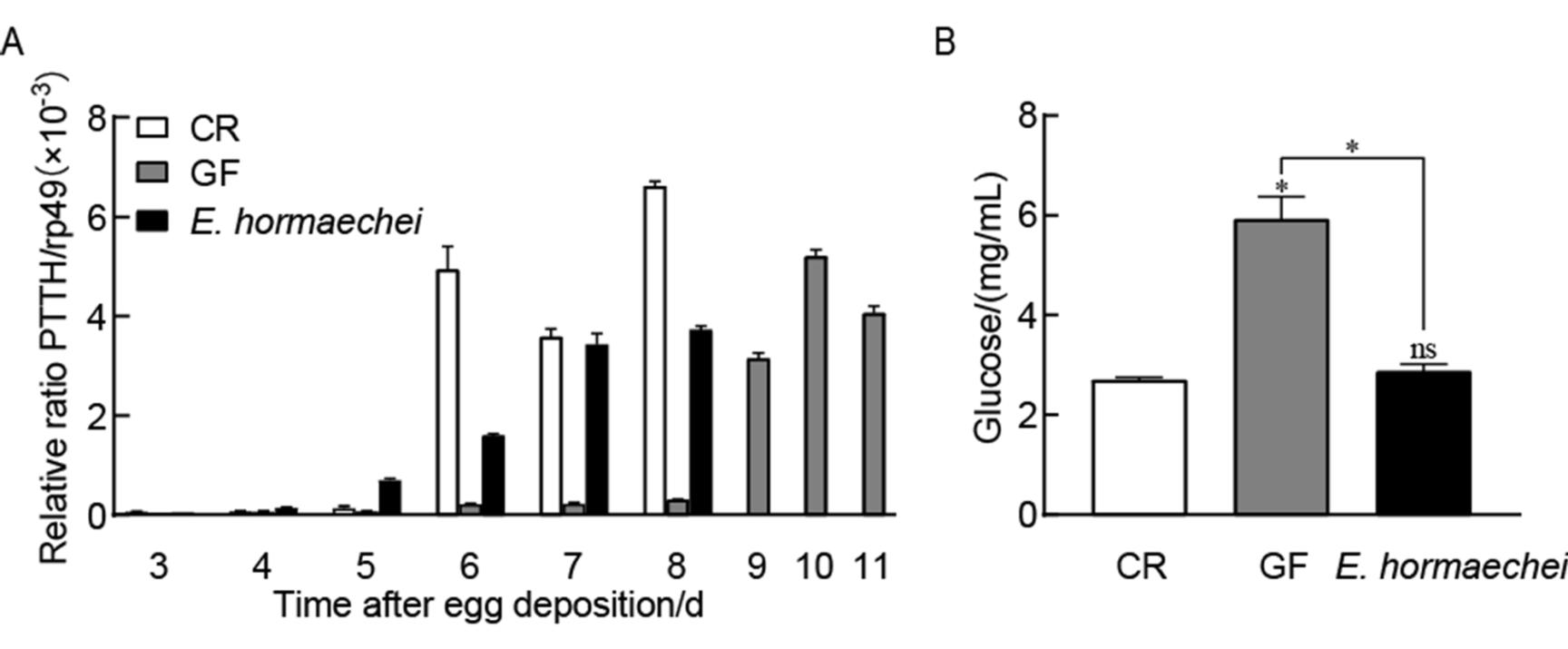
Figure 7 E. hormaechei accelerated the expession of PTTH and lowered glucose levels.
注:A:RT-PCR检测CR、GF以及霍氏肠杆菌悉生果蝇体内PTTH的转录量;B:CR、GF以及霍氏肠杆菌悉生果蝇体内葡萄糖浓度。数据代表3次重复实验的平均值±标准误。ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001.Note: A: PTTH mRNA levels for CR, GF and E. hormaechei-associated Drosophila. B: Glucose levels for CR, GF and E. hormaechei-associated Drosophila. Values represent the mean of 3 biological replicates±SEM. ns: P>0.05, *: P<0.05, **: P<0.01, ***: P<0.001.
3、 讨论与结论
本实验室及其他相关研究发现肠道共生微生物对于果蝇的生长发育至关重要[17],而且基于非培养的测序技术显示其肠道内的菌群丰度及多样性远远超过之前的认知。因此,研究菌群与果蝇间的相互作用关系,从而更深层次地理解微生物群与宿主间的作用机制就显得格外重要。本研究从果蝇肠道内分离出霍氏肠杆菌,并证实其为果蝇的肠道共生菌,可以显着促进黑腹果蝇的生长和发育。一方面,菌株FY可以缩短果蝇的发育历期,提高其生长速率;另一方面,该菌可以促进果蝇肠细胞的增殖分裂,促进黑腹果蝇体内促胸腺激素(PTTH)的分泌及增强胰岛素信号通路,进而发挥促生长作用。
果蝇肠道是一个动态变化的复杂器官,在不同时期存在着形态和功能的差异[18]。在幼虫期,肠道担负着营养吸收和储存的功能,以支持其快速生长,所以果蝇摄食量大且转运速度快;而果蝇成虫食物种类繁杂且摄食量减少,主要通过长鼻获取液体食物[18],加之其肠道免疫活性增强,食物在肠道滞留时间相对延长,不利于微生物的增殖定居,因此,这部分解释了幼虫载菌量多于新孵化成虫载菌量。但随着成虫衰老(如15 d成虫),肠道免疫活性降低,载菌量又会显着地增加,也符合预期[19]。然而,不同时期的肠道又具有非常高的保守性,由多种细胞类型的异质发育起源组成,形成物理屏障,选择性吸收养分,防止病原体入侵,并增强免疫反应[20]。其中的中肠由多能肠道干细胞、吸收性肠细胞和产生激素的分泌细胞构成。在内在机制上,多种信号如BMP、Wnt、JAK/STAT和Ras等调节肠道发育和动态平衡[18]。因此,我们认为肠道共生菌促进不同时期肠干细胞增殖和分化时,尽管可能存在速度和数量上差异,但这种促生长是一种通用模式。本研究重点在于霍氏肠杆菌对黑腹果蝇生长和发育的促进作用,所以我们推测该菌对果蝇不同发育阶段具有类似的积极作用,均可以促进不同时期肠道干细胞的增殖分裂。
果蝇从幼虫到成虫要经历4次蜕皮,研究表明,蜕皮是从大脑神经分泌腺分泌促胸腺激素(PTTH)开始的,PTTH刺激前胸腺(prothoracic gland,PG)分泌和合成蜕皮激素,作为蜕皮酮代谢衍生物的蜕皮激素的动态变化会启动体壁角质层合成以及果蝇内部器官生长发育,从而引起果蝇的蜕皮变态[21,22]。而且在果蝇的发育过程中,4次蜕皮时间是由幼虫在上一个龄期其大小或者是体重达到某个临界点来进行控制的,但这又显然与激素级联的启动有关。因此,本研究将促胸腺激素(PTTH)作为评价霍氏肠杆菌促进果蝇生长和发育的分子指标之一。本研究发现,霍氏肠杆菌作为肠杆菌属的常见菌株,其所构建的悉菌模型可促进果蝇肠细胞增殖,同时促进PTTH提前分泌以挽救GF果蝇的生长发育迟缓,这与前人的研究结果[23]相符合。
研究表明肠道微生物不仅仅可以利用食物中的营养成分促进自身的生长繁殖,还可以刺激果蝇肠道细胞分泌消化酶促进营养物质的更好吸收[24],进而促进果蝇的生长和发育。鉴于肠杆菌属在一些昆虫体内所展现出的益生菌效应,本实验研究发现,处于无菌环境的GF果蝇生长发育迟缓现象可以被霍氏肠杆菌的定殖所挽救,并且与CR果蝇间无差异。另外,作为机体供能最主要的能源物质,葡萄糖在机体的新陈代谢和生长发育发挥着极为重要的作用,而类胰岛素可以通过促进葡萄糖的代谢吸收以降低果蝇的血淋巴液的葡萄糖水平。那么霍氏肠杆菌可以增强机体的胰岛素信号通路,促进果蝇体内葡萄糖的代谢吸收,降低其葡萄糖浓度,从而促进果蝇的生长和发育。
综上所述,霍氏肠杆菌可以显着缩短果蝇的发育历期,提高其生长速率,促进肠细胞的增殖分裂,是果蝇的一种肠道有益共生菌。至于该菌对于果蝇其他神经生理行为和代谢等生理活动是否存在影响,以及该菌是否也存在通过表皮等外部器官发挥促生长作用,还需进一步进行探究。另外,本实验研究结果表明,果蝇的确是一个用以研究微生物与宿主间相互作用机制的优良的遗传学模型,期待其在生物研究领域发挥更重要的作用。对于霍氏肠杆菌的研究也有望弥补国内外对该菌研究的空缺,为之后的研究提供一定的借鉴意义。
参考文献
[1] Scanlan PD, Knight R, Song SJ, et al. Prevalence and genetic diversity of Blastocystis in family units living in the United States[J]. Infection, Genetics and Evolution, 2016, 45: 95-97
[2] Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nature Reviews Immunology, 2009, 9(5): 313-323
[3] Segata N, Haake SK, Mannon P, et al. Composition of the adult digestive tract bacterial microbiome based on seven mouth surfaces, tonsils, throat and stool samples[J]. Genome Biology, 2012, 13(6): R42
[4] Liu W, Li YJ, Liu XL, et al. Clostridium perfringens promotes the growth and development of Drosophila melanogaster[J]. Acta Entomologica Sinica, 2016, 59(5): 530-537 (in Chinese)
[5] Shin SC, Kim SH, You H, et al. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling[J]. Science, 2011, 334(6056): 670-674
[6] Liu W, Jiang FF, Bi XL, et al. Drosophila FMRP participates in the DNA damage response by regulating G2/M cell cycle checkpoint and apoptosis[J]. Human Molecular Genetics, 2012, 21(21): 4655-4668
[7] Markow TA, O’Grady P. Reproductive ecology of Drosophila[J]. Functional Ecology, 2008, 22(5): 747-759
[8] Chandler JA, Lang JM, Bhatnagar S, et al. Bacterial communities of diverse Drosophila species: ecological context of a host-microbe model system[J]. PLoS Genetics, 2011, 7(9): e1002272
[9] Pais IS, Valente RS, Sporniak M, et al. Drosophila melanogaster establishes a species-specific mutualistic interaction with stable gut-colonizing bacteria[J]. PLoS Biology, 2018, 16(7): e2005710
[10] Geiger A, Fardeau ML, Grebaut P, et al. First isolation of Enterobacter, Enterococcus, and Acinetobacter spp. as inhabitants of the tsetse fly (Glossina palpalis palpalis) midgut[J]. Infection, Genetics and Evolution, 2009, 9(6): 1364-1370
[11] Sutton GG, Brinkac LM, Clarke TH, et al. Enterobacter hormaechei subsp. hoffmannii subsp. nov., Enterobacter hormaechei subsp. xiangfangensis comb. nov., Enterobacter roggenkampii sp. nov., and Enterobacter muelleri is a later heterotypic synonym of Enterobacter asburiae based on computational analysis of sequenced Enterobacter genomes. [version 1; peer review: 1 approved, 1 approved with reservations][J]. F1000Res, 2018, 7: 521
[12] Wang HX, Jin L, Peng T, et al. Identification of cultivable bacteria in the intestinal tract of Bactrocera dorsalis from three different populations and determination of their attractive potential[J]. Pest Management Science, 2014, 70(1): 80-87
[13] Zhou HZ, Guo W, Xu B, et al. Screening and identification of lignin-degrading bacteria in termite gut and the construction of LiP-expressing recombinant Lactococcus lactis[J]. Microbial Pathogenesis, 2017, 112: 63-69
[14] Koch H, Schmid-Hempel P. Socially transmitted gut microbiota protect bumble bees against an intestinal parasite[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(48): 19288-19292
[15] Bourtzis K, Lees RS, Hendrichs J, et al. More than one rabbit out of the hat: Radiation, transgenic and symbiont-based approaches for sustainable management of mosquito and tsetse fly populations[J]. Acta Tropica, 2016, 157: 115-130
[16] Yao MY, Zhang HH, Cai PM, et al. Enhanced fitness of a Bactrocera cucurbitae genetic sexing strain based on the addition of gut-isolated probiotics (Enterobacter spec.) to the larval diet[J]. Entomologia Experimentalis et Applicata, 2017, 162(2): 197-203
[17] Liu W, Wang XY, Gao XC. Commensal Staphylococcus epidermidis promoted postembryonic development of Drosophila melanogaster[J]. Microbiology China, 2019, 46(6): 1404-1412 (in Chinese)
[18] Lemaitre B, Miguel-Aliaga I. The digestive tract of Drosophila melanogaster[J]. Annual Review of Genetics, 2013, 47(1): 377-404
[19] Ren CL, Webster P, Finkel SE, et al. Increased internal and external bacterial load during Drosophila aging without life-span trade-off[J]. Cell Metabolism, 2007, 6(2): 144-152
[20] Miguel-Aliaga I, Jasper H, Lemaitre B. Anatomy and physiology of the digestive tract of Drosophila melanogaster[J]. Genetics, 2018, 210(2): 357-396
[21] Tennessen JM, Thummel CS. Coordinating growth and maturation-insights from Drosophila[J]. Current Biology, 2011, 21(18): R750-R757
[22] Shingleton AW. The regulation of organ size in Drosophila: Physiology, plasticity, patterning and physical force[J]. Organogenesis, 2010, 6(2): 76-87
[23] Xu HZ, Wang L, Wang J, et al. Symbiotic Escherichia coil promotes the developmental timing of Drosophila melanogaster[J]. Microbiology China, 2018, 45(12): 2662-2672
[24] Erkosar B, Storelli G, Mitchell M, et al. Pathogen virulence impedes mutualist-mediated enhancement of host juvenile growth via inhibition of protein digestion[J]. Cell Host & Microbe, 2015, 18(4): 445-455





