汉族人中CLU基因多态性及血浆CLU水平与AD的关系
时间:2018-11-02 来源:国际检验医学杂 作者:宋兴勃,吴茜,王旻晋, 本文字数:6588字摘 要: 目的 探讨西南地区汉族人群聚集素 (CLU) 基因多态性及外周血CLU与阿尔茨海默病 (AD) 的关系。方法 纳入AD患者108例 (AD组) , 健康对照115例 (对照组) , 应用SNaPshot SNP分型技术对入选11个位点进行分型, 采用双抗体夹心酶联免疫吸附试验 (ELISA) 检测AD组与对照组外周血清CLU水平。结果AD组血清CLU水平显着高于对照组, 差异有统计学意义 (P=0.001) 。CLU基因SNP位点rs3087554在显性模型下差异有统计学意义 (P=0.037, OR=0.523, 95%CI=0.2840.962) , 其余8个位点各基因型和等位基因在病例组和对照组的分布无差异。CLU基因型和血清CLU水平相关性分析未发现显着性差异。结论AD患者血浆CLU水平较对照组明显升高, CLU可能在AD的发生发展中发挥作用。CLU rs3087554位点CC或CT基因型可能是AD的保护性因素。未发现其他8个SNP多态性与疾病的联系。
关键词: 阿尔茨海默病; 聚集素; 单核苷酸多态性;
Abstract: Objective To assess the correlation between the clusterin (CLU) level and its gene polymorphism and Alzheimer′s disease (AD) among ethnic Han Chinese in southwest of China.Methods A total of108 patients with AD (AD group) and 115 healthy controls (control group) were enrolled in this study.SNaPshot SNP typing was used to genotype 11 SNP.Serum levels of CLU were detected by ELISA.Results The clustrin level of peripheral blood in AD group was significantly higher than that in the control group (P=0.001) .There were statistically significant differences of the rs3087554 locus of CLU gene in the dominant model (P=0.037, OR=0.523, 95%CI=0.284-0.962) .There was no significant difference in the distribution of other eight loci genotypes and alleles between AD group and control group.No significant association were found between genotypes and serum CLU levels.Conclusion The plasma levels of CLU in AD patients are significantly higher than those in control group.CLU may play a role in the occurrence and development of AD.CC or CT genotype of rs3087554 in CLU gene may be a protective factor of AD.No association was found between the other eight SNPs and AD disease.
Keyword: Alzheimer′s disease; clusterin; single nucleotide polymorphism;
目前, 阿尔茨海默病 (AD) 是全球的第六大死因, 发病人数超过4 400万人[1]。按照目前全球人口发展速度, 到2050年, AD患者数量预计达1.16亿[2]。AD作为老年人常见的精神疾病, 给政府、社会和患者家庭带来极大的负担。
迄今为止, AD的发病机制仍在探索中, 其中主要的学说是β淀粉样蛋白学说[3]和Tau学说[4,5]。AD的组织病理学特征包括β-淀粉样蛋白和神经原纤维缠结 (NFTs) 的形成, 突触损失, 大脑炎症, 神经元损失, 最终导致脑实质收缩[6]。单核苷酸多态性 (SNP) 是人类DNA的第三代遗传标记, 是在基因组水平上由于单个核酸的变异所引起的DNA序列的多态性, 也是决定人类疾病 (尤其是多基因疾病) 易感性, 以及个体对药物反应差异性的主要因素。AD归因于多因素导致的神经退行性改变, 遗传因素和环境因素共同影响发病, 基因多态性在AD的发生发展中有着重要的影响。研究先后发现了早老素1 (PS1) [7]、早老素2 (PS2) [8]、淀粉样前体蛋白 (APP) 等[9]单一致病基因与AD相关。但目前仅载脂蛋白E (APOE) ε4等位基因被多个不同群体广泛证实为迟发型AD (LOAD) 与散发型AD (SAD) 的易感基因[10]。2009年以后, 2项GWAS研究证实CLU基因rs11136000位点和LOAD相关[11,12]。同时研究发现聚集素 (CLU) 基因rs9331888位点多态性与LOAD易感性显着相关。基于此研究基础, 本实验拟通过测定中国汉族人群中AD组与健康老年人组的血浆CLU水平及CLU基因多个位点多态性, 探讨中国汉族人中CLU基因多态性及血浆CLU水平与AD的关系。
1、 资料与方法
1.1、 一般资料
收集四川大学华西医院2016年8月至2017年3月门诊及住院AD患者109例作为AD组, 年龄>65岁, 为LOAD, 其中男52例, 女57例, 平均年龄 (78.69±10.55) 岁。采用简易智能状态量表 (MMSE) 评定患者痴呆情况, MMSE在相应教育程度分值以下为痴呆 (文盲≤17分, 小学文化≤20分, 初中及以上文化≤24分) 。符合美国国立神经病学、语言障碍和卒中研究所AD和相关疾病学会 (NINCS-ADRDA) 制定的AD诊断标准, 世界卫生组织生活质量测定简表 (WHOQOL-BREF) 临床痴呆评定量表 (CDR) 评分>1分, Hachinski缺血指数量表评分<4分。排除标准: (1) 患有其他中枢神经系统; (2) 其他系统病变所致痴呆患者; (3) 前列腺癌、非小细胞肺癌、乳腺癌、肝癌等肿瘤病史; (4) 甲状腺功能低下、抑郁症患者。另选取四川大学华西医院体检中心体检健康老年人115例作为健康对照组, 其中男58例, 女57例, 平均年龄 (73.09±6.10) 岁。患者采用神经心理学检查未发现认知功能损害, MMSE评分>24分。
1.2、方法
CLU水平测定:收集3mL外周静脉血, 离心取血清, 置于PC管中, 采用CLU检测试剂盒 (美国RayBio) ELISA方法测定。基因多态性检测:采用基因组DNA提取试剂盒 (Qiagen) 提取全血DNA。应用Hapmap数据库 (http://hapmap.ncbi.nlm.nih.gov/) dbSNP数据库 (http://www.ncbi.nlm.nih.gov/snp) 和天昊生物SNP Annotation软件 (http://www.geneskybiotech.com/sup/software/) , 优先纳入基因外显子区、启动子区、非翻译区 (UTR) 及侧翼区的功能调控性的tagSNPs, 再纳入其他能代表3个SNPs位点以上的tagSNPs, 结合国内外文献, 纳入CLU基因上的11个SNPs位点 (rs9331949、rs9331942、rs3087554、rs2279590、rs9331938、rs9331936、rs11136000、rs1532278、rs9331896、rs9331888、rs9314349) , 位点信息见表1。基因多态性检测采用SNaPshotSNP分型方法 (引物序列及SNaPshot引物见表2) , 随机抽取5%的样本进行双盲实验, 验证SNPs分型的重复性及稳定性。
表1 入选位点信息
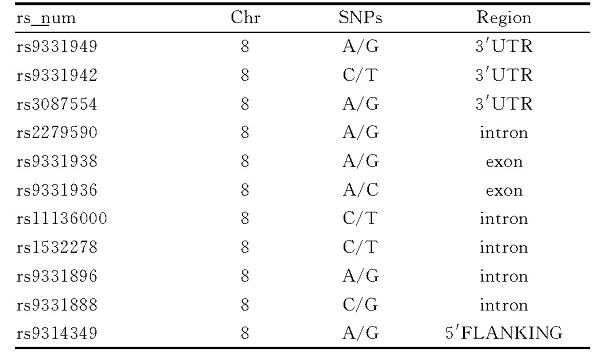
表2 11个SNPs位点的PCR扩增引物及SNaPshot检测引物序列

1.3、 统计学处理
采用SPSS20.0软件进行统计学处理, 对于连续性数据, 根据数据分布是否服从正态分布分别使用t检验和非参数的Wilcoxon检验。对于二分类数据, 采用Pearson卡方进行统计检验, 必要时采用Fisher精确概率法。应用Person相关分析探讨基因型与血清CLU水平的关系。等位基因及基因型、遗传模型的分析采用Plink软件。P<0.05为差异有统计学意义。
2、 结果
2.1、 AD组和对照组的一般情况与CLU水平比较
比较AD组和对照组的一般情况 (性别、年龄) 与CLU水平, 结果见表3。两组性别比例比较, 差异无统计学意义 (P>0.05) , 两组年龄比较, 差异有统计学意义 (P<0.05) 。AD组外周血CLU水平较对照组明显增高, 差异有统计学意义 (P<0.05) 。采用logistic回归校正后, 两组年龄和CLU水平差异仍具有统计学意义 (P=0.000、0.001) 。可初步认为, CLU和年龄均是AD发病的独立危险因素。
2.2、 最小等位基因频率 (MAF) 及哈勃-温格平衡检验 (HWE检验)
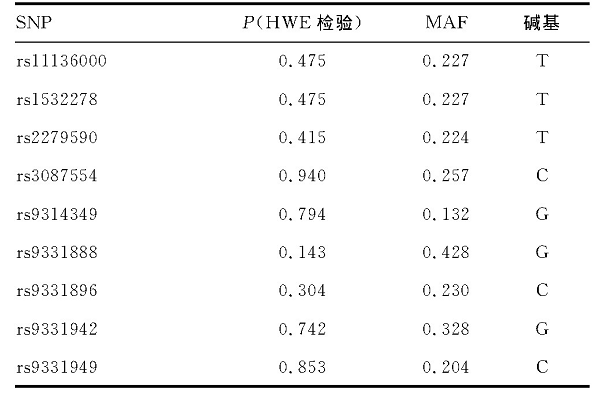
为说明AD组和对照组等位基因的代表性, 对该两组的基因型进行HWE检验, rs9331936、rs9331938的MAF为0, 且不符合HWE平衡, 其余9个位点均符合, 见表4。
表3 AD组和对照组一般情况及外周血CLU水平比较
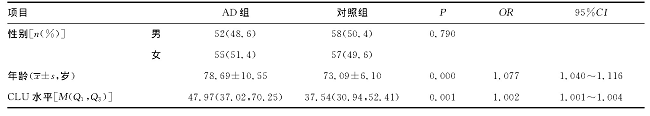
表4 所选9个SNP位点的MAF和HWE平衡检验
2.3、】 等位基因频率及基因型分布
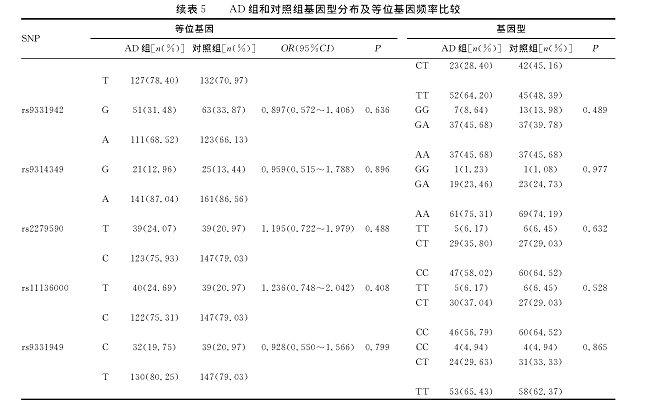
AD组和对照组等位基因频率见表5, 所选9个位点差异均无统计学意义 (P>0.05) 。
2.4、 遗传模型分析
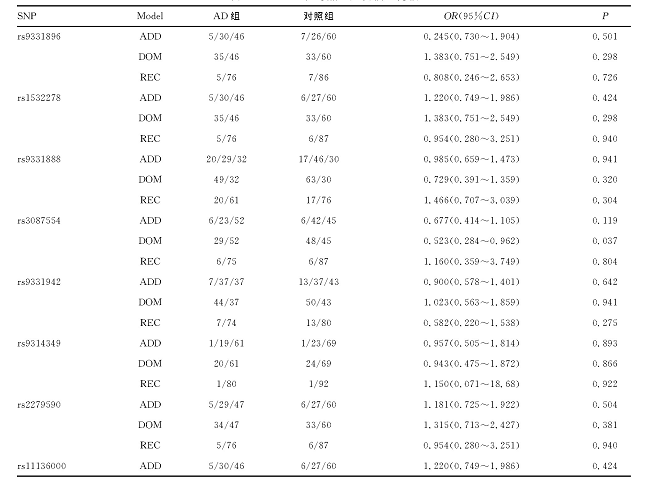
进一步对AD组对照组的遗传模型加以分析, rs3087554在显性模型下差异具有统计学意义 (P=0.037, OR=0.523, 95%CI=0.284~0.962) , 表明基因型为CC或CT的AD发病风险是基因型为TT的0.523倍, 可降低AD的发病风险。其余位点差异无统计学意义 (P>0.05) 。见表6。
2.5、 基因型与病例组MMSE评分的相关性
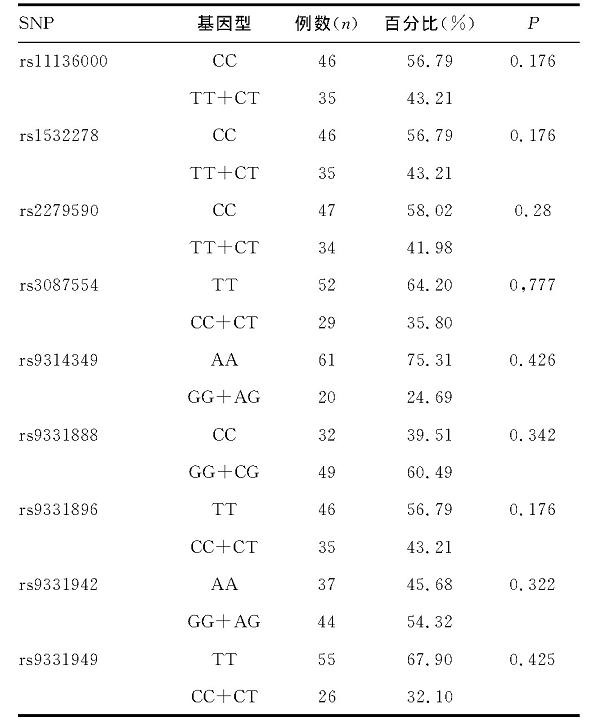
为进一步明确基因型与病情严重程度之间的相关性, 将所选9个位点与病例组MMSE评分进行统计学分析, 差异无统计学意义 (P>0.05) 。见表7。
表5 AD组和对照组基因型分布及等位基因频率比较

表6 AD组和对照组遗传模型比较
注:ADD表示加性模型, DOM表示显性模型, REC表示隐形模型
表6 AD组和对照组遗传模型比较
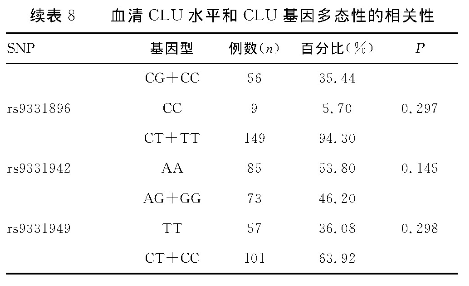
2.6、 基因型与CLU水平的相关性
将基因型列为二分类, 分析SNP基因型与血清CLU水平之间的关系, 差异无统计学意义 (P>0.05) 。见表8。
表7 CLU基因多态性与AD组MMSE评分的关系
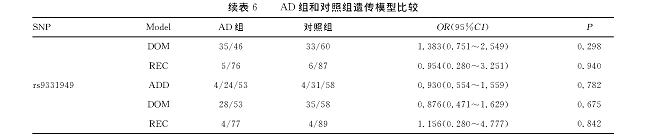
表8 血清CLU水平和CLU基因多态性的相关性
3、 讨论
CLU又称载脂蛋白J, 是由BLASCHUK等[13]在1983年从山羊睾丸网液中首次分离出的一种特殊的糖蛋白, 存在于大脑、血浆、肝脏和脑脊液中[14], 它与载脂蛋白E有着类似的生物学功能, 能促进Aβ聚集, 介导Aβ的清除[15], 同时也参与炎性反应[16], 细胞凋亡[17]等一系列病理反应过程。研究表明, CLU参与多个疾病的进展, 如肝癌[18]、膀胱癌[19]、鼻咽癌[20]、帕金森病[21]等。
本研究采用病例-对照的研究方式, 关注健康人和AD患者的血清CLU水平的关系。研究发现, 在AD组中, 血清CLU的水平明显高于对照组, 提示检测外周血CLU水平可作为诊断AD的一种方法, 并有研究表明, CLU水平在疾病早期升高可加速疾病的进展, 表示CLU可作为监控疾病进展的分子标志物[22]。同时, 在校正其他因素后, 可发现年龄对AD的发病具有统计学差异。故可初步认为, CLU和年龄均是AD发病的独立危险因素。对于年龄与CLU是否具有相关性分析发现, 二者不具有相关性, 与CAI等[23]报道一致。
CLU基因位于8号染色体p21.1。本次对于CLU基因多态性的研究, 9个位点中, 除rs3087554外, 其余位点在等位基因频率、基因型分布、遗传模型方面差异无统计学意义 (P>0.05) 。2009年两项欧洲大样本病例对照研究已证实在高加索人群中, rs11136000与AD发病相关联。2010年我国北方的一项研究证实, 在中国北方汉族人群, 未发现rs11136000与AD的关系, 但发现rs9331888等位基因G可增加AD的风险, 但本实验均未发现统计学差异[24]。另外, 本研究结果发现, CLU基因SNP位点rs3087554在显性模型下差异有统计学意义 (P=0.037, OR=0.523, 95%CI=0.284~0.962) , 表明基因型为CC或CT的AD发病风险是基因型为TT的0.523倍, 可降低AD的发病风险, 表现了基因多态性对遗传调控的神经退行性疾病的影响, 并提示该作用可能是确定复杂疾病遗传性的关键。DU等[25]关于rs11136000和LOAD易感性的meta分析发现, T等位基因的存在可能降低白种人和亚洲人群的LOAD风险, 但在非洲或西班牙裔人群中并没有发现明确的关联, 说明对于种族差异对于基因多态性的影响。本次研究结果与部分报道结果不一致考虑可能是样本的选取具有种族差异性或地区差异性, 选取人群主要为西南地区人群。
4、 结论
AD起病隐匿、复杂, 且目前发病机制仍不清楚, 没有有效的治疗方案, 所以早期诊断对于控制AD的疾病发展过程具有极大的临床意义。目前的研究都在力求寻找一个新的生物标志物以便能尽早的对于AD做出早期诊断, 本研究发现的rs3087554可作为一个新的分子标志物, 并且多个位点的研究补充了人们对AD易感性相关SNP的认识。
参考文献:
[1]MARTINO RMCD, SIMONE A D, ANDRISANO V, et al.The versatility of the curcumin scaffold:discovery of potent and balanced dual BACE-1and GSK-3βinhibitors[J].J Med Chem, 2016, 59 (2) :531.
[2]DULSAT, C.A report from the 65th annual meeting of the American Academy of Neurology (March 16-23, 2013, San Diego, California, USA) [J].Drugs Today (Barc) , 2013, 49 (5) :341-345.
[3]WANNER M, KESSLER J, MARTIG J, et al.Amyloid deposition as the central event in the aetiology of Alzheimer′s disease[J].Trends Pharmacol Sci, 1991, 12 (10) :383.
[4]BLENNOW K, HAMPEL H.CSF markers for incipient Alzheimer′s disease[J].Lancet Neurol, 2003, 2 (10) :605-613.
[5]陈逸, 张宝荣.阿尔茨海默病相关核心生物标志物研究进展[J].生命科学, 2014, 26 (1) :2-8.
[6]LARS M.ITTNER, JRGEN G.Amyloid-βand tau:a toxic pas de deux in Alzheimer′s disease[J].Nat Rev Neurosci, 2011, 12 (2) :65.
[7]GOATE A, CHARTIER-HARLIN M C, MULLAN M, et al.Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer′s disease[J].Nature, 1991, 349 (6311) :704-706.
[8]BRUNI A C.Cloning of a gene bearing missense mutations in early onset familial Alzheimer′s disease:a Calabrian study[J].Funct Neurol, 1998, 13 (3) :257-261.
[9]ROGAEV E I, SHERRINGTON R, ROGAEVA E A, et al.Familial Alzheimer′s disease in kindreds with missense mutations in agene on chromosome 1related to the Alzheimer′s disease type 3gene[J].Nature, 1995, 376 (6543) :775-778.
[10]OSSENKOPPELE R, FLIER W M V D, ZWAN M D, et al.Differential effect of APOE genotype on amyloid load and glucose metabolism in AD dementia[J].Neurology, 2013, 80 (4) :359-365.
[11]LAMBERT J C, HEATH S, EVEN G, et al.Genomewide association study identifies variants at CLU and CR1associated with Alzheimer′s disease[J].Nature Genetics, 2009, 41 (10) :1094-1099.
[12]HAROLD D, ABRAHAM R, HOLLINGWORTH P, et al.Erratum:genome-wide association study identifies variants at CLU and PICALM associated with Alzheimer′s disease[J].Nat Genet, 2009, 41 (10) :1094.
[13]BLASCHUKO, BURDZYAK, FRITZIB.Purification and characterization of a cell aggregating factor (clusterin) , the major glycoprotein in ramretetestis fluid[J].Biol Chem, 1983, 258 (12) :7714.
[14]MULLAN G M, MCENENY J, FUCHS M, et al.Plasma clusterin levels and the rs11136000genotype in individuals with mild cognitive impairment and Alzheimer′s disease[J].Curr Alzheimer Res, 2013, 10 (9) :973.
[15]MINERS J S, CLARKE P, LOVE S.Clusterin levels are increased in Alzheimer′s disease and influence the regional distribution of Aβ[J].Brain Pathol, 2016, 27 (3) :305-313.
[16]PLUTA R.Role of ischemic blood-brain barrier on amyloid plaques development in Alzheimer′s disease brain.[J].Curr Neurovas Res, 2007, 4 (2) :121.
[17]WONG P, PINEAULT J, LAKINS J, et al.Genomic organization and expression of the rat TRPM-2 (clusterin) gene, agene implicated in apoptosis[J].J Biol Chem, 1993, 268 (7) :5021.
[18]ZHENG W, YAO M, SAI W, et al.Diagnostic and prognostic significance of secretory clusterin expression in patients with hepatocellular carcinoma[J].Tumor Biol, 2016, 37 (1) :999-1008.
[19]MIYAKE H, HARA I, KAMIDONO S, et al.Synergistic chemsensitization and inhibition of tumor growth and metastasis by the antisense oligodeoxynucleotide targeting clusterin gene in a human bladder cancer model[J].Clin Cancer Res, 2001, 7 (12) :4245-4252.、
[20]LI Y, LU J, SHAN Z, et al.Clusterin induced by N, N′-Dinitrosopiperazine is involved in nasopharyngeal carcinoma metastasis[J].Oncotarget, 2016, 7 (5) :5548-5563.
[21]PRIKRYLOVVH, HNYKOVE, MAREJ, et al.Clusterin CSF levels in differential diagnosis of neurodegenerative disorders[J].J Neurol Sci, 2016, 361:117-121.
[22]THAMBISETTY M, BEASON-HELD L L, AN Y, et al.Alzheimer risk variant CLU and brain function during aging[J].Alzheimers Dement, 2013, 73 (5) :399.
[23]CAI R, JING H, JIE S, et al.Plasma clusterin and the CLU gene rs11136000variant are associated with mild cognitive impairment in type 2diabetic patients[J].Front Aging Neurosci, 2016, 8:179.
[24]YU J T, LI L, ZHU Q X, et al.Implcation of CLU gene polymorphisms in Chinese patients with Alzheimers disease[J].Clin Chim Acta, 2010, 411:1516-1519.
[25]DU W, TAN J, XU W, et al.Association between clusterin gene polymorphism rs11136000 and late-onset Alzheimer′s disease susceptibility:a review and metaanalysis of case-control studies[J].Exp Ther Med, 2016, 12 (5) :2915-2927.
- 相关内容推荐
- 阿尔茨海默病与轻度认知障碍病人情景记忆编码和提取变化2014-10-16
- 观察parkin对阿尔茨海默病转基因果蝇模型的保护作用2015-01-13





