
黄鳍金枪鱼(Thunnus albacares) 广泛分布于太平洋、印度洋和大西洋,是一种高度洄游的商业性大洋鱼类。黄鳍金枪鱼肉质鲜美,营养价值较高,已成为当前世界海洋渔业重要对象之一。随着捕捞技术的提高及捕捞强度的加大,黄鳍金枪鱼的资源量已经处于过度捕捞的状态。清楚认识黄鳍金枪鱼的种群遗传结构将有助于掌握其生活史、估算种群数量及资源变动,从而为黄鳍金枪鱼资源的可持续利用和开发提供科学依据。为此,不同的学者采用了标志重捕技术、形态学手段和分子标记等方法对黄鳍金枪鱼种群遗传结构进行了研究,得出的结论并不一致。
线粒体 DNA(mtDNA) 结构简单、进化速率快,尤其是控制区变异最大,变异积累较高,被广泛应用于鱼类种群遗传结构和遗传变异的研究。本文对太平洋中部的7 个采样群体,通过分析 mtDNA D-loop 基因序列,研究其遗传多样性和遗传结构,并对其系统地理格局进行初步的探讨,以期为太平洋黄鳍金枪鱼资源的合理开发、管理和保护提供理论依据。
1、 材料与方法
1. 1 样本采集
2010 年 9 月 - 2012 年 1 月我国远洋渔业船队在太平洋采集到的 101 尾黄鳍金枪鱼样本,其中西部太平洋 3 个采样点,分别命名为 WPO1-WPO3; 东部太平洋 4 个采样点,分别命名为EPO1-EPO4(表 1、图 1) 。剪取黄鳍金枪鱼尾部的肌肉组织样本,将其固定在装有 95% 乙醇的离心管并冻存于 -20 ℃冰箱,备用。

1. 2 DNA 的提取、扩增及测序
采用组织/细胞基因组 DNA 快速提取试剂盒(北京艾德莱生物科技有限公司) 提取肌肉组织 DNA,洗脱缓冲液 EB 溶解,1. 0% 琼脂糖凝胶电泳检测 DNA 质量,紫外分光光度计测定 DNA浓度,-20 ℃保存备用。D-loop 基因扩增引物为TACRF: 5'-AACAACTAAATCGTCTAAGCCATACCAA-3',TACRR: 5'-ATACCCCACTCGAGATTTTCCTGTT-3'。PCR 反应中,1. 0 × PCR 反应缓冲液 2μL; 模板 DNA(50 μg/μL) 1 μL; Taq 酶(5 U/μL)0. 12 μL; dNTP (2. 5 mmol / L) 1. 6 μL; 引物 (10μmol/L) 各 0. 5 μL; 剩余用 ddH2O 补足至 20 μL。
PCR 扩增在 Eppendorf 热循环仪上进行,条件为:94 ℃ 预变性 3 min; 94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1min,共 30 个循环; 72 ℃ 延伸 10 min; 4 ℃ 保存。PCR 产物由上海生工生物工程技术服务有限公司进行测序。
1. 3 数据分析
测序结果使用 Clustal X 1. 83软件进行比对并辅以人工校对。利用 Network 软件构建单倍型间的系谱关系,系统进化树采用 PUAP 软件构建,重复计算 1 000 次,从 NCBI 下载北方蓝鳍金枪鱼 (Thunnus thynnus ) ,南方蓝鳍金枪鱼(Thunnus maccoyii) 和青干金枪鱼 (Thunnustonggol) 3 个物种线粒体上控制区的部分序列作为外群,对应序列号为 EU562825、GU256523 和HQ425780。单倍型数、单倍型多样性指数(h) 与核苷酸多样性指数(π) 、碱基不配对分布曲线由软件 DnaSP version 4. 00处理。不同群体间遗传分化指数 Fst、AMOVA 分析、Tajima’s D 和 Fu’s Fs 检测和基因分化参数由 ARLEQUIN version3. 0计算,其中Fst的显著性检验经过Bonferroni校正,显著性水平为 P < 0. 05,极其显著水平为 P <0. 01; 种群扩张时间推算公式:T = τ /2μ (1)式中: τ 是根据广义非线性最小二乘法所估算的种群扩张参数; μ 是基因序列每一世代的突变率。
基因流(Nm) 计算公式为:Nm= (1 / Fst- 1) /4 (2)式中: Fst表示遗传分化指数。
2、 结果
2. 1 D-loop 序列多样性
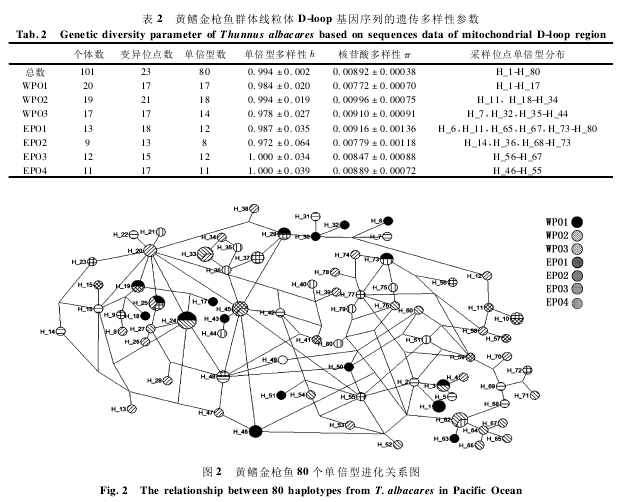
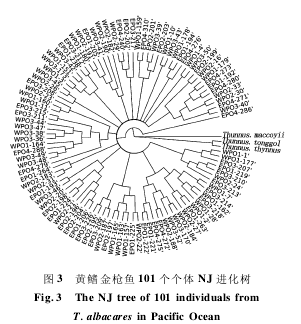
太平洋中部 7 个采样位点获得的 101 个样本,经 PCR 扩增、产物纯化和序列测定,结果显示,101 个样本中共发现 23 个变异位点,定义 80个单倍型(表 2) 。在获得的 80 个单倍型中,定义为 H_1-H_80,其中大多数单倍型为某个群体所特有。WPO2 群体拥有 12 个单倍型,而群体EPO4 具有单倍型数最少,仅为 8 个(表 2) 。单倍型进化网络分析显示(图 2) ,80 个单倍型中并没有显著的单倍型分化格局,NJ 系统树(图 3) 同样没有明显的遗传分化拓扑结构。遗传多样性分析结果显示,所有群体单倍型多样性(h) 和核苷酸多样性(π) 分别为 0. 994 ± 0. 002 和0.008 92 ±0. 000 38(表 2) 。
2. 2 遗传变异分析
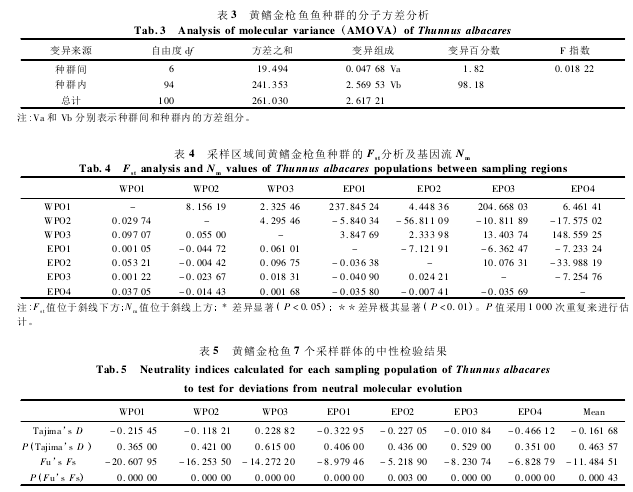
7 个采样群体的 AMOVA 检验发现,98. 18%的变异是发生在群体内部(表 3) 。7 个采样群体的两两群体间 Fst范围在 0. 001 05 ~0. 097 07 之间(表 4) ,其中,检验经过 Bonferroni 校正后,所有群体的两两群体间的显著性检验都不显著(P > 0. 05) 。除了 WPO1 与 WPO3(2. 32546) ,WOP3 与 EPO2(2. 33398) 外,各群体间的基因流指数都大于 3,表明 7 个采样群体间有着广泛的基因交流。
2. 3 研究群体的群体扩张分析
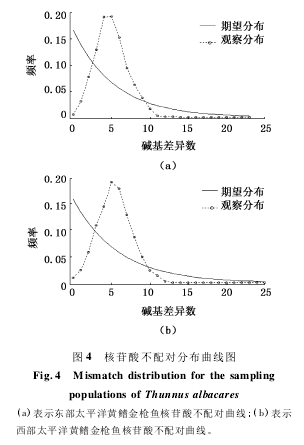
7 个采样群体的中性检验(表 5) 结果显示,除了 WOP3 群体的 Tajima’s D 为非显著的(P =0. 615) 正值之外,其他的 Tajima’s D 均为非显著的(P >0. 05) 负值。而 7 个采样群体的 Fu’s Fs均为极显著的(P < 0. 01) 的负值。通常情况下,显著的 Tajima’s D 和 Fu’s Fs 负值,表明群体发生过扩 张,但 是 在 缺 乏 背 景 选 择 的 情 况 下,Tajima’s D 会出现非显著的负值,而 Fu’s Fs 为显著的负值,表明群体发生过扩张。7 个群体核苷酸不配对分布曲线呈现明显的单峰(图 4) ,表明群体近期发生过扩张。
3 讨论
3. 1 黄鳍金枪鱼的遗传分化与遗传变异性
单倍型多样性指数和核苷酸多态性是衡量一个群体 mtDNA 遗传变异的重要指标,π 反映了各种 mtDNA 单倍型在群体中所占的比例,在揭示群体 mtDNA 遗传多样性方面优越于单纯的单倍型遗传距离(D)[20]。本研究结果显示,7 个采样群体呈现较高的平均单倍型多样性指数(h =0. 994 ± 0. 002) 和较低的核苷酸多样性指数(π =0. 008 92 ± 0. 000 38) 。根据 GRANT 和 BOWEN推测的鱼类群体的 4 种进化格局,黄鳍金枪鱼可能是由小的遗传群体经历一段时间的稳定后扩张,群体的快速增长保持了较高的单倍型多样性和降低了核苷酸多样性。
种群间和种群内的有效变异,能够保持种群的自然分布范围,防止突发性的种群灭绝。
AMOVA 分析显示,98. 18% 的变异是发生在群体内部,只有 1. 82% 的变异发生在群体间,表明变异的发生主要在群体内部,对于突发性群体灭绝的抵抗能力较弱。两两群体间的 Fst分析显示,所有群体的两两群体间的 Fst分析都是非显著的,Nm值都相对较大,基本上都是大于 3,表明了黄鳍金枪鱼 7 个群体之间的基因交流比较频繁,可以认为所研究的群体为同一种群(表 4) 。另外,基于 101 个样本定义的 80 个单倍型构建的单倍型网络进化图(图 2) ,呈现错综复杂的交叉网络结构,基于 101 个个体构建的 NJ 进化树(图3) 并没有显示出明显的遗传谱系分化。由此推断,研究样本中的 101 个样本分属同一个种群,东部太平洋和西部太平洋之间不存在显著的群体分化。
海洋作为一个大的水体,鱼类能够相对自由地运动,鱼卵和幼体鱼随海流运动而运输,因此海洋鱼类群体的遗传分化一般相对较低,不易形成显著的遗传分化[22]。为此,本研究的中西太平洋和中东太平洋黄鳍金枪鱼群体间较小的遗传分化可以归因于个体间频繁的基因交流,这也可以由较大的 Nm得到验证(表 4) 。
赤道 0°线附近有自东向西的冷水舌伸展,10°线附近有暖水自西向东扩展延伸,冷暖水团交汇形成强烈的辐合区,容易形成高的浮游生物富集区,诱使渔场的形成。中部太平洋具备冷暖水团交汇的特点,太平洋中部海域黄鳍金枪鱼在产卵季节进入冷暖水团交汇海域,并进行繁殖,使得东部和西部群体间的基因交流较高,进一步同较大的基因流结果相互验证。
通常,群体遗传多样性与其适应性、生存和进化潜力密切相关,遗传变异是有机体适应环境变化的必要条件。相关研究认为,动物群体遗传多样性与个体大小成负相关,个体越大,生命周期越长,繁殖周期就越长,而遗传变异就越小。本研究发现黄鳍金枪鱼群体遗传多样性水平偏低,可能是由于黄鳍金枪鱼属于大体型、长生命周期鱼类,本身具备小的变异。外界因素上,巨大的捕捞压力使得补充群体的逐渐减少,资源量下降,致使群体遗传多样性下降。
3. 2 黄鳍金枪鱼种群的扩张
种群的历史性演化通常采用碱基不配对分布曲线、Tajima’s D 和 Fu’s Fs 来检测。在本研究中,Tajima’s D 和 Fu’s Fs 都 呈 现 负 值,Tajima’s D 显著性检验并不显著,而 Fu’s Fs 显著性检验显著。Tajima’s D 反映的是较长时间的种群事件,Fu’s Fs 则是对种群的近期事件相对比较敏感。在缺乏背景选择的情况下,非显著的 Tajima’s D 负值和显著的 Fu’s Fs 同样是种群扩张的表现,所以本研究的中性检测结果表明了研究群体发生过近期的群体扩张,同朱叶的研究结果相似。碱基不配对分布曲线呈明显的单峰则被认为种群经历了历史扩张,本研究结果显示,东部群体和西部群体的核苷酸不配对分布曲线都呈现明显的单峰(图 3) ,表明黄鳍金枪鱼种群体经历了历史的扩张。依据碱基突变率μ = 1. 1 × 10- 7,τ 取 3. 68 ~5. 98 之间,依据τ = 2μT,得 T = τ /2μ,计算扩张时间大约在 335 ~554 万年前。此时期正处于更新世与上新世的边缘,由更新世的冰期变化向着上新世的稳定气候转化,表明太平洋黄鳍金枪鱼群体在更新世冰期的影响下,发生了群体遗传结构的巨大变化; 进入上新世后,由于气候、温度和地质上的稳定,使得群体发生迅速的扩张,同有关学者研究更新世冰期的气候变化对于海洋鱼类的种群遗传结构产生的影响结果高度一致。核苷酸不配对分布曲线(图 3) 和 Fu’s Fs 检测结果(表 5) 高度一致,证明了黄鳍金枪鱼群体发生过群体扩张。
3. 3 黄鳍金枪鱼资源现状和应对策略
渔业资源的下降,使得渔业管理组织的保护措施进一步得到加强,黄鳍金枪鱼的捕捞配额得到进一步的控制。近年来,不同的渔业管理组织对黄鳍金枪鱼资源的养护采取了一序列的措施,黄鳍金枪鱼渔业管理得到落实,捕捞配额得到限制,但是,有关学者对金枪鱼的研究中,依旧指出黄鳍金枪鱼处于过度捕捞的状态,整体渔业资源的现状还是不容乐观。
MACKENZIE 等认为,沿用单一的管理策略管理多种群结构的渔业种群,将会使地中海地区的黄鳍金枪鱼失去原有的种群结构。由此可见,种群的遗传结构对渔业管理有着至关重要的作用,因此必须加大对金枪鱼渔业研究的投入,通过对黄鳍金枪鱼种群遗传现状的了解和分析,进一步制定合理有效的措施,以促进科学管理、保护和可持续利用黄鳍金枪鱼渔业资源。从本研究的结果显示,太平洋中部海域的黄鳍金枪鱼群体并没有显著的遗传分化,属同一种群,针对本研究的结果提议,对太平洋中部海域黄鳍金枪鱼的渔业管理可以采用统一的、有效的措施进行合理的管理。
参考文献:
[1] 罗殷,王锡昌,刘源. 黄鳍金枪鱼食用品质的研究 [J].食品科学,2008,29(9) : 476 -480.
[2] 廖圣赐. WPMFC 向 WCPFC 提出保护中西太平洋大眼、黄鳍金枪鱼资源的要求 [J]. 现代渔业信息,2006,21(3) :33 - 34.
[3] 黄斌. 世界主要金枪鱼类资源状况与管理 [J]. 现代渔业信息,2008,23(1) : 22 -25.





