
传统的动物生理生态学研究聚焦于比较同一生境不同物种的种间变异或环境因子梯度的反应, 并且习惯于通过增加样本量或提高测量精度而获得更为可靠的实验数据, 用评价指标的平均值作为这些变异的生物学统计基础, 以总结某些自然规律或揭示生命表面现象的内在机制.然而, 部分学者开始关注动物种内普遍存在的自然现象, 即种内存在个体变异[1, 2].稳定个体变异(Consistent IndividualDifferences, CIDs)是指动物表型(如生理、行为、形态)存在种内个体变异并且这种变异在一段时期内保持相对稳定(即可重复测量), 该方面的相关研究具有重要的生态和进化意义[1].
环境变迁、季节更替等易导致食物资源产生巨大时空异质性[3, 4], 动物在其生活史中常受到不同程度的饥饿胁迫, 并通过形态、生理和行为的调整以适应食物资源的短缺[4].游泳运动不仅是鱼类获取食物、寻找生境、繁衍后代、逃避敌害等生命活动的重要实现方式, 而且也是鱼类适合度的重要决定因素[5].依据是否对氧气的需求, 游泳运动可分为有氧运动和无氧运动两种类型, 前者与鱼类的日常活动(如巡游)、洄游等有关, 常用临界游泳速度(Ucrit)评价[6], 而后者则反映鱼类的暴发游泳能力, 与其捕食活动、逃逸敌害、穿越激流等生命活动密切相关, 可用暴发游泳速度(Ucat)[7]或数倍 Ucrit固定流速度下的耐受时间(Endurance)体现[8].鱼类游泳能力的种内个体变异已有报道, 如大西洋鳕(Gadus mor-hua Linnaeus)Ucrit和 Ucat的变异幅度分别达 64%和35%, 两种游泳能力的重复性较高且该种鱼的 Ucrit与 Ucat存在权衡[7].
南方鲇(S. meridionalis)是栖息于我国长江、珠江等流域的大型凶猛肉食性鱼类, 是食物链的顶级捕食者, 已成为经济养殖、能量代谢及游泳运动等方面的重要实验对象.有关该种鱼的生物学特征、摄食代谢、游泳能力和消化生理等方面的研究报道十分丰富[8-13], 然而有关该种鱼游泳能力的个体变异的研究尚未涉及.本研究试图回答以下两个问题:
(1)在实验室环境下南方鲇幼鱼有氧运动能力和无氧运动能力的个体变异及两者的关系; (2)如果环境中食物资源减少, 那么上述两种游泳运动能力的个体变异、稳定性和二者关系将发生怎样的变化.据此, 本研究以南方鲇幼鱼为实验对象, 考察该种鱼游泳能力的个体变异、重复性以及二者之间的关系及其对饥饿的响应, 为鱼类游泳生理学以及种内个体变异的相关理论研究提供有益资料.
1 材料与方法
1.1 实验鱼来源与驯化
本实验南方鲇幼鱼来源于西南大学水产科学研究所, 运回后分养于本实验室的 3 个循环控温水槽(1.2 m × 0.6 m × 0.6 m, 水容量约为 250 L)中.每个水槽的养殖数量约为 150 尾, 驯化时间为 1 个月.
在此期间, 以切碎、洗净的黄鳝(Monopterus albusZuiew)肉块为饵料, 每隔两天在 20:00 饱足投喂一次, 投饵 2h 后用虹吸管清除残饵及粪便.水槽水体为充分曝气 5d 后的自来水, 用空气泵向水槽持续泵入空气, 控制溶氧水平>7 mg/L.水槽的日换水量为驯化水体的15%(约为40 L), 水温控制在(25±0.5) ℃,光周期设定为 12 L︰12 D.
1.2 实验设计
驯养结束, 随意在 3 个驯化水槽中挑选出体形相当、鱼体健康的南方鲇幼鱼 60 尾, 装入实验室自行设计的多单元格养殖循环控温系统中, 每套系统包括 30 个独立养殖单元格(长×宽×高, 17 cm × 12 cm× 10 cm).实验处理分对照组和饥饿组, 每组 30 尾,饥饿时间为 2 周.研究发现大于 20 的样本量即可获得动物种群运动能力的最大均值[14].因此, 本研究设定的样本量(n=30)足以获得南方鲇幼鱼游泳能力的最大均值.对照组单尾鱼的投喂饵料仍为黄鳝肉块, 每两天于投喂一次(20: 00), 投喂量约为鱼体重的 4%-5%(此摄食水平范围由预备实验获得), 以使对照组南方鲇的体重保持相对稳定; 饥饿组实验鱼在 2 周期间无任何食物供给.对于对照组, 在最后一次摄食之后, 经历 48h 后的消化道内食物消化吸收完毕[12], 因此不影响实验鱼游泳能力的测定.
本研究共 2 次测定两实验组的每尾鱼的性能参数,即饥饿前(测定 Ⅰ )后(测定 Ⅱ ),分别对饥饿组和对照组单尾鱼测定体长和体重, 再用实验室自行设计游泳代谢仪测定单尾鱼的临界游泳速度、暴发游泳速度和固定流速下的耐受时间.实验期间, 多单元格养殖循环控温系统和游泳仪水体的环境条件[水温:(25 ± 0.5)℃、溶氧: (7.4 ± 0.3) mg/L、换水量: 约为40 L/d、pH: 7.5 ± 0.3、光周期: 12 L︰12 D]均与驯养水槽相同.对照组和饥饿组在实验期间分别有 2尾和 1 尾南方鲇幼鱼跳至地面而死亡, 故两个组的实际样本量分别为 28 和 29 尾.不论对照组还是饥饿组, 每组的所有实验鱼均要测定其 Ucrit、Ucat和耐受时间.对于单尾鱼而言, 在第一天上午先测定其耐受时间(数分钟), 然后在当天下午(间隔 8h 以上)测定该尾鱼的 Ucat.在第 2 天(间隔 12h 以上)再测定该尾鱼的 Ucrit.文献报道, 在无氧运动力竭后的 1h,鱼类白肌的三磷酸腺苷(ATP)和磷酸肌酸(PCr)已恢复到运动前水平[15]; 此外, 力竭运动后 8h 后鲇肌乳酸和血乳酸水平也已恢复运动前水平[16].因此, 本实验参数测定的设定不影响游泳能力指标的测定结果.
1.3 测定步骤与参数计算
(1) Ucrit测定: 将单尾鱼装入游泳代谢仪的游泳管中适应1h, 管内的水流速度为6 cm/s(约0.5 BL/s).Ucrit测定采用逐步提高法, 起始速度为6 cm/s, 每档的流速增量( V)为6 cm/s, 每档的游泳历时( T)为20min, 直致实验鱼力竭.力竭标准: 实验鱼因不能抵抗水流而后退且在游泳代谢仪尾端筛板处的停留时间在20s以上[17].在力竭之后, 取出实验鱼并测量其体高、体宽、体重、体长等相关形态学参数.由于所有实验鱼横截面积未超过水体横截面积的10%,无需进行水阻校正.Ucrit的计算公式[18]
如下:
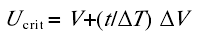
其中V是单尾鱼能够完成20min游泳历时的最高流速(cm/s), V是流速增量(6 cm/s), T是时间间隔(20min), t是实验鱼在流速为V+ V条件下的游泳历时(< 20min).
(2) Ucat测定: 该指标测定步骤参照Reidy等[7].将单尾鱼装入游泳代谢仪中适应 1h, 游泳管中的水流速度为 6 cm/s.然后以加速度 5 cm/(s·min)[19]增加流速, 直至实验鱼游泳力竭.力竭标准: 实验鱼因不能抵抗水流被冲至游泳管的尾端筛板且呈弯曲状, 此时的流水速度即为单尾鱼的暴发游泳速度[7].
(3) 固定流速耐受时间: 用以考察鱼类的暴发游泳能力[10].设定的固定流速(54 cm /s)约为 1.5 倍实验鱼 Ucrit平均值, 即 1.5 Ucrit[10], 该 Ucrit平均值[(36.7 ± 0.7) cm/s, n=10]在预备实验获得.将单尾鱼装于游泳管中适应 1h, 适应流速 6 cm/s.适应完毕后, 在5min内将流速匀速提高至1.5 Ucrit, 同时用秒表计时直至实验鱼游泳力竭, 力竭标准同 Ucat测定.
1.4 数据处理与统计分析
用 Excel (2003)对实验数据作常规计算并用Statistics (6.0)和 SigmaStat (3.5) 软件进行统计分析,统计值均以平均值±标准误(Mean ± SE)表示.同一时间对照组与饥饿组之间的数据以及饥饿期间同一组的数据均用 T-检验, 稳定性用 Spearman等级相关分析, 所有显着水平定为 P<0.05.
2 结 果
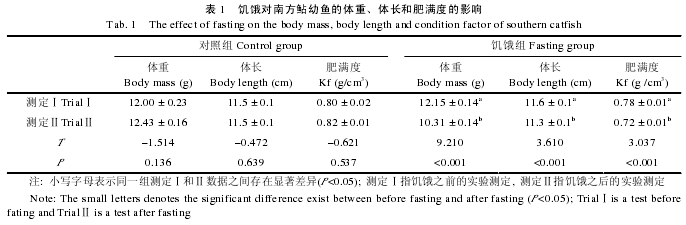
2.1 饥饿对外部形态的影响
在饥饿之前, 对照组的体重、体长和肥满度均与饥饿组的无显着变异(P>0.05).在饥饿之后, 对照组的形态参数均无明显变化(表 1, P>0.05).然而, 饥饿组的体重、体长和肥满度均分别显着下降了15.1%、2.6%和 7.9%(表 1, P<0.05), 其中体重的变化程度大于肥满度.
2.2 游泳能力的个性变异及其饥饿响应
在饥饿之前, 对照组的 Ucrit, Ucat和耐受时间分别 与 饥 饿 组 的 均 无 明 显 变 异 (Ucrit: T= –0.764,P=0.448; Ucat: T= –0.384, P=0.703; 耐 受 时 间 :T=0.253, P=0.801).饥饿之后, 对照组的 Ucat和耐受时间无明显变化(Ucat: T= –0.566, P=0.573; 耐受时间: T=0.308, P=0.760), 但 Ucrit下降 6.6% (Ucrit:T=2.216, P=0.031), 并且三个指标的 CV 的变化方向和程度不尽相同(表 2).然而, 饥饿组的 Ucrit和 Ucat分别显着下降了 26.0%和 13.7% (表 2, Ucrit: T=7.808,P<0.001; Ucat: T=4.145, P<0.001), 并且分别显着小于同一时间的对照组(Ucrit: T=6.050, P<0.001; Ucat:T=2.970, P=0.004).饥饿组 Ucrit的下降比例明显大于其 Ucat(T=3.639, P<0.001).另外, 饥饿组的 Ucrit、Ucat和耐受时间的 CV 均呈现相同的增加趋势, 分别从饥饿前的12.3、11.5和104.0增大至饥饿后的18.7、15.9 和 126.3, 并且 Ucrit的 CV 增大程度(52%)大于Ucat(38.3%)和耐受时间(21.4%).
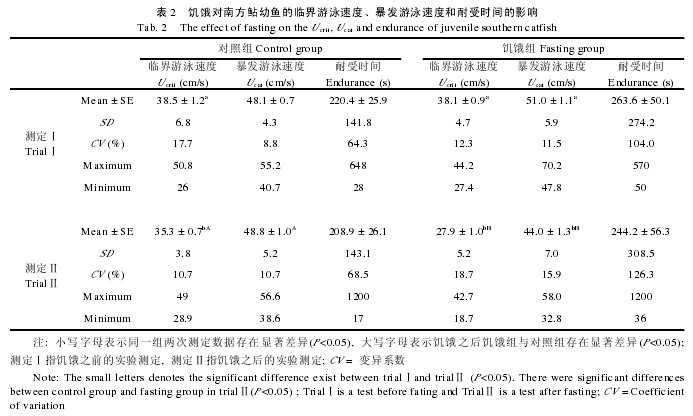
2.3 游泳能力的重复比例和相关性
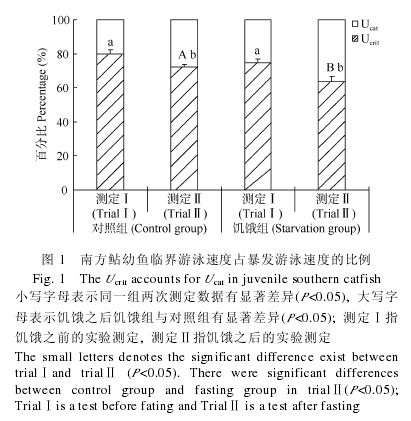
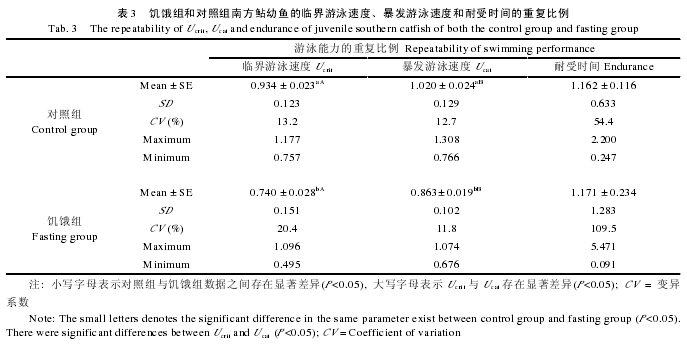
对照组的 Ucrit和 Ucat的重复比例分别显着高于饥饿组(表 3, Ucrit: T=6.552, P<0.001; Ucat: T=5.270,P<0.001), 但二者的耐受时间的重复比例并无明显变异(T=0.170, P=0.867).对照组的 Ucat明显大于Ucrit(T=2.623, P=0.014), 但二者均与耐受时间无显着变异.同样, 饥饿组的 Ucat也显着高于 Ucrit(T=4.053, P<0.001), 二者也均与同组耐受时间无显着变异(表 3).
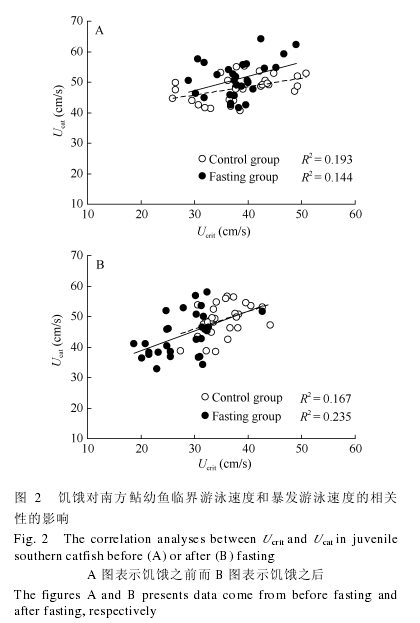
在饥饿之前, 对照组和饥饿组的 Ucrit/Ucat比例分别为 80.0%和 75.3%, 二者无明显变异(图 1,T=1.544, P=0.128).在饥饿之后, 饥饿组和对照组的Ucrit/Ucat的比例均有下降(对照组: T=2.789, P=0.010;饥饿组: T=4.469, P<0.001), 但饥饿组 Ucrit/Ucat下降比例的程度更为明显(图 1, 25.1% vs 8.6%; T=3.346,P=0.003).
在饥饿之前, 对照组和饥饿组的 Ucrit与 Ucat均呈现正相关, 对照组: Ucat=0.3414×Ucrit+ 46.572(R2= 0.193, n=28, P=0.015), 饥饿组: Ucat= 0.5895×Ucrit+ 40.793 (R2=0.144, n=29, P=0.041)(图 2A).在饥饿之后, 饥饿组和对照组的 Ucrit与 Ucat之间关系仍呈现正相关(图 2B), 对照组: Ucat=0.7009×Ucrit+35.877 (R2=0.167, n=28, P=0.031), 饥饿组 : Ucat=0.8028×Ucrit+ 32.136 (R2= 0.235, n=29, P=0.008).
3 讨论
3.1 南方鲇幼鱼的两种游泳能力的个性变异和重复性及饥饿影响.
传统生理生态学实验关注于特定处理的表型特征的平均值反应却忽略了种内个体变异的生态和进化意义[20].种内个体变异对于种群进化十分重要,这是因为生理(或形态、行为)表型特征的多样性不仅是遗传多样性的间接体现, 也是种群对环境多样性的适应表现和基因与环境相互作用的综合结果[21].
鱼类的两种游泳能力(有氧运动能力和无氧运动能力)存在明显的个体变异并且其与鱼的种类、食物丰度、溶氧和水温等因素密切相关.冬天驯化的大口黑鲈(Micropterus salmoides Lacepede)的 Ucrit和耐受时间(75%Ucrit)极值分别相差 42.8% (CV=9.7%)和 10倍(CV=65.1%), 而夏天驯化的则分别相差 33.7%(CV=7.2%)和 42 倍(CV=61.9%)[22]; 大西洋鳕的 Ucrit和 Ucat的极值相差分别为 64% (CV=14.2%)和 35%(CV=9.9%)[7]; 欧鲈(Dicentrarchus labrax Linnaeus)Ucat的变异程度约为 75% (CV=12.5%)[23]和 85.2% (CV=18.4%)[24]; 上述不同研究对象均在实验室条件下驯化的, 表明在均质环境下实验种群的表型特征的测定数据可反映野外种群表型特征的个体变异情况[7].
本研究对照组的 Ucrit、Ucat和耐受时间极值相差0.95、0.36 和 12.9 倍, 其中 Ucat的 CV (8.8)小于 Ucrit的(17.7).然而, 南方鲇幼鱼 Ucrit的变异系数大于大口黑鲈[20]和大西洋鳕[7], 耐受时间的变异系数(64.3%)与冬天驯化的大口黑鲈接近.环境食物丰度的变动必将影响动物的营养状况, 导致动物生理功能和组织结构的变化[4, 13].饥饿 2 周的南方鲇幼鱼的Ucrit显着下降了19.2%[25], 但低于本研究的 26.0%,而本研究饥饿组的 Ucat却仅降低 13.7%, 明显小于其 Ucrit.类似的结果出现在大西洋鳕, 该种鱼饥饿组的临界游泳速度的下降比例(38%)显着大于其暴发游泳速度(30%)[26].对于鱼类两种运动能力非平行变化的现象可能存在以下几原因: 首先, Ucat运动的能量底物依次动用白肌的 ATP、PCr 和糖原并且饥饿不影响前两种高能量物质的含量[27].在 Ucrit测定结束时, 摄食个体的游泳速度和肌肉的乳酸水平均明显高于饥饿个体 13 倍, 表明饥饿个体在 Ucrit过程中能动用能量底物的含量明显少于摄食个体[26]; 同时饥饿个体不仅具有较小的心脏和较低的心率, 而且具有较低含量的心室甘油三酯和糖原, 暗示饥饿个体在每单位时间内对红肌的供氧能力下降明显并会影响有氧运动能力[28], 这些因素导致鱼类无氧运动能力受饥饿影响的程度更小.此外, 饥饿组的三个游泳能力指标的变异系数均变大(表 2), 其中 Ucrit的增加幅度最大, 表明 Ucat对饥饿的反应程度较低而显得较为保守, 同时也说明饥饿会改变鱼类种群生理表型特征的个体变异, 可能有利于种群在整体上适应复杂多变的生存环境.然而这种不同类型运动能力非平行变化的现象是否普遍, 仍需要更多其它鱼类加以验证.
种内个体变异的研究内容之一是生理(或形态、行为)表型特征的稳定性, 包括稳定期和重复比例.稳定性关注的是单个实验动物的表型特征在每次测定结果的排序问题, 即使种群的表型特征在整体上的变动情况[2, 19].如果自然界动物种内个体表型特征的稳定性差, 可能不利于在自然选择压力下该种群表型特征的进化[5].研究报道, 大西洋鳕游泳能力的稳定期达 3 个月并且重复性好[7]; 欧鲈 Ucrit的稳定期介于 4 周[29]到 6 个月[23]; 孔雀鱼(Poecilia re-ticulate Peters)Ucrit和 Ucat的稳定期分别为 131d 和459d[5], 这些研究表明不同鱼类的游泳能力在不同的环境条件下的稳定期不尽相同, 且同一种鱼的Ucat的稳定期可能长于Ucrit, 暗示鱼类无氧运动能力的环境依赖性可能较低.在本研究中, 对照组南方鲇幼鱼 Ucrit和 Ucat的在 2 周内基本稳定, 由于实验设计的限制, 并没有进行更长时期稳定性测定, 但本研究表明 2 周是南方鲇幼鱼游泳能力的最短稳定期.研究显示, 数种鱼类 Ucat的重复性(0.890-0.943)大于 Ucrit(0.440-0.857), 并且 Ucrit的重复比例随测定时间间隔的增加而降低[5].然而, 本研究南方鲇游泳能力的重复性均低于上述研究报道.此外, 饥饿组 Ucrit和 Ucat的重复比例均分别显着低于对照组,而两者在耐受时间之间却无明显变异(表 3), 同时对照组和饥饿组的 Ucat也高于 Ucrit, 这也说明饥饿明显降低南方鲇幼鱼的游泳功能, 但不同类型的运动能力的反应程度不尽相同.
3.2 饥饿对南方鲇幼鱼两种游泳能力之间关系的影响
鱼类的有氧运动和无氧运动是两种不同的运动类型, 在自然界中具有明显不同的生态学意义.目前, 有关动物的有氧运动能力与无氧运动能力之间关系的假说主要有三个.(1)权衡假说(Trade-off hypothesis)[30]:如果动物个体的某种类型的运动能力较为突出, 那么其他类型的运动能力则较弱.该权衡可能存在于多数鱼类中, 这是因为动物个体不能同时使多种类型运动能力均达到最大化[31], 并且两种不同的鱼类运动能力的实现均需要动用同一运动系统(即肌肉系统)[32].支持该假说的研究对象包括大西洋鳕[7]和白斑狗鱼(Esox lucius Linnaeus)[33].(2)优秀运动员假说(Good athlete hypothesis)[34]: 某个运动员既擅长于某一种运动(如马拉松运动、篮球), 也擅长于其他类型运动(短跑、排球), 在大量人群中挑选出既无遗传因素作用也未经专业体育训练的普通人可能支持该假说.此外, 相关研究认为某些鱼类的有氧运动能力和无氧运动能力均较突出可能是以高的维持能量支出或其它生理功能如生长和消化的降低为代价[32].
支持该假说有束带蛇(Thamnophis sirtalis Linna-eus)[35]、大西洋鳕[26]和六种鲤科鱼类[32].(3)无相关假说(No correlation hypothesis)[23]: 鱼类的两种运动能力可能不存在任何相关, 这是因为有氧运动主要受限于循环系统的摄氧、运氧能力和体内能量利用效率, 而无氧运动主要是靠肌肉中 ATP、磷酸肌酸和糖酵解等有效动员.支持该假说有欧鲈[23]和孔雀鱼[36].在本研究中, 南方鲇幼鱼的 Ucrit和 Ucat呈现正相关, 并且在饥饿 2 周后二者关系仍呈现正相关, 支持优秀运动员假说, 这与本实验室前期的研究结果一致[32], 表明此发育阶段的南方鲇幼鱼(约12 cm)是游泳运动的"多面手"(Generalist), 可能与它有意搜寻水体或追击猎物而快速生长的生态特征有关[8].
鱼类的 Ucat明显高于 Ucrit, 如大口黑鲈的相差30%[37], 虹鳟(Oncorhynchus mykiss Walbaum)的相差比例介于 20%-60%[19], 大西洋鳕的相差 77%[7].在本研究中, 饥饿之前对照组和饥饿组南方鲇幼鱼的分别相差 30.7%和 35%, 饥饿之后饥饿组相差比例增加至 60.6%, 明显大于对照组的(39.3%), 主要是因为 Ucrit的下降程度更为明显.饥饿组 Ucrit/Ucat比例的变化存在较大变异, 暗示在食物匮乏环境中大小相近的南方鲇幼鱼在能源的利用效率方面可能也具有种内个体变异, 但是该种变异是否与能量代谢特别是静止代谢率的个体变异相关有待研究.
参考文献:
[1] Biro P A, Stamps J A. Do consistent individual differences inmetabolic rate promote consistent individual differences inbehavior [J]? Trends in Ecology and Evolution, 2010, 25(11):653-659
[2] Hanson K C, Hasler C T, Donaldson M R, et al. Stability ofswimming performance and activity hierarchies among wildlargemouth bass at multiple temporal scales: evidence forcontext-dependent shuffling between seasons [J]. CanadianJournal of Zoology, 2010, 88(3): 324-333
[3] Zhang Y, Cao Z D, Fu S J. Effect of delayed first feeding onthe energy content, body length and swimming performanceof southern catfish (Silurus meridionalis) larvae [J]. ActaEcologica Sinica, 2007, 27(3): 1161-1167 [张怡, 曹振东,付世建. 延迟首次投喂对南方鲇(Silurus meridionalis Chen)仔鱼身体含能量、体长及游泳能力的影响. 生态学报,2007, 27(3): 1161-1167]
[4] McCue M D. Starvation physiology: Reviewing the differentstrategies animals use to survive a common challenge [J].Comparative Biochemistry and Physiology A, 2010, 156(1):1-18
[5] Oufiero C E, Garland T. Repeatability and correlation ofswimming performance and size over varying time-scales inthe guppy (Poecilia reticulata) [J]. Functional Ecology, 2009,23(5): 969-978
[6] Plaut I. Critical swimming speed: its ecological relevance [J].Comparative Biochemistry and Physiology A, 2001, 131(1):41-50
[7] Reidy S P, Kerr S R, Nelson J A. Aerobic and anaerobicswimming performance of individual Atlantic cod [J]. TheJournal of Experimental Biology, 2000, 203(2): 347-357
[8] Zeng L Q, Cao Z D, Fu S J, et al. Effect of temperature onswimming performance in juvneile southern catfish (Silurusmeridionalis) [J]. Comparative Biochemistry and PhysiologyA, 2009, 153(2): 125-130
[9] He L J, Xie X J, Ai Q H. Effects of feeding frenquency onfeeding rate, growth and feed conversion efficiency for thesouthern catfish, Silurus meridionalis [J]. Acta Hydrobio-logica Sinica, 2003, 27(4): 434-436 [何利君, 谢小军, 艾庆辉. 饲喂频率对南方鲇的摄食率、生长和饲料转化效率的影响. 水生生物学报, 2003, 27(4): 434-436]
[10] Shi B N. The biological study on the southern catfish in theJialing River [J]. Journal of Southwest Normal University,1980, 2: 45-52 [施白南. 嘉陵江南方大口鲶的生物学研究. 西南师范学院学报, 1980, 2: 45-52]
[11] Zeng L Q, Zhang Y G, Fu S J, et al. Effects of acutetemperature change on resting oxygen consumption rate andcritical swimming speed in juvniel southern catfish (Silurusmeridionalis Chen) [J]. Acta Hydrobiologica Sinica, 2011,35(2): 276-282 [曾令清, 张耀光, 付世建, 等. 双向急性变温对南方鲇幼鱼静止耗氧率和临界游泳速度的影响.水生生物学报, 2011, 35(2): 276-282]





