
近年来,相比于传统的疾病治疗方法,利用药物载体靶向治疗作为一种新型的治疗方法已经引起人们越来越多的关注。 现在各种各样的药物载体不断地被设计和发展,其中最常见的药物缓释载体有胶束[1]、纳米凝胶[2]、纳米颗粒[3]和脂质体[4]等。 而在上述这些药物载体中,聚合物胶束已成为一种很有发展前景的药物载体,其在生物技术和药剂学应用方面受到的关注程度越来越高[1],这是因为该类两亲性聚合物能通过亲疏水作用自发地自组装为核-壳结构,其中疏水性内核可以作为多种疏水性药物分子的容器,而亲水性外壳可以起到内核跟外界媒介之间的保护作用[5 ~7]. 不仅如此,聚合物胶束在药物缓释系统中还具有一些特异性的优点,比如,提高药物的水溶性和生物利用度,延长药物的循环时间,降低副作用和通过增强渗透与滞留( EPR) 效应提高药物在肿瘤部位的优先累积[8 ~10]. 药物可以通过物理包埋、静电作用或者化学键合的方法与胶束载体结合,同时药物在靶向部位释放后,药物载体可以继续在体内降解或者随着人体的新陈代谢排出体外[11].
随着药物缓释系统的逐步发展,生物相容性和生物可降解性这两大性质正成为聚合物胶束作为药物载体优先考虑的关键性因素[12]. 天然多糖作为一种无毒和生物可降解的聚合物材料已被广泛地用于制备生物纳米载体,主要是因为其来源广泛,生物相容性好,无免疫原性,有大量可被修饰的官能团,释药后可降解为寡糖且易吸收,无炎症发生[13]. 其中,淀粉及其衍生物已成为在生物缓释系统领域最受欢迎的用于制备药物载体的聚合物材料[14].
淀粉是自然界中最重要的天然多糖,具有廉价、可再生、无毒、生物可降解、生物相容性等特点,是很好的绿色化学原料[15]. 通常情况下,淀粉中含有直链淀粉和支链淀粉,根据淀粉来源的不同,二者在淀粉中所占的比例也不同,同时两者的含量也决定了淀粉本身的化学和物理属性的区别,但是直链淀粉较支链淀粉具有一定的优越性。
故在本文涉及报道的淀粉基聚合物中多是以直链淀粉为主要研究对象。 由于淀粉链上的羟基之间易形成氢键,使其在冷水中的溶解能力很差,为了提高淀粉的溶解性,目前多采用化学和物理改性的方法。 而在两亲性淀粉基聚合物中主要是化学改性,除了常见的酯化、醚化和氧化等,嵌段和接枝也是淀粉改性的主要方法。
目前,在众多的生物缓释载体中通过自组装方法制备的基于淀粉及其衍生物的两亲性聚合物胶束由于具有良好的生物相容性和生物可降解性,无毒,无免疫原性以及与药物之间无相互作用等突出的性能,使其对它的研究和报道在逐年增多。 而淀粉基生物材料除了用于组织工程和支架外,另一个重要用途就是药物缓释载体。 本文结合本课题的研究工作和近几年的相关报道对淀粉基聚合物胶束作为药物载体做简要综述。
1 常见聚合物胶束
和表面活性剂一样,两亲性淀粉基聚合物在一定条件下能够自组装形成胶束,这已成为一种获得生物纳米载体的主要新途径。 目前,作为药物载体最常见的聚合物胶束主要有接枝聚合物胶束、嵌段聚合物胶束和聚电解质胶束等。 其中,淀粉基聚合物胶束多以接枝聚合物胶束和嵌段聚合物胶束研究为主,而本课题组主要研究的是淀粉基接枝聚合物胶束。
1. 1 接枝型聚合物胶束
淀粉的接枝是指在淀粉的分子骨架上引入各类基团,使淀粉的分子结构发生改变,从而改进或者赋予新的性能。 而在报道的接枝型淀粉基聚合物中,多以酯化和醚化反应为主。 其中疏水改性后的淀粉可以作为自组装生物高分子,用于包载难溶性的生物活性物质。 例如疏水改性淀粉、乙酰化的棕榈酸酯化淀粉[16]和丙基淀粉[17]已用于封装抗癌药物。 同时酯化改性的淀粉自组装成纳米尺寸的胶束作为一种潜在的药物载体也有报道[18].
聚乙二醇( poly( ethylene glycol) ,PEG) 由于其突出的物化和生物性质( 如无毒、无抗原性和无免疫原性) ,使其在制备两亲性聚合物时常常作为一种可溶性的聚合物改性剂,多为末端为羧基、醛基或者伯氨基封端的聚乙二醇,用其所制得的聚合物具有很高的两亲性、生物相容性和生物可降解性[19]. 比如 Zhang 等[5]将糯玉米淀粉和羧基封端的聚乙二醇合成了 starch-g-PEG 的共聚物,并自组装制备了纳米胶束,包载了难溶性的抗癌药物阿霉素。
辛烯基琥珀酸酐( octenyl succinic anhydride,OSA) 和琥珀酸酐( succinic anhydride,SA) 也是目前用于疏水改性淀粉最多的物质,其中 OSA 改性淀粉的物化性质和应用[20]以及自组装形成的胶束的纳米结构[21]均已被详细报道,OSA 改性淀粉和 SA 改性淀粉在许多方面都得到了应用,如药物载体等。 Yu 等[22]则通过玉米淀粉和聚辛烯基琥珀酸酐反应合成了疏水化改性淀粉,并通过自组装制备了纳米胶束,成功包载了难溶性抗癌药物姜黄素,提高了其抗癌活性。
目前,已报道的可用于制备胶束的接枝聚合物主要存在 2 种类型,分别是疏水的骨架链和亲水的支链构成的接枝聚合物以及亲水的骨架链和疏水的支链构成的接枝聚合物。 相较于嵌段聚合物,接枝聚合物通常更容易合成,并且上述 2 种接枝聚合物均可以在水溶液中快速地通过自组装形成疏水链向内、亲水链向外的核-壳结构的胶束。同时,接枝聚合物胶束的大小、结构以及性质都可以通过聚合物的构型、支链的长短与数量以及接枝点等进行有效的调控[23].
若在淀粉及衍生物骨架上修饰疏水性分子,则自组装后形成的两亲性接枝聚合物胶束多以淀粉衍生物链为壳、疏水分子成核的结构,该类核-壳结构胶束作为药物纳米载体具有显着的优势和潜在的应用前景。 Zhang 等[5]通过在聚乙二醇修饰的淀粉骨架上接枝了疏水性分子辛硫醇,不仅引入了二硫键,还使交联后的胶束比未交联的具有高的药物负载率、较好的稳定性和加速细胞内的药物缓释行为。 Ju 等[24]将疏水性分子正丁基缩水甘油醚接枝到淀粉骨架上,制备了具有良好温敏性的两亲性聚合物胶束,该胶束可用作药物载体。 Besheer 等[18]将羟乙基淀粉分别接枝上脂肪酸、月桂酸、棕榈酸和硬脂酸疏水分子,得到 4 种疏水改性的羟乙基淀粉,在水中自组装后形成纳米尺寸的两亲性聚合物胶束。 本研究小组利用可溶性淀粉作为亲水链部分,将人体内存在的疏水性分子脱氧胆酸接枝到淀粉骨架上,制备了一种新型淀粉基聚合物胶束( 图 1)[25]. 同时,本课题组相关的其他淀粉基聚合物胶束的工作也在不断地研究报道中。
1. 2 嵌段型聚合物胶束
嵌段聚合物中同时存在两种或者两种以上不同组成和性质的聚合物链段,各链段通过化学键链接。 将淀粉分子引入到嵌段聚合物中也已成为目前的研究热点[26]. 两亲性淀粉基聚合物同时具有亲水链和疏水链,若将其放入到一种选择性溶剂中时,由于溶解性存在极大的差异,淀粉基聚合物在水溶液环境中自组装形成具有独特核-壳结构的聚合物胶束。
到目前为止,关于淀粉基嵌段聚合物的文献报道较少。 含直链淀粉嵌段聚合物的制备方法主要有酶促聚合法、偶联法以及活性/可控聚合法,其中后者是目前的研究热点。 酶促聚合法在制备直链淀粉嵌段聚合物的过程中,以麦芽寡糖为底物,土豆磷酸化酶催化葡萄糖-1-磷酸酯单体聚合就可 以 得 到 含 直 链 淀 粉 的 嵌 段 聚 合 物[27].Akiyoshi 等[28]以末端连有麦芽五糖的聚氧化乙烯为底物,通过土豆磷酸化酶催化葡萄糖-1-磷酸酯单体聚合得到麦芽糖/聚氧化乙烯两嵌段聚合物,此聚合物在氯仿中能发生自组装。 这种方法能较好的控制淀粉链的分子量,但是操作过程繁琐,因此很少采用该方法。 采用偶联法制备含直链淀粉链的嵌段聚合物时,先将高分子量淀粉中的羟基用保护基团保护起来,再进行降解,得到具有反应功能端基的低分子量直链淀粉衍生物,最后通过功能基团之间的偶联反应制备嵌段聚合物[27]. 直链淀粉-聚丙二醇嵌段聚合物和直链淀粉-聚丁二烯嵌段聚合物[29]以及直链淀粉-聚酯嵌段聚合物[30]均是通过偶联反应制备。 此类聚合物能被 α-淀粉酶降解,具有生物可降解性,但制备方法仍然繁琐。 活性/可控聚合法目前已经替代了上述两种方法,成为合成两亲性嵌段聚合物的最有效、最简单的方法,其中点击化学( click chemistry) 是主要的反应。 Uliniuc 等[31]通过 CuAAC 点击化学将聚ε-己内酯接到淀粉骨架上,制备了两亲性聚合物。Zhang 等[32]将聚 L-谷氨酸用点击化学接到淀粉上,制备了具有 pH 响应的两亲性嵌段聚合物。

1. 3 聚电解质胶束
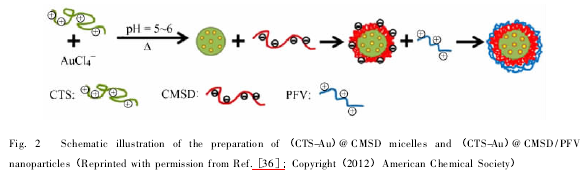
聚电解质胶束是嵌段聚合物在水溶液中通过静电作用等方式形成的胶束。 近年来,聚电解质胶束已经成为药物载体领域研究的一大热点,主要是因为其有益于负电荷化合物( 蛋白质、核酸等)的递送,多用来作为基因的非病毒转运载体。 如果载体表面再带上具有电荷的基团,这样就更加有利于提高载体穿膜的效率,促进细胞内吞作用,进一步提高载体的载药效率。 比如,氨基基团、赖氨酸等氨基酸基团和具有细胞膜仿生的磷酸胆碱( PC) 基团等[33]. 其中,亲水性聚合物链自组装形成束缚链状的致密栅栏,包裹在内核外维持胶束的空间稳定性,而内核由聚合物的部分嵌段物聚集形成,凝聚成核的过程是分子间力( 疏水作用、静电作用、金属络合作用及嵌段共聚物间的氢键作用等) 作用的结果[34]. 按照其形成机理,一般在淀粉衍生物形成的聚电解质胶束中常把阴离子淀粉或阳离子淀粉作为基质。 如 Johansson 等[35]利用阳离子淀粉和阴离子淀粉分别在 1 mmol/L 和10 mmol / L 的 NaCl 的电解液中形成的聚电解质多分子层具有良好的吸附行为,但没有自组装行为。 Xia 等[36]通过带正电的壳聚糖( CTS) 和带负电的羧甲基二醛淀粉( CMSD) 与 Au 纳米粒子共价交联制得电解质胶束( 图 2) ,再将带正电的荧光分子( PFV) 通过静电作用组合到复合微球中( ( CTS-Au) @ CMSD/PFV) ,这种自组装得到的复合微球( ( CTS-Au) @ CMSD) 具有很好的生物相容性和可降解性,包裹 PFV 后荧光强度增强。
2 智能型聚合物胶束
近年来,为了追求抗癌药物药效的最大化和副作用的最小化,传统型的纳米缓释载体正逐步被环境-响应型药物载体所取代,这种受外界刺激发生响应的智能载体用于药物释放已成为目前主要的研究热点。 环境-响应型聚合物是一种自身能够对外界环境的细微变化做出响应,产生相应的物理结构和化学性质变化的一类聚合物。 智能型药物载体携带药物到达病灶部位后,根据病灶部位环境的变化,智能型载体可做出相应的变化,从而使药物被快速的释放出来,大大地提高了药物的有效利用率,这是传统的药物载体所不具备的。
而这种特异性的药物释放是根据病灶部位特定的药理因素或环境信号的改变引起的,这样就最大限度地提高了药效,降低了毒副作用。 根据理化作用或外部环境( pH、温度、GSH 浓度等) 的不同,具有环境响应性的淀粉基聚合物胶束分为 pH 响应型胶束、还原响应型胶束、温度响应型胶束等,这几种特异性胶束在药物缓释系统方面都是目前的研究热点。
2. 1 pH 响应型聚合物胶束
体内不同部位的组织环境有着明显的 pH 差别,一般人的胃部 pH =2,肠道 pH =5 ~8. 不同组织和细胞的 pH 也不一样,正常组织 pH = 7. 23,而肿瘤组织的细胞间质呈弱酸性( pH < 7) ,肿瘤细胞内的内涵体和溶酶体具有更强的酸性( pH =4 ~ 6)[37]. 利用这种 pH 环境的差异,可设计出众多针对肿瘤组织或其他特定器官进行特异性药物传递的 pH 响应型聚合物胶束。 用此类胶束输送抗癌药物,可以明显增加药物在靶向部位( 如细胞质和细胞核) 中的浓度,降低癌细胞的多种抗药机制,从而克服肿瘤细胞的耐药性,提高抗癌药物的治疗效率并减少毒副作用。 例如,具有生物相容性和生物可降解性的聚 L-谷氨酸( PGA) 是一种 pH 响应性物质,Zhang 等[32]通过点击化学将其接到淀粉上,制备了 pH 响应型的两亲性嵌段聚合物胶束,且体外的药物释放实验表明,胰岛素在模拟胃酸环境( pH =1. 2) 下的释放量远远低于其在模拟肠道环境( pH = 6. 8) 下的药物释放量。 同时,该聚合物胶束在酸性条件下具有较好的稳定性。 另外,本研究小组[38]制备的聚乙二醇化的淀粉基聚合物胶束具有良好的 pH 敏感性( 图3) ,研究发现该聚合物胶束在酸性条件下具有明显区别于中性条件下的物理化学特性,测得该聚合物胶束的 pKa= 5. 87,我们认为这种 pH 敏感性主要是由脱氧胆酸( pKa= 6. 58) 以及在酸性条件下氢键变弱和酯键水解协同作用产生的结果,故该类淀粉基聚合物胶束在作为药物载体方面具有潜在的应用价值和前景。
2. 2 还原响应型聚合物胶束
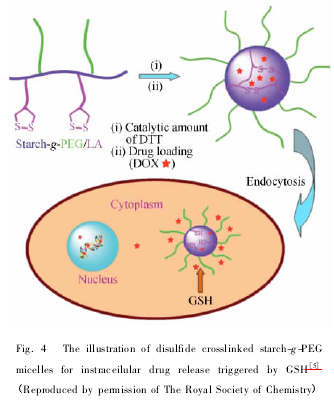
还原响应型聚合物胶束较 pH 响应型聚合物胶束具有高效的缓释效果和可生物降解的优良特性,目前已引起了人们极大的关注。 而这些还原响应型聚合物的最重要特征就是含有二硫键,它通常位于主链、侧链或者作为交联剂。 常见含有二硫键的疏水分子有 N,N-双丙烯酰胱胺[39]、辛硫酸[8]、S,S-二巯基吡啶 N-乙酰半胱氨酸[40]等。 二硫键具有以下特点: 在人体的正常体温、pH 和氧化等环境下较稳定; 在一定量的谷胱甘肽( GSH)还原酶或二硫苏糖醇( DTT) 等还原剂存在下被还原成巯基。 细胞内外恰好存在氧化还原电位,细胞内的 GSH 浓度( 0. 5 ~10 mmol/L) 是细胞外 GSH浓度( 2 ~20 μmol/L) 的200 倍以上。 同时,肿瘤组织细胞比正常组织细胞缺氧,更具有还原性环境,故在细胞外环境或者体内循环中,二硫键显示了较好的稳定性,但是其在细胞内能很快地被降解[41]. 疏水性药物与还原型胶束通过共价键结合或者被包封,到达靶细胞后经内吞作用进入细胞内被 GSH 还原,二硫键断开,药物被快速地释放,从而达到治疗的效果[42,43]. Zhang 等[5]以辛硫酸为交联剂,制备了 PEG 改性淀粉胶束。 较之未交联的 PEG 改性淀粉,交联的淀粉胶束不仅具有较高的 DOX 负载效率,而且具有在靶向部位加速药物释放的作用( 图 4) .

2. 3 温度响应型聚合物胶束
温度响应型聚合物也是目前研究最多的一种特异性高分子。 该类聚合物在结构上含有一定比例的疏水和亲水基团,温度的变化会影响疏水基团的作用以及分子链间的氢键作用,从而引起结构和性能的变化,进而达到控制药物释放的目的。
常见的温敏性高分子主要有聚 N-异丙基丙烯酰胺( PNIPAAm) 、聚氧乙烯( PEO) 和聚甲基丙烯酸( PMAA) 等,其中 PNIPAAm 是目前研究最多且最成熟的一类温敏性高分子,主要是它的 LCST 在32 ℃ ,接近人体温度,在溶液中具有非常明显的可逆相变过程,然而目前尚鲜见基于 PNIPAAm的淀粉基聚合物胶束的报道。 Ju 等[23]制备了温度响应性的 2-羟基-3-丁氧基丙基淀粉( HBPS) ,可自组装成胶束纳米载体用于药物缓释,随着丁基缩水甘油醚的比例的变化,其 LCST 在 4. 5 ~32. 5 ℃ 之间变化,在温度低于 LCST 时能自组装成胶束,而在温度高于 LCST 时能加速药物的释放。
3 小结与展望
淀粉基聚合物胶束作为药物载体在药剂学应用和生物技术方面具有很大的潜力。 再者,淀粉原材料由于其本身天然无毒,具有良好的生物相容性和生物可降解性,符合制备载体材料所具备的条件,已成为制备药物载体最常用的生物材料之一。 但是有关淀粉基聚合物胶束目前仍存在许多亟待解决的问题,如包封率低、适用范围窄、生理稳定性不好等。 另外,还需要进一步提高药物载体的可控程度、载药量和靶向定位能力等。 截止目前,有关淀粉基聚合物胶束的制备和性能研究的报道较其他天然多糖类聚合物胶束( 如壳聚糖、环糊精等) 尚不多见。 我们相信随着科技手段的发展和人们对聚合物胶束认识的逐步加深,两亲性淀粉基聚合物胶束作为一种新型的天然多糖类聚合物胶束将会受到更加广泛的关注和应用,并且逐渐成为一种很有潜力的药物缓释载体。





