
近年来,荧光纳米粒子在生物成像[1]、离子检测[2]、光催化[3]、化学-生物传感[4]、药物诊断[5]等诸多领域受到人们的广泛关注。通常情况下,荧光纳米粒子的制备是把染料分子[6]、量子点[7]或者其他发光基团[8]与粒子进行结合,或者将有机荧光小分子包覆在纳米粒子内部[9],或者荧光分子进行自组装[10]等。相对于传统的有机荧光小分子,上述方法得到的纳米粒子具有发射光强度高、耐光漂白性好和表面可功能修饰性等优势。然而每种方法都有其应用的局限性,量子点通常由于重金属成分的存在而有潜在的毒性[11];有机荧光小分子包覆进纳米粒子内部时不容易均匀分布,且物理包覆的荧光分子容易从包覆体中泄漏;自组装方法往往需要复杂的制备过程。因此,设计一种简单的方法合成高稳定性、环境友好的荧光纳米粒子是非常有意义的工作。
六氯环三磷腈(HCCP)拥有无机环状结构,是合成环基交联磷腈材料的重要原料[12].由其制备得到的环基聚磷腈,是一种具有高度交联结构的无机-有机杂化高分子。聚磷腈材料通常具有结构多样性、耐热稳定性、耐溶剂稳定性和生物相容性等特性,因此在生物医药领域具有潜在应用价值。
本文提出了一个简单的方法制备荧光纳米粒子。以HCCP和荧光素(FL)为单体、三乙胺(TEA)为缚酸剂、乙腈为溶剂,室温下超声反应,得到了拥有良好荧光性能的聚磷腈纳米粒子。由于HCCP与FL之间聚合交联,FL被共价键固定交联并且隔离在环磷腈结构中,所以得到的纳米粒子具有良好的荧光特性和耐光漂白性。同时纳米粒子结合了聚磷腈材料的优良性能,在生物医药方面如细胞标记的应用中具有很大的潜力。
1实验部分
1.1试剂与药品
HCCP、FL:纯度99%,百灵威化学公司;TEA、乙腈、乙醇:分析纯,中国医药(集团)上海试剂公司。
1.2测试与表征
采用美国Perkin Elmer公司Paragon 1000型傅里叶变换红外光谱仪测试红外光谱;采用日本电子株式会社公司JEM-2010型高分辨透射电镜(加速电压200kV,配有EDS)测试微观结构和进行元素分析,将样品在乙醇溶剂中超声分散均匀后,滴加在碳支持膜上,室温下自然晾干用于测试;采用美国FEI公司NOVANano SEM-230型高分辨场发射扫描电子显微镜测试微观结构,将样品在乙醇中超声分散均匀后,滴加在经无水乙醇和丙酮混合溶剂超声处理过的硅片上,放置于40°C鼓风烘箱中干燥后用于测试;采用美国PerkinElmer公司LS 50B型荧光分光光度计测定荧光光谱(激发波长为450nm)。
1.3荧光聚磷腈纳米粒子(PZF)的制备
在100mL单口圆底烧瓶内依次加入20mg HCCP、60mg FL、50mL乙腈溶剂,超声条件下均匀分散后,加入2mL缚酸剂TEA.超声条件下,室温反应6h,得到较为浑浊不透明的黄色分散液。产物经过8 000r/min的速率离心分离5min,并分别用乙腈和乙醇反复洗涤2次,最终的产物在40°C真空干燥箱中干燥过夜后备用。
2结果与讨论
2.1 PZF的结构表征
PZF的合成示意图如图1所示。两种单体在TEA的作用下,反应生成具有高度交联的结构。在本反应中[13],TEA首先活化FL中的酚羟基,使FL亲核进攻HCCP分子中的P-Cl键,形成新P-O-Ar键,两者之间反应生成HCl,此时TEA又作为缚酸剂,与氯化氢结合形成三乙胺盐酸盐,加速聚合反应的进行。
反应初期即成核期,首先生成低聚物,由于低聚物的表面能较高,所以倾向于聚集形成较稳定的初级聚合物核。随着聚合反应的进行,初期形成的聚合物核不断吸收低聚物,同时低聚物之间继续发生交联反应使得纳米粒子不断生长,直到反应结束,得到最终的聚磷腈纳米粒子。由于FL是双酚羟基型分子,所以其与HC-CP聚合后就会形成以HCCP为交联剂的高度交联的网状结构。
图2是HCCP、FL和PZF的红外光谱图。如图所示,PZF纳米粒子在999cm-1处出现一个新的吸收峰,它归属于P-O-Ar键,这证明了HCCP与FL之间发生了缩聚反应。此外,PZF依然保留了HCCP和FL中一些官能团的特征:如在1 191cm-1处为HCCP单元中氮磷双键(P=N)的特征吸收峰;而在1 610cm-1和1 492cm-1处的尖峰是FL中苯环的特征吸收峰。
图3是聚磷腈纳米粒子的EDS能谱图。从图中可见,PZF的主要成分是C、O、N、P、Cl元素,其中P、Cl、N元素来自HCCP单元,C、O元素来自FL单元。而Cl元素信号的存在说明了HCCP单元中的Cl元素并未被完全取代,这主要是因为FL分子的尺寸较大,在与HCCP进行缩聚反应时存在空间位阻效应,从而使得Cl元素被部分取代。

2.2 PZF的形貌
图4(a)和图4(b)为PZF的SEM图。由图4(a)可见,由HCCP和FL通过沉淀聚合反应得到的PZF均呈规则的球形,表面光洁、分散性良好且粒径均一。从图4(b)可见,PZF表面较为光滑,粒子与粒子之间未发生明显黏结。图4(c)和4(d)是PZF的TEM图,从图中可见,PZF轮廓清晰,且为实心。
2.3 PZF的荧光性质
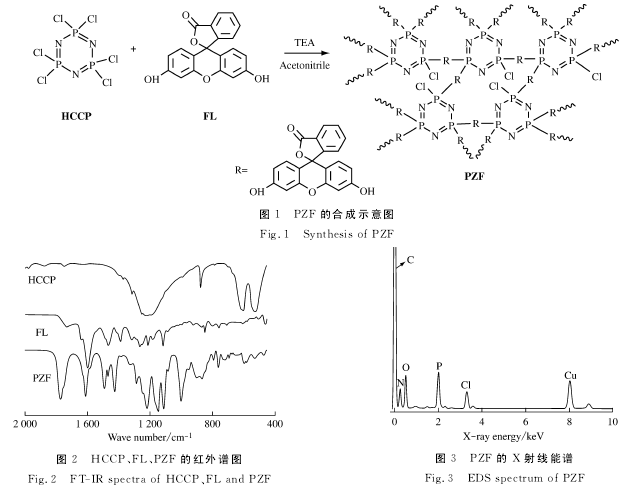
图5是FL和PZF的荧光光谱图。其中FL的荧光发射峰位于514nm,PZF的荧光发射峰位于525nm,发生了些许红移。这证明了制备得到的PZF具有良好的荧光性能。
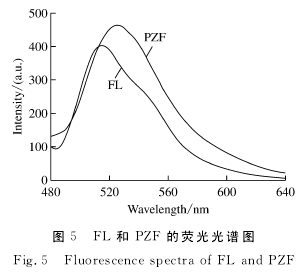
为了证明单体FL被共价键固定在聚磷腈交联体系后,提高了其耐光漂白性。本文分别将FL和PZF的乙醇溶液置于石英比色皿中,在365nm紫外光下照射不同的时间后测定其荧光强度的变化。图6(a)和图6(b)分别是FL分子和PZF在365nm紫外光作用下的荧光性能比较。
如图6(a)所示,FL在紫外光下照射不同时间后,其荧光发射峰位置没有明显变化,但荧光强度随着照射时间的增长在逐步降低。2h后,FL分子的荧光强度下降了60%,这说明其耐光漂白性较差。但PZF在365nm紫外光下照射不同时间后,其荧光发射峰和荧光强度均无明显变化,表明其有优异的耐光漂白性(图6(b))。有研究表明聚磷腈材料具有良好的生物相容性,是理想的生物材料[13],本文中合成的具有良好荧光性能的聚磷腈纳米粒子,在细胞标记的应用中具有很大潜力。
3结论
(1)以HCCP和FL为单体,通过简单的一锅法缩聚反应成功制得具有高度交联结构的PZF.
(2)该PZF具有明亮的黄色荧光,并且由于荧光素单体通过化学键被固定在交联的PZF内,有效克服了有机荧光小分子在高浓度下聚集引起的荧光淬灭效应,因而粒子具有良好的荧光稳定性,且在细胞标记的应用方面大有潜力。
参考文献:
[1]Gao Baoxiang,Li Hongxia,Liu Hongmei,et al.Water-soluble and fluorescent dendritic perylene bisimides for live-cellimaging[J].Chemical Communications,2011,47(13):3894-3896.
[2]Kim H N,Ren W X,Kim J S,et al.Fluorescent and colorimetric sensors for detection of lead,cadmium,and mercuryions[J].Chemical Society Reviews,2012,41(8):3210-3244.
[3]Trytek M,Fiedurek J,Lipke A,et al.Porphyrins incorporated to SiO2gels as fluorescent materials and efficient cata-lysts in biomimetic photocatalytic systems[J].Journal of Sol-Gel Science and Technology,2009,51(3):272-286.
[4]McQuade D T,Pullen A E,Swager T M.Conjugated polymer-based chemical sensors[J].Chemical Reviews,2000,100(7):2537-2574.





