
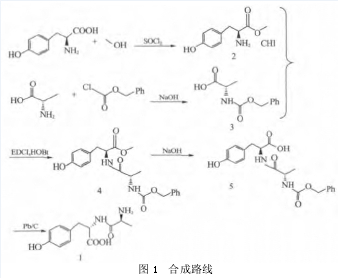
酪氨酸是维持细胞生长必备的氨基酸之一,而丙酪二肽作为一种新型培养基的组成成分,其合成方法多为酶促合肽[1-3],虽然反应效率较高,但由于酶的专一性和成本较高,不利于工业化。本文设计用甲醇保护的 L-酪氨酸和氯甲酸苄酯保护的丙氨酸反应生成带保护基团的二肽,再通过碱解和加氢脱去保护基团,合成路线见图 1,该方法反应条件温和,原材料价格低廉,具有一定的工业化价值。
1、试验部分
1.1 试验试剂与仪器。
试剂:L-丙氨酸和 L-酪氨酸,1-羟基苯并三氮唑 (HOBt),1-乙基 -(3-二甲基氨基丙基 ) 碳酰二亚胺盐酸盐 (EDC-HCl),纯净水为饮用水,其余试剂均为市售工业试剂。
仪器:LC-10ATVP 液相色谱仪测定,TENSOR27 型傅里叶变换红外光谱仪 (KBr 压片 ),LC-MS-2010EV 质谱仪,Avanceav 500 型核磁共振仪 (CDCl3溶剂,TMS 内标 )。
1.2 实验步骤。
1.2.1 酪氨酸甲酯盐酸盐 2 的制备。
向 1L 体系中加入甲醇 600mL,冰盐浴降温至T<0℃,缓慢滴加氯化亚砜31.6g,控温T<0℃反应,滴毕,向体系加入 L-酪氨酸 40g,继续搅拌,撤去冰盐浴,缓慢加热至回流 2h,降温至T< 50℃,减压浓缩得黄色粗品 82g;甲醇 / 甲基叔丁基醚重结晶,得白色固体 42g,收率 82%,LC 纯度 99%.
1.2.2 Cbz 保护丙氨酸 3 的制备。
向 2L 体系中加入 L-丙氨酸 89.0g,12% 氢氧化钠溶液 900mL,冰盐浴降温至体系T< 0℃,缓慢滴加氯甲酸苄酯 340g,滴毕自然升温至室温反应,不断补充氢氧化钠溶液,保持体系 pH ≈ 12 反应,至pH 无变化,缓慢加入 18% 盐酸溶液至 pH ≈ 8,加入乙酸乙酯洗涤水相至澄清,继续缓慢加入 18% 盐酸溶液至体系 pH < 1,乙酸乙酯 1200mL 提取水相,无水硫酸钠干燥,过滤,滤液减压浓缩得白色粗品300g;乙酸乙酯 / 石油醚重结晶得白色固体 182g,收率 81%,LC 纯度 94%,ESI-MS(m/z):(222,M--H)。
1.2.3 Cbz 保护丙氨酰酪氨酸甲酯 4 的制备。
向 1L 体系中加入酪氨酸甲酯盐酸盐 39.3g,Cbz保护丙氨酸 45.0g,HOBt 32.4g,四氢呋喃 750mL,冰盐浴降温至体系T< -5℃,缓慢滴加三乙胺 20.2g,滴毕,控温T< 0℃继续搅拌 30min,加入 EDCl45.8g 控温T< 0℃反应,继续搅拌 30min,撤去冰盐浴,自然升温至室温反应,体系中少量固体不溶,继续搅拌 16h,浓缩反应液得黄色粘稠固体 80g,溶入乙酸乙酯 800mL,分别用饱和碳酸氢钠溶液和0.5mol/L盐酸溶液分次洗涤,无水硫酸镁干燥,过滤,浓缩得浅黄色粗品 70g;乙酸乙酯 / 石油醚重结晶得白色固体 55g,收率 80%,LC 纯度 96%,ESI-MS(m/z):401, M+ + H)。
1.2.4 脱甲酯保护中间体 5 的制备。
向 500mL 体系中加入 Cbz 保护丙氨酰酪氨酸甲酯 35g,甲醇 350mL,加热至 40℃溶清,冷却至室温,缓慢滴加 2mol/L氢氧化钠溶液 220mL,滴毕,继续搅拌 1h,缓慢加入 2mol/L盐酸溶液调节体系 pH=8~9,浓缩除去甲醇,向剩余水液加入2mol/L盐酸溶液调节体系pH<1,乙酸乙酯萃取,无水硫酸镁干燥,过滤,浓缩得白色粘稠物 35g,收率 90%,LC 纯度 91 %,ESI-MS(m/z):(387,M+ + H)。
1.2.5 L-丙氨酰-L-酪氨酸 1 的制备。
向 500mL 体系中加入脱甲酯保护中间体 522.0g,10% Pd/C 4.4g,甲醇和水的混合液 920mL,通H2( 约 0.1MPa) 反应 2h,过滤除去 Pd/C,滤液减压浓缩得白色粗品 20g,甲醇和纯净水分别打浆 30min,过滤,得白色固体 17g,收率 77%,LC 纯度 99%.
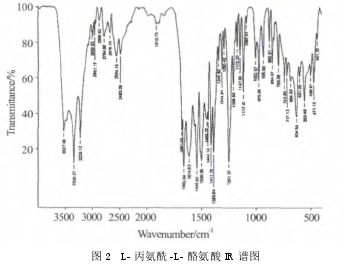
1.3 产品鉴定。
产品为白色晶体粉末,红外图谱如图 2 所示,与分子结构相符;ESI-MS(m/z):(253,M+ + H);1NMR(D2O,500MHz),δ:7.1(d,2H);6.8(d,2H);4.4(m,1H);4.0(q,1H);3.1(dd,1H);2.9(dd,1H);1.5(d,3H)。
2、结论
本文所用氨基酸保护基材料低廉,合肽采用EDCl-HOBt 体系,后处理纯化方法简单且收率较高;加氢脱保护时用甲醇 / 水混合体系替代原有的单一溶剂体系,有效避免反应过程中产物析出附着 Pd/C催化剂导致其失活,优化后的反应体系加氢时间仅为 2h(常温 20~30℃反应),反应完毕经简单后处理纯度即可达 LC > 99%.该合肽方法条件温和,具有一定的工业化意义。
【参考文献】
[1] Kenzo Yokozeki,Kanagawa, et al. Novel peptide-formingenzyme,microbe producine the enzyme and method forproducine peptide using them:US 2005/0032187[P], 2005-11-02.
[2] Ricca,Jean-Marc, et al. Selectivity and specificity insubstrate binding to proteases: novel hydrolytic reactionscatalysed by α-chymotrypsin suspended in organic solventswith low water content and mediated by ammonium hydrogencarbonate [J].J.Chem.Soc.Perkin Trans 1,1993(11):1225-1234.
[3] Bergmann Fruton, et al. The influence of substrate structureon the kinetics of carboxypeptidase action[J].J.Biol. Chem.,1942(145):247-252.








