摘 要: 胶原蛋白作为生物体内重要的结构蛋白,来源广泛,种类繁多,是一种重要的生物学材料,具有众多优良的生物学性能:低免疫原性、生物可降解性、细胞相容性等。但纯胶原蛋白在被直接使用时会因本身的一些缺陷如:降解过快、热变性温度低、机械强度差等,导致其应用范围受到限制。目前常用的方法是对胶原蛋白进行改性,通过有效改善胶原蛋白在特定方面的性能,从而有效应对不同领域对胶原蛋白的性能需求,扩大胶原蛋白的应用范围。本文主要介绍了目前胶原蛋白的化学交联改性、侧链修饰改性、接枝共聚改性等化学改性方法,物理改性方法及高分子材料共混改性方法等5种方法;改性胶原蛋白在医用材料、食品工业、造纸、胶粘剂、皮革工业等领域的应用。
关键词: 胶原蛋白; 改性; 改性方法; 应用;
Abstract: As an important structural protein in the body,collagen is an important biological material with a wide range of sources and excellent biological properties:low immunogenicity,biodegradability,and cell compatibility.However,due to its own shortcomings,such as:rapid degradation,low thermal denaturation temperature,poor mechanical strength,etc.,its scope of applicationwas limited.At present,the commonly used method is to modify collagen,thereby effectively improving the performance of collagen in specific aspects,effectively responding to the performance needs of collagen in different fields,and expanding the application range of collagen.The article mainly introduced five modified methods,including chemical modification of collagen,chemical modification of side chain,modification of graft copolymerization,physical modification method,polymer material blend modification method.The application and progress of modified collagen in medical materials,food industry,papermaking,adhesives,leather industry and other fields,and the research and application trend of modified collagen were prospected.
Keyword: collagen; modification; method; application;
胶原蛋白广泛存在于生物体骨骼、皮肤、肌腱、血管等部位,约占人体体重的6%,蛋白总量的25%~30%,胶原纤维固体物的85%[1],在生物体中起到保护、支撑、结合及形成界面隔断等作用。胶原蛋白来源丰富,种类繁多,目前已发现并被命名的不同类型胶原蛋白有27种,而且低温条件下提取得到的胶原蛋白具有独特的三螺旋结构,具有优良的生物相容性,是重要的生物材料之一[2],被广泛应用于医用材料、日用化工、造纸工业、食品工业等领域。但从生物体内提取的胶原蛋白直接作为材料使用存在分离纯化及加工处理困难,干燥后其存在质地较脆、成膜能力较弱、遇水溶胀、在体内降解过快、易被细菌分解变质等缺点。因此,常通过改性处理来改善胶原蛋白的抗拉伸能力、抗降解能力、耐热性等,从而获得新型材料,并将其应用于烧烫伤的治疗、美容、组织修复、创面止血、组织工程等领域[3]。

1 、胶原蛋白改性方法
胶原蛋白改性方法可分为化学法、物理法和高分子材料共混三种主要方法。
1.1、 化学改性法
胶原蛋白的化学改性法主要有化学交联改性[4]、侧链基团修饰改性[5]和接枝共聚物改性[6]等方法。
1.1.1、 化学交联改性
化学交联指在胶原肽链内或肽链间通过化学交联剂形成共价键进行交联,在保留胶原结构的同时改善胶原力学、化学稳定性等性质的改性方法。根据不同的交联剂性质在胶原肽链内或胶原肽链间形成稳定的连接,如酯键、二硫键、酰胺键等,从而改善胶原蛋白的力学或热稳定性,是目前最常用的改性方法。
胶原蛋白的化学改性效果明显,具有广泛的应用前景。但化学法改性会引入化学试剂,难以控制试剂残留,产生生物学毒性。化学交联剂根据功能大致可分为以下两类。
一类是具有多官能团的交联剂,这类交联剂在相邻的两条肽链间形成胺基桥键与胶原蛋白交联,例如京尼平、原花青素、多酚类和酶等对胶原蛋白的交联。王刚等[7]和王晓亚等[8]分别使用京尼平与原花青素交联胶原蛋白制备出具有理想柔顺度和生物学性能的组织工程支架,新型支架具有快速再细胞化的潜能、优良的血液相容性和抗钙化性能,有希望用作组织工程支架。多酚类物质含有带负电荷的活性酚羟基,且该羟基可被氧化成醌或半醌,因此多酚与蛋白质之间可以通过非共价作用或共价作用形成蛋白质-多酚复合物[9]。邓依等[10]用单宁酸对胶原蛋白膜进行改性,在保持胶原蛋白的三股螺旋结构完整的基础上,单宁酸的酚羟基与胶原蛋白发生了多点氢键结合,使膜的机械强度、热稳定性和耐酶解性都有所提高,可在临床和包装材料中被使用。Chen等[11]用谷氨酰胺转氨酶将胶原蛋白的侧链基团进行脱除、转移和键和,从而发生共价交联,制得的胶原蛋白膜抗拉强度和热稳定性得到了提高,且无细胞毒性,有希望用于医学材料。除谷氨酰胺转氨酶外,也有漆酶和酪氨酸酶用于胶原蛋白改性而提高了胶原蛋白的抗拉伸强度和抗微生物降解的研究报道[12]。在常见报道中多使用单一交联剂对胶原蛋白进行改性,但也有报道使用复合交联剂对胶原蛋白进行交联的研究,例如杜田明[13]使用壳聚糖和双醛海藻酸钠对胶原蛋白进行改性研究制备胶原蛋白海绵,三种材料的复合在保持胶原蛋白三螺旋结构的基础上,增加了胶原蛋白结构稳定性、成纤维能力、热变性温度等性能,同时还不会影响壳聚糖的抑菌性,可以作为医用敷料继续深入研究。
戊二醛作为目前使用最广泛的多官能团交联剂,具有两个活性醛基,能与胶原蛋白的伯氨基形成希夫碱,将胶原蛋白以五元环的形式连接起来以提供有效的交联,结构[14]如图1所示。戊二醛虽能提供有效交联,但有一定细胞毒性,不同浓度戊二醛改性的胶原蛋白植入大鼠皮下会对大鼠的皮肤造成不同程度的侵蚀,使大鼠皮肤产生炎症和细胞毒性反应,并使周围组织产生一定程度的钙化[15]。为避免交联剂带来损伤,研究者正努力寻找无毒无害的交联剂。
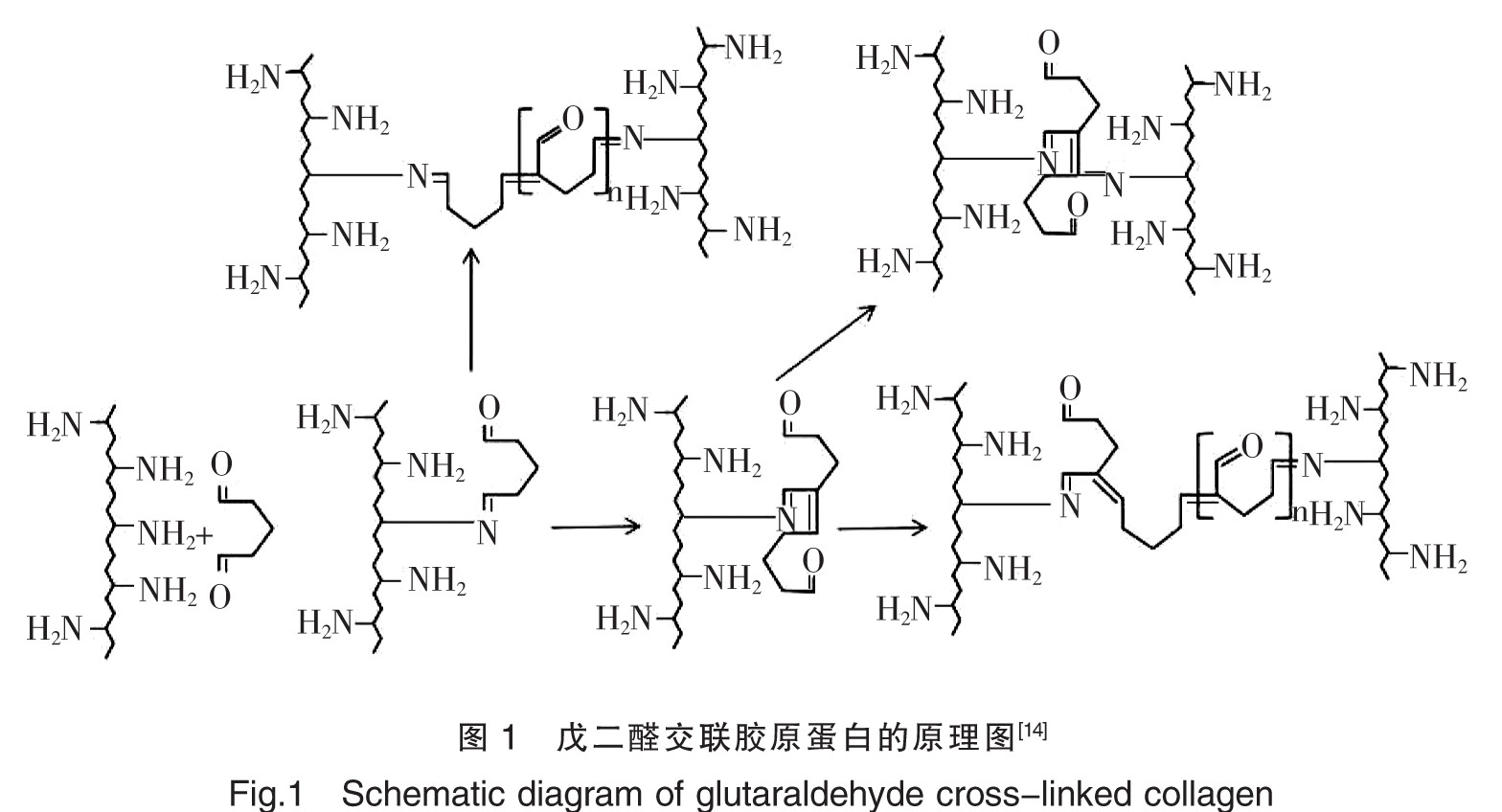
另一类是能活化谷氨酸或天冬氨酸残基上的羧酸,与另一条肽链上的氨基形成酰胺键,实现胶原蛋白的交联改性,如酰基叠氮化合物。Marinucci等[16]采用聚二烯丙基二甲基氯化铵对胶原膜进行交联,并将未交联的膜与交联后的膜进行对比,结果发现应用二苯基磷酸盐交联的胶原蛋白使细胞的扩增速度明显高于未交联胶原膜,说明通过交联后的胶原膜细胞相容性得到了提升。
1.1.2、 基团的修饰改性
基团的修饰改性是通过低分子试剂与胶原蛋白侧链基团发生化学反应而实现的。胶原纤维具有大量氨基与亚氨基,特别是ε-氨基,反应活性极强,胶原蛋白氨基主要有脱氨基反应、酰胺化反应、甲基化反应、巯基化反应、胍基化反应等。王学川等[17]使用乙醛酸对胶原蛋白进行侧链修饰改性,发现胶原蛋白侧链的胍基和氨基与乙醛酸的醛基发生羧基化反应,将羧基和氨基结构引入胶原蛋白,胶原蛋白的比表面积由2.126 1 m2/g提高到4.694 2 m2/g,孔径由21.630 nm降低到9.886 nm,使胶原纤维对铬离子(Cr3+)的吸附率上升,同时提高了胶原纤维的热性能,改性后的胶原吸附剂可用于废水中(Cr3+)回收利用,有利于节约资源,保护环境。刘琼等[18]使用乙二胺四乙酸酐对明胶进行酰胺化改性,制得了溶胀快速、溶胀率高的pH敏感型水明胶,可在药物缓释领域发挥作用。
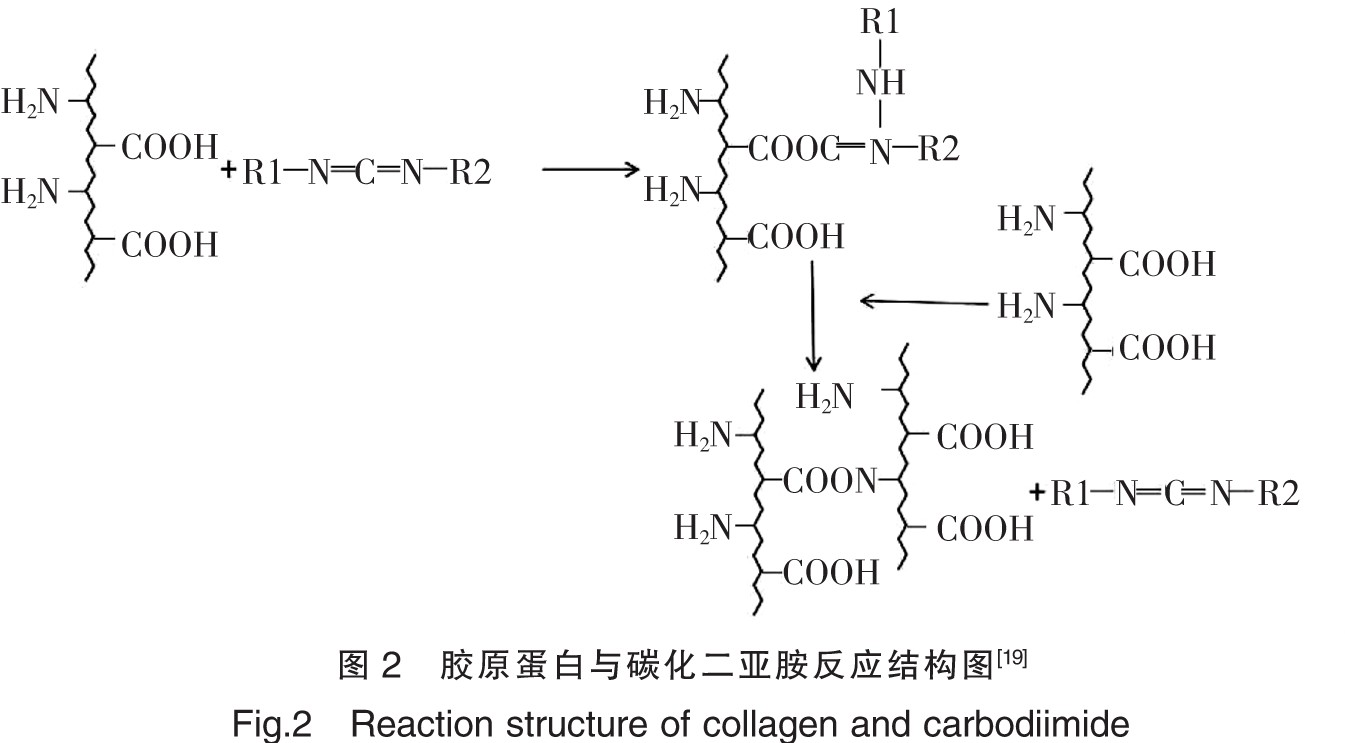
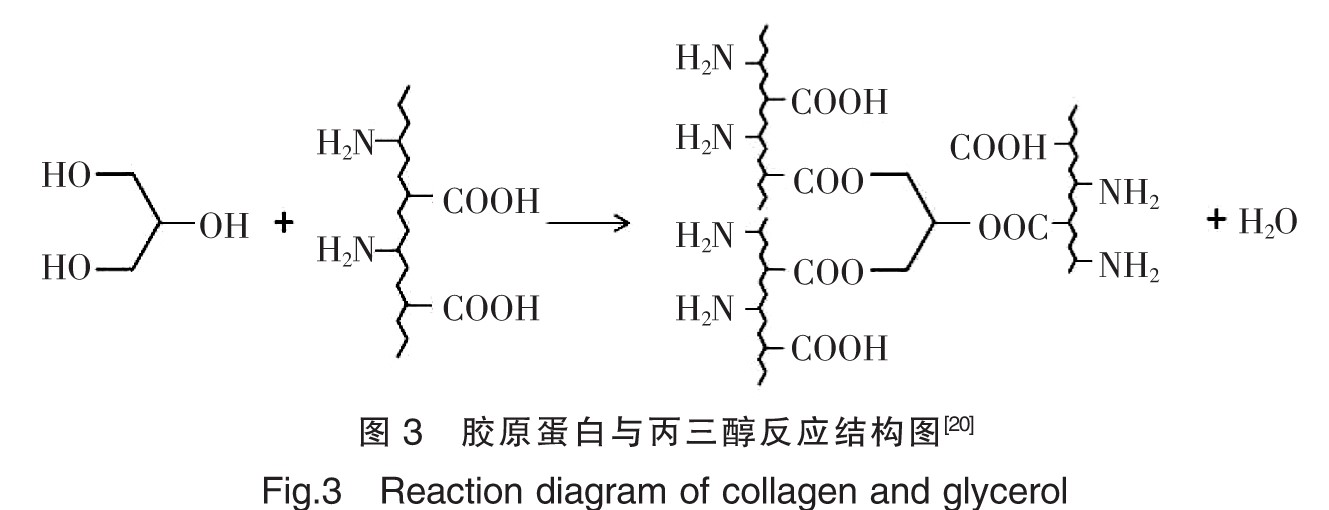
除氨基外,胶原蛋白中的谷氨酸等二元酸,可以发生酯化、酰胺化等反应。目前应用最普遍的方法是用水溶性的碳化二亚胺类特定修饰蛋白质的羧基基团,生成酯类或酰胺类。王丽霞等[19]使用碳化二亚胺修饰胶原蛋白制备胶原支架并进行测定,结果证明碳化二亚胺增加了胶原支架的孔径和孔隙率,提高了其变性温度和抗酶解能力,且人牙周膜成纤维细胞(PDLFs)在支架材料上生长状态稳定,说明碳化二亚胺改性胶原支架有希望用于牙周组织的修复,其结构如图2所示。另外Liu等[20]用丙三醇与胶原蛋白的羧基进行酯化,改变了胶原蛋白的侧链基团,形成了立体的空间网状结构,使粘结剂的粘结能力得以提高,制成了新的胶原粘结剂,结构如图3所示。
1.1.3、 接枝共聚物改性
接枝共聚物是在高分子聚合物主干或主链下,将单体进行自由基聚合、离子加成聚合或开环聚合所得到的新的聚合物。对胶原蛋白的聚合物改性目前主要集中在烯类单体的接枝共聚改性,烯类接枝共聚改性的单体包括丙烯酸甲酯、甲基丙酸甲酯、丙烯酸丁酯以及丙烯腈等,所用的引发剂有过硫酸钾、过硫酸铵、偶氮二异丁腈-异丙醇-水体系、铈离子等引发体系。郝晓丽等[21]以胶原蛋白为基材,丙烯酸甲酯和乙酸乙烯酯为接枝单体,过硫酸铵为引发剂,采用乳液聚合法对胶原蛋白进行改性制备施胶剂。采用红外光谱仪和激光粒度仪对产物进行表征,结果表明:胶原蛋白与乙烯基单体之间发生了接枝反应,得到的施胶剂乳液平均粒径为0.117 μm,分布均匀;将该产物应用于纸张表面施胶后,与未施胶纸张相比,抗拉伸强度是原纸的3.0倍,抗撕裂强度是原纸的1.9倍,且耐水性能得到改善。陈永芳等[22]在胶原蛋白基团上接枝丙烯酸单体制得的胶原类皮革涂饰剂具有优良的耐熨烫性、耐擦洗和耐折裂性,可以满足皮革涂饰的要求。胶原蛋白的接枝改性可以在保持胶原蛋白原有特性的基础上使胶原蛋白具有接枝组分的新性质。
1.2、 物理改性法
物理改性法在不添加化学试剂的条件下,通过物理手段改善胶原蛋白性能,改性后的胶原蛋白可被广泛应用于生物体,在生物医学方面有着广阔的应用前景。目前常见的物理改性方法主要有紫外线照射、重度脱水、γ射线处理等方法。
Chan[23]和Koide T等[24]对胶原蛋白进行紫外照射,发现经紫外照射后的胶原蛋白-水结合能力、拉伸强度、黏度和热稳定性等理化性能明显提高。此外,重度脱水也是胶原蛋白物理改性中常使用的方法,该法通过脱水使胶原蛋白交联,以提高变性温度,改善胶原的物理性能。重度脱水缩短了胶原蛋白活性基团之间的距离,使胶原蛋白分子之间发生交联,提高胶原蛋白的变性温度,降低游离氨基酸含量,从而提高胶原蛋白的机械强度。Scotchford等[25]使用重度脱水法交联的胶原膜做底物培养成骨细胞,结果表明交联后的胶原膜水溶性低,对成骨细胞无细胞毒性,与成骨细胞的生物相容性得到改善。常用于医疗物品和辐射灭菌和食品处理的γ射线也可用于胶原蛋白的改性,适当剂量γ射线处理可以增强胶原材料的力学性质和热稳定性[26]。但是γ射线处理会有辐照剂量不均一和不稳定的缺点,导致最终材料的交联不稳定和不均一[27]。
物理方法改性胶原蛋白的优点是可避免外源物质进入胶原蛋白内,缺点是胶原交联度低,且难以获得均匀一致的交联,因此目前物理改性方法一般作为改性的辅助方法使用。
1.3 、高分子材料共混改性法
除物理和化学改性外,胶原蛋白还能通过与其他高分子材料共混进行改性。共混改性基本可分为两大类:一类是物理共混改性,包括溶液共混、机械共混、乳液共混;另一类是化学共混,高分子材料与蛋白质分子形成静电相互作用和/或氢键的聚合物与胶原蛋白共混,改善其可纺性。常见与胶原蛋白共混的高分子材料主要分为合成高分子材料和天然高分子材料两大类。
1.3.1 、合成高分子材料
与胶原蛋白共混常用的合成高分子材料有聚氨酯类、聚酰胺类等,随着对胶原蛋白研究的深入和对胶原材料的健康和环保要求,选用可生物降解的聚乳酸、聚乙烯醇等与胶原蛋白进行共混,作为制备可吸收的缝合线、组织工程支架等的材料。
Jose等[28]通过静电纺丝技术将聚乙丙交酯与胶原共混,形成均匀的纳米纤维共混物并应用于骨组织工程材料,形态特征表明,加入胶原后的聚乙丙交酯的直径变小并且分布变窄;DSC-Tg结果显示:在静电纺丝过程中,胶原的三股螺旋结构并未遭到破坏,且胶原的加入增加了支架的亲水性,可用于制作骨组织支架。唐屹等[29]使用可溶性聚乙烯醇和胶原蛋白制备共混复合纤维,其表面具有与天然纤维相似的褶皱与凹槽,而且最大断裂度和纤维弹性模量有着明显提高,颜色上染率可达95%以上。
合成高分子材料与胶原蛋白共混制备复合材料应用广泛,但在使用中存在一些问题:与不可降解的聚氨酯等材料制得的新材料因为不能被机体吸收,只能用于体外;可降解的聚酯、聚谷氨酸等材料生物性能优良,但如果分子量较小,则聚合物强度不足,而分子量较大则不溶于水,而且如果溶解时易降解,也会影响材料的机械性能,并影响附近组织pH值,易造成组织内的无菌炎症。
1.3.2、 天然高分子材料
天然高分子材料具有优良的生物相容性与可降解性等性质,天然高分子材料中具有代表性的是天然蛋白质和天然多糖,研究中常用的天然多糖主要有淀粉、壳聚糖、海藻酸和羧甲基纤维素等,以及天然蛋白质有蚕丝蛋白、大豆分离蛋白等。
王碧等[30]利用海藻酸和羧甲基纤维素共混改性胶原蛋白制备新型生物材料,实验后证明共混膜中胶原蛋白、海藻酸钠和羧甲基纤维素之间具有较强的相互作用和优良的相容性,Ca2+交联、氢键以及静电引力等强烈相互作用使材料具有均匀致密的截面形貌、较高的透光率、更优良的力学性能和柔韧性,同时具有较高热稳定性,有望作为一种新型材料在食品医药等领域进行应用。裴莹等[31]依据天然资源各自的结构和性质,从改性方法和机理出发,阐述了胶原及明胶与其他天然高分子(壳聚糖、淀粉、丝素蛋白、海藻酸钠)进行共混和复合以制备新的生物复合材料方面的研究。
天然高分子材料与机体之间具有优良的相容性,胶原蛋白通过与不同高分子材料进行共混,可以相互补充,是目前生物材料的主要研究热点。
2 、改性胶原蛋白的应用
2.1、 在生物医学中的应用
胶原蛋白作为天然的组织支架,是一种重要的生物医学材料。具有优良的生物活性、低抗原性和生物相容性,能以不同形态参与人体组织的增殖、分化、迁移,同时胶原蛋白在生物体内易吸收、强度高、亲水性强、无毒,在医学领域的应用尤为广泛。
2.1.1、 医用敷料
胶原蛋白作为天然生物材料,具有高亲水性、优良的生物相容性和可降解性,因此利用改性胶原蛋白开发制作的医用敷料常用于治疗烧伤、烫伤、止血等。改性胶原蛋白敷料能在使用过程中防止创面水分和热量损失,暂时作为机体的生物屏障,与外界隔离避免刺激,从而加速创面愈合。目前比较常见的改性胶原敷料主要包括胶原海绵、水凝胶、胶原贴剂等。
胶原海绵在医用辅料中的研究和应用与其理化特性密不可分:胶原海绵的多孔性结构保证了优良的透气性;胶原蛋白能刺激凝血因子,促进凝血,可用于体内止血;胶原蛋白是成纤维细胞、血管内皮细胞等细胞促生长因子的生长基质,有利于损伤组织细胞增殖。张自强等[32]对两种胶原蛋白海绵进行鼠静脉止血与生物相容性实验,证明胶原海绵对静脉出血的止血效果明显,能够促进静脉创口的愈合,在大鼠体内28 d可完全降解,组织相容性优良。靳少锋等[33]使用胶原、透明质酸和氯化钙为原料,以碳化二酰亚胺为交联剂,制备复合胶原海绵止血材料,并测试了止血效果和生物相容性,结果证明复合材料呈多孔的海绵状,有利于血液的吸收与凝结,细胞毒性反应为Ⅰ级,具有良好的生物相容性,是一种优良的止血材料。
与干燥状态的胶原海绵不同,胶原水凝胶富含大量水分,具有三维立体结构,是一种优良的敷料形式和药物载体。明胶和胶原蛋白制备的水凝胶目前已被应用于多个方面。魏志君等[34]将鱼胶原蛋白和透明质酸进行交联制备水凝胶,用于培育人脐带间充质干细胞,发现人脐带间充质干细胞生长状况稳定,是优良的组织和器官的培育基础材料,可用于组织修复。
此外还有胶原蛋白贴剂类敷料,多为膜状,主要用作体外的真皮替代和烧伤、烫伤的敷料。Wang等[35]对胶原蛋白进行甲基化修饰和交联后,改善了胶原贴片的理化性质,并通过大鼠进行了生物相容性的研究,证明改性后的胶原贴片在无生长因子的作用下,可以与组织进行融合,表明改性后的胶原贴片可应用于医用辅料。
胶原敷料还可以搭载不同类型药物,制备成具有不同特性如抗菌、抗炎、抗敏等的敷料。目前常见的形式有载药海绵、载药水凝胶、载药微球等。覃凤均等[36]用胶原蛋白海绵搭载磺胺嘧啶制成抗菌海绵并与纯胶原海绵同时进行临床实验,证明纯胶原海绵本身具有抗菌作用,同时能吸收大量渗出液,保持伤口湿润环境,从而促进愈合。此外,载药胶原载体除海绵状外,还可以制成膜状。Jana等[37]利用瓜尔胶和鱼鳞胶原蛋白膜搭载头孢他啶药物,经体外细胞实验证明载药胶原膜具有生物相容性以及抗金黄色葡萄球菌和铜绿假单胞菌的作用。随着对药物释放的要求,具有缓释作用的微球正成为当前研究的热点。尚学峰等[38]采用乳化交联法制备胶原蛋白-壳聚糖-纳米SiO2的复合微球,并测定不同条件下对于盐酸小檗碱(黄连素)和维生素D载药率的影响,结果证明该微球呈均匀的圆球状,粒径在600~1 200 nm之间,载药率最高可达35%,并且具有一定的缓释效果。
2.1.2 、组织工程材料
胶原蛋白的束状四级结构,使胶原蛋白不仅具有优异的力学性质,还在使用时为细胞繁殖和组织修复提供空间,所以改性胶原蛋白在组织工程中的应用是胶原蛋白的又一研究重点。用于组织工程的材料不仅需要优良的生物相容性、生物可降解性和机械稳定性,还要能提供用于诱导组织细胞形成和聚集的适当信号,胶原蛋白作为理想的组织工程材料,可以支持多种类型的结缔组织,如皮肤、血管、韧带、骨和软骨等。胶原蛋白是人体组织的重要成分,在人体组织器官修复上有着重要的地位,是一种理想的高分子生物医学材料。胶原蛋白在经过适当改性后植入细胞或生长因子,可作为人工组织器官或支架等组织工程类产品。
现在已有报道的改性胶原类组织工程材料有胶原蛋白线[39]、组织填充物[40]、人工组织器官[41]等。胶原蛋白制备的组织工程材料无毒无害、免疫原性低,能够避免发生免疫排斥反应。外科手术中常使用的普通丝线会使皮肤表面产生癞痕,拆线时会给患者带来痛苦。但是胶原蛋白线具有一定强度,在体内可被人体降解吸收,体外可处理脱落,不会产生癞痕。崔硕等[42]和徐海洋等[43]对人体皮肤伤口和口腔种植切口进行缝合,最终观察证明胶原蛋白线可在7~15 d时脱落,伤口愈合情况良好,减少疤痕和并发症的产生。胶原材料除制成胶原线用于组织的伤口缝合外,还可以植入人体内部,用作机体组织缺损时的填充材料。姚晖等[44]和冯庆玲等[45]用羟基磷灰石与胶原蛋白制备仿生骨材料并通过植入兔的颅骨与股骨缺损处进行动物实验,证明新型仿生骨具有优良的生物相容性,能够在逐渐降解的同时加快新骨的沉积,促进骨组织创伤的愈合,是一种新型的骨缺损修复材料。胶原类组织工程材料不仅可以暂时用作组织修复材料,而且可以搭载生长因子、培植组织细胞,用作人工组织器官的培植基体。孙秀娟等[46]使用胶原蛋白和透明质酸通过京尼平进行交联,制备了血管支架,并通过细胞毒性实验、细胞种植和植入实验对血管支架的性能进行测定,实验证明该血管支架材料细胞毒性为Ⅰ级,具有优良的细胞黏附和增殖能力,植入皮下后可在5个礼拜后降解,在组织工程领域具有广阔的应用前景。赵东锷等[47]使用胶原蛋白-壳聚糖膜为支架体外构建心脏瓣膜,经多次接种犬主动脉壁间质细胞和内皮细胞后,材料表面完全被细胞覆盖,内皮细胞在支架表面不仅可以黏附生长,还能分泌血管活性物质,是一种具有生理功能的心脏瓣膜雏形。随着医学与材料学的不断发展,胶原蛋白在医学领域的应用范围也将不断扩大。
2.2、 在食品中的应用
胶原蛋白在食品中多用于制成包装材料。胶原蛋白的螺旋结构具有优良的韧度与强度,而且氨基酸组成使其具有优良的成膜能力,因此改性胶原蛋白常用于制备可食用膜,用作肠衣、鱼或肉等食品的保鲜与包装材料。
改性胶原蛋白制备的可食膜与纯胶原膜相比具有强度高、热稳定性高、阻湿性高、耐水性强等特点。秦溪[48]利用胶原蛋白共混聚乙烯醇再经戊二醛喷雾制备的胶原蛋白肠衣的抗张强度达到36.48 MPa,断裂伸长率为3.07%,透光率为69.83%,与商业肠衣相比无显着差异;改性处理后,胶原纤维相互连接,呈网状结构,耐热抗水能力都有很大提高。改性胶原蛋白除用于肠衣等的包装材料外,还可以用于制备具有保鲜功能的复合膜。于林等[49]使用茶多酚和壳聚糖改性胶原蛋白制备复合膜,探究复合膜对于冷藏石斑鱼保鲜效果的影响,实验证明:茶多酚和壳聚糖改性的胶原复合膜可在冷藏条件下减缓鱼肉肌动球蛋白变性和巯基含量降低,阻碍Ca2+-ATPase活性下降,TVB-N值等理化指标变化,抑制细菌生长,说明该复合膜可在冷藏条件下有效阻止石斑鱼腐败变质,具有明显保鲜效果,其可作为替代塑料的新型包装材料。
2.3 、在其他工业中的应用
改性胶原蛋白在纸张施胶、粘结剂、皮革鞣制等工业中亦有广泛应用。施胶作为纸张和纸板制作过程中必不可少的工序,可有效提高纸张的抗水性、抗张强度等性能。目前使用中的施胶剂多为烷基烯酮二聚体(AKD)、烯基琥珀酸酐(ASA)、苯乙烯丙烯酸丁酯共聚物等石油化工类产品,但其资源紧缺,价格昂贵,且对身体有害;而改性胶原蛋白作为纸张施胶剂,资源丰富,价格低廉,且对环境与人体无害。王学川等[50]以过硫酸铵为引发剂,使用马来酸酐-胶原蛋白与苯乙烯、丙烯酸乙酯单体进行接枝共聚合反应,合成一种新型造纸表面施胶剂,实验证明用新型施胶剂制作而成的纸张的抗张指数、环压指数与抗水性能较原纸张皆有一定程度的提升,施胶后纸张性能优于工厂用化学施胶剂的施胶效果,其是纸张施胶剂的优良替代品。
动物胶原蛋白粘结剂是天然高分子粘结剂,无毒无害可降解,是传统化学粘结剂的优良替代品。王培霖等[51]用戊二醛对骨胶进行改性条件探究,结果表明醛胶比为0.2∶100、时间60 min、温度30℃为反应最佳条件,改性后的粘结剂的剪切强度、黏度、热稳定性最佳,这是因为改性后分子间凝胶趋势降低,交联形成网状结构,使胶粘性能得以提高。苏秀霞等[52]将戊二醛和盐酸柠檬酸的混合酸用于胶原蛋白粘结剂的改性,制备的胶原粘结剂表面光滑无裂纹,耐水性能得到显着提高,是优良的胶原蛋白粘结剂。
改性胶原蛋白在皮革工业中也有极其广泛的应用。改性胶原蛋白可用作皮革填充剂,使皮革手感更加舒适自然,用于皮革鞣制可保持皮革真皮感,发挥皮革可以透水汽的卫生性能。卢加洪等[53]用环氧树脂与水解胶原蛋白交联制备皮革复鞣剂,用于皮革的复鞣填充吸收率可达90%以上,对皮革的填充作用能明显有效减少皮革的部位差,保证皮革质量。贾鹏翔等[54]用马来酸酐和丙烯酸通过过硫酸铵为引发剂,与胶原蛋白接枝改性制备复鞣剂,用于皮革的鞣制,并与商业化复鞣剂进行对比,结果证明经改性后的鞣革剂处理的皮革的粒面性能、丰满度、弹性及填充性更佳,皮革收缩温度提高6℃,透气性能提高20%,在作为鞣革剂方面具有应用潜力。
改性胶原蛋白制备的施胶剂、粘结剂、鞣革剂与传统施胶剂、粘结剂、鞣革剂相比,可以减少生产中化学试剂的使用以及使用时对机体带来的危害和对环境的污染。随着对改性胶原蛋白研究的深入和材料学的发展,改性胶原蛋白的应用也将逐步进入生产生活的各个方面。
3、 结语
胶原蛋白因优良的生物学特性而受到各行业的广泛关注。胶原蛋白的改性扩大了胶原的应用范围。不同的改性方法有不同的优缺点,根据需求选择不同的改性方式,是扩大胶原利用范围的重要方法。安全、环保、可控的改性方法正在逐步取代传统方法成为胶原蛋白改性的新热点。随着胶原蛋白改性方法研究的深入,其在食品、医学、化工和环保等行业的应用将更加广泛。
参考文献
[][ 1 ]宋芹,陈封政,颜军,等.胶原蛋白研究进展[J].成都大学学报(自然科学版),2012,31(1):35-38.
[][ 2 ]Jongjareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper(Lutjanus vitta)[J].Food Chemistry,2005,93(3):475-484.
[][ 3 ]张忍虎.胶原蛋白在生物医药工程中的应用研究进展[J].中国设备工程,2018,(1):189-190.
[][ 4 ]吴邦耀,罗卓荆,孟浩,等.胶原-明胶支架材料交联改性的制备及细胞毒性实验研究[J].生物医学工程与临床,2007,11(5):420-425.
[][ 5 ]陈达佳,赵利,袁美兰,等.茶多酚改性胶原蛋白-壳聚糖复合膜工艺优化[J].食品科学,2014,35(24):63-68.
[][ 6 ]陈淑花,孙婷婷,许利丽,等.壳聚糖接枝物改性胶原蛋白海绵状敷料的制备与表征[J].工程塑料应用,2019,47(2):36-40,64.
[][ 7 ]王刚,亢婷,刘毅,等.京尼平交联Ⅰ型胶原蛋白材料与人脂肪间充质干细胞的生物相容性[J].中国组织工程研究,2014,18(34):5423-5428.
[][ 8 ]王晓亚,马旭兵,翟万银,等.原花青素在酸性条件下交联制备心脏瓣膜的性能研究[J].华东师范大学学报(自然科学版),2014,(6):109-120.
[][ 9 ]刘夫国,马翠翠,王迪,等.蛋白质与多酚相互作用研究进展[J].食品与发酵工业,2016,42(2):282-288.
[10]邓依,王维生,刘文涛,等.天然植物单宁酸交联改性胶原膜[J].皮革科学与工程,2016,26(6):5-10.
[11]Chen R N,Ho H O,Sheu M T.Characterization of collagen matrices crosslinked using microbial transglutaminase[J].Biomaterials,2005,26(20):4229-4235.
[12]Jus S,Stachel I,Schloegl W,et al.Cross-linking of collagen with laccases and tyrosinases[J].Materials Science and Engineering:C,2011,31(5):1068-1077.
[13]杜田明.鱼鳞胶原基质的复合改性及其在创面中的初步应用研究[D].北京:中国人民解放军军事医学科学院,2016.
[14]蔡洁.新型交联剂的合成及交联改性胶原的研究[D].广州:华南理工大学,2014.
[15]Mcpherson J M,Sawamura S,Armstrong R.An examination of the biologic response to injectable,glutaraldehyde cross-linked collagen implants[J].Journal of Biomedical Materials Research,1986,20(1):93-107.
[16]Marinucci L,Lilli C,Guerra M,et al.Biocompatibility of collagen membranes crosslinked with glutaraldehyde or diphenylphosphoryl azide:an in vitro study[J].Journal of Biomedical Materials Research Part A,2003,67(2):504-509.
[17]王学川,步巧巧,强涛涛,等.乙醛酸改性胶原纤维吸附剂的合成/表征及反应机理研究[J].功能材料,2013,18(44):2699-2691.
[18]刘琼,范晓东.快速溶胀pH敏感明胶水凝胶的研究[J].精细化工,2005,(10):739-743.
[19]王丽霞,赵寰,靳淑凤,等.EDC交联离子化胶原支架材料的生物学表征[J].口腔医学研究,2015,31(4):343-348.
[20]Liu Weihua,Zhang Yilin,Li Yingmin.Optimization of a new animal glue binder system cured by CO2 for use in foundry[J].China Foundry ,2012,9(4):356-359.
[21]郝晓丽,白凡凡,任雯,等.改性胶原蛋白施胶剂的制备及其施胶性能研究[J].陕西理工学院学报(自然科学版),2016,32(4):6-10,22.
[22]陈永芳,丁志文.胶原蛋白接枝共聚改性的研究[J].中国皮革,2007,(23):24-26.
[23]Chan B P.A photochemical crosslinking technology for tissue engineering:enhancement of the physico-chemical properties of collagen-based scaffolds [J].Proceedings of SPIE,2005,56(95):317-327.
[24]Koide T,Daito M.Effects of various collagen crosslinking techniques on mechanical properties of collagen film[J].Dental Materials Journal,2009,16(1):1-9.
[25]Scotchford C A,Cascone M G,Downes S,et al.Osteoblast responses to collagen-PVA bioartificial polymers in vitro:The effects of cross-linking method and collagen content[J].Biomaterials,1998,19(1-3):1-11.
[26]You F,Li Y,Zuo Y,et al.The influence of γ-ray irradiation on the mechanical and thermal behaviors of nHA/PA66 composite scaffolds[J].The Scientific World Journal,2013,(8):162384.
[27]Yang H T,Tan Q,Zhao H.Progress in various crosslinking modification for acellular matrix [J].Chinese Medical Journal,2014,127(17):3156-3164.
[28]Jose M V,Thomas V,Dean D R,et al.Fabrication and characterization of aligned nanofibrous PLGA/Collagen blends as bone tissue scaffolds[J].Polymer,2009,50(15):3778-3785.
[29]唐屹,杨璐铭,徐建军,等.胶原蛋白/聚乙烯醇复合纤维的结构与性能[J].合成纤维工业,2007,30(2):7-10.
[30]王碧,廖立敏,李建凤,等.胶原蛋白/海藻酸/羧甲基纤维素共混膜的结构与性能[J].化学世界,2013,54(3):155-160,164.
[31]裴莹,郑学晶,汤克勇.胶原及明胶基天然高分子复合材料研究进展[J].高分子通报,2010,(2):58-68.
[32]张自强,张以河,安琪,等.胶原蛋白海绵对大鼠股主静脉创伤止血效果及组织相容性观察[J].转化医学杂志,2017,6(6):350-354.
[33]靳少锋,綦惠,舒雄,等.复合胶原海绵材料的体内外止血效果[J].中国组织工程研究,2018,22(2):216-221.
[34]魏志君,施春英,程连强,等.鱼胶原蛋白肽-透明质酸水凝胶制备及其生物相容性[J].青岛大学医学院学报,2017,53(5):600-603.
[35]Wang J K,Yeo K P,Chun Y Y,et al.Fish scale-derived collagen patch promotes growth of blood and lymphatic vessels,in vivo[J].Acta Biomaterialia,2017,(63):246-260.
[36]覃凤均,陈旭,李迟.胶原蛋白海绵治疗Ⅱ度烧伤创面的临床疗效研究[J].中国全科医学,2010,13(18):1994-1996.
[37]Jana P,Mitra T,Selvaraj T K R,et al.Preparation of guar gum scaffold film grafted with ethylenediamine and fish scale collagen,cross-linked with ceftazidime for wound healing application[J].Carbohydrate Polymers,2016,153:573-581.
[38]尚学峰,李新年,张玉苍,等.胶原蛋白/壳聚糖/纳米SiO2复合微球的制备与载药性能研究[J].化工新型材料,2016,44(3):245-248.
[39]杨涌,满孝会.胶原蛋白线一期缝合混合痔创面的临床观察[J].中国医药指南,2019,17(15):79-80.
[40]王征,于会,于尧,等.自体脂肪干细胞、壳聚糖/胶原蛋白支架材料及GDF-5复合物移植修复兔软骨缺损[J].中国组织工程研究,2018,22(25):3969-3974.
[41]秦雄,徐志飞,史宏灿,等.组织工程构建人工食管的初步实验研究[J].第二军医大学学报,2002,23(10):1134-1137.
[42]崔硕,张新营,海森,等.胶原蛋白线在显微外科的临床应用[J].中国医疗美容,2014,(2):92-93.
[43]徐海洋,徐昊,张丽,等.可吸收胶原蛋白线与丝线编织非吸收线在口腔种植中的应用[J].中国组织工程研究,2014,18(12):1877-1882.
[44]姚晖,杜昶,杨韶华,等.纳米羟晶/胶原仿生骨修复家兔颅颌骨缺损的实验研究[J].透析与人工器官,2000,11(2):5-8.
[45]冯庆玲,崔福斋,张伟.纳米羟基磷灰石/胶原骨修复材料[J].中国医学科学院学报,2002,24(2):124-128.
[46]孙秀娟,范代娣,朱晨辉,等.类人胶原蛋白-透明质酸血管支架的性能及生物相容性[J].生物工程学报,2009,25(4):591-598.
[47]赵东锷,李若冰,邱立成,等.应用胶原壳聚糖体外构建组织工程心脏瓣膜的初步研究[J].武警医学,2004,15(6):414-416.
[48]秦溪.鱼皮胶原为基质的胶原蛋白肠衣的制备及其性能研究[D].南宁:广西大学,2015.
[49]于林,陈舜胜,王娟娟,等.茶多酚改性胶原蛋白-壳聚糖复合膜对冷藏斜带石斑鱼的保鲜效果[J].食品科学,2017,38(3):220-226.
[50]王学川,商跃美,任龙芳,等.废皮胶原蛋白基造纸表面施胶剂的制备、表征及应用性能研究[J].功能材料,2016,47(3):3210-3214,3221.
[51]王培霖,李仲谨,丁金皓,等.戊二醛接枝共聚改性骨胶粘合剂的研究[J].中国胶粘剂,2010,19(5):1-3.
[52]苏秀霞,景洁,李仲谨,等.混合酸水解法合成新型改性骨胶及性能研究[J].中国胶粘剂,2011,20(4):5-9.
[53]卢加洪,罗祖源,廖学品,等.环氧树脂交联水解胶原蛋白制备复鞣填充剂[J].中国皮革,2013,42(17):1-4,10.
[54]贾鹏翔,汤克勇.胶原蛋白改性丙烯酸类复鞣剂的制备[J].精细化工,2006,23(8):801-808.





